Презентація уроку з хімії для 8 класу "Будова атома. Склад атомних ядер. Протонне число. Нуклонне число"



























Що ми знаємо про періодичний закон та періодичну систему?1. Періодичний закон відкрив російський вчений ….. 2. Це сталося у ……. 3. Періодичний закон за Д. І. Менделєєвим, полягає в тому, що властивості хімічних елементів та їх сполук перебувають у періодичній залежності від …4. Графічним відображенням періодичного закону є…
5. Основними структурними одиницями короткої форми періодичної системи є…6. Горизонтальний ряд хімічних елементів, що починається лужним металом і закінчується інертним газом, називається … 7. Періоди бувають…8. Всього в періодичній системі виділяється...періодів.9. Вертикальний стовпчик хімічних елементів у ПС має назву…
10. Всього в періодичній системі виділяється…груп11. Кожна група поділяється на …12. Підгрупа, до складу якої входять елементи і малих, і великих періодів, називається …13. Підгрупа, що містить тільки елементи великих періодів, є … 14. У групах у міру зростання відносних атомних мас хімічних елементів металічні властивості … 15. У періодах у міру зростання відносних атомних мас хімічних елементів металічні властивості …
1896 р. Беккерель випадково відкрив радіоактивність. Антуан Анрі Беккерель. Радіоактивність відкрив у 1896 році Антуан Анрі Беккерель. Сталося це випадково. Вчений працював із солями урану і загорнув свої зразки разом із фотопластинами в непрозорий матеріал. Фотопластини виявилися засвіченими, хоча доступу світла до них не було.1852 - 1908
Дослідження радіоактивних променів тісно пов’язані з іменами подружжя: польської дослідниці Марії Склодовської та її чоловіка — француза П’єра Кюрі.1859 - 1906 П'єр Кюрі Марія Склодовська-Кюрі1867 - 1934 У 1903 році П’єр Кюрі і Марія Склодовська-Кюрі разом одержали Нобелівську премію з фізики за відкриття радіоактивності. Після смерті чоловіка М. Склодовська-Кюрі продовжила дослідження й у 1911 році за одержання чистого Радію була удостоєна Нобелівської премії в галузі хімії.
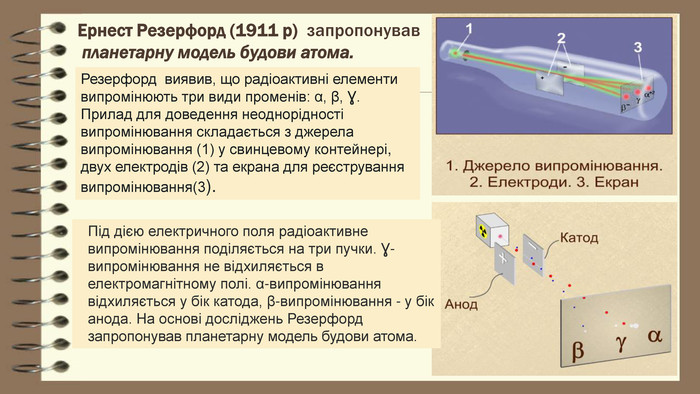
Ернест Резерфорд (1911 р) запропонував планетарну модель будови атома. Резерфорд виявив, що радіоактивні елементи випромінюють три види променів: α, β, Ɣ. Прилад для доведення неоднорідності випромінювання складається з джерела випромінювання (1) у свинцевому контейнері, двух електродів (2) та екрана для реєстрування випромінювання(3). Під дією електричного поля радіоактивне випромінювання поділяється на три пучки. Ɣ-випромінювання не відхиляється в електромагнітному полі. α-випромінювання відхиляється у бік катода, β-випромінювання - у бік анода. На основі досліджень Резерфорд запропонував планетарну модель будови атома.
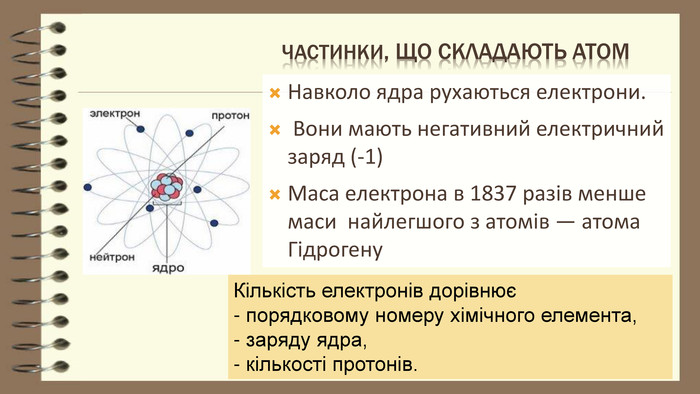
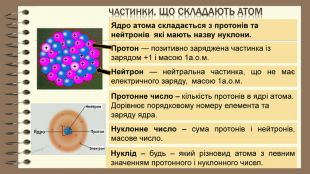
основні положення планетарної будови моделі атома1). У центрі атома знаходиться позитивно заряджене ядро, розмір якого в десятки тисяч разів менший за розмір атома 2). Весь позитивний заряд і майже вся маса атома зосереджена в ядрі ( маса електрона = 1/1836 а.о.м)3). Ядро атома складається з нуклонів: протонів та нейтронів. Число протонів (р+) дорівнює порядковому номеру елемента. Число нейтронів (n0) в ядрі дорівнює різниці відносної атомної маси та порядкового номера елемента. 4). Навколо ядра рухаються електрони (е). Їх число дорівнює порядковому номеру елемента. ядроелектрони
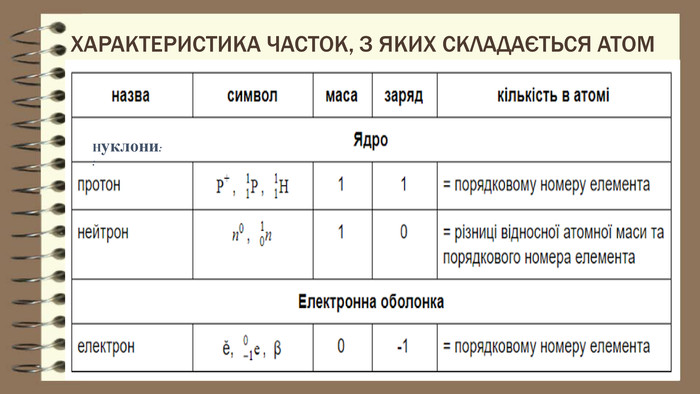
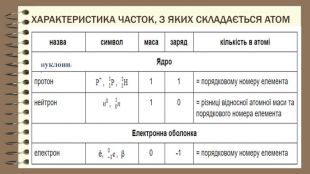
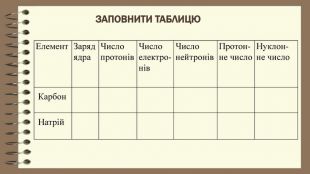
Частинки, що складають атом. Протон — позитивно заряджена частинка із зарядом +1 і масою 1а.о.м. Ядро атома складається з протонів та нейтронів які мають назву нуклони. Нейтрон — нейтральна частинка, що не має електричного заряду, масою 1а.о.м. Протонне число – кількість протонів в ядрі атома. Дорівнює порядковому номеру елемента та заряду ядра. Нуклонне число – сума протонів і нейтронів, масове число. Нуклід – будь – який різновид атома з певним значенням протонного і нуклонного чисел.
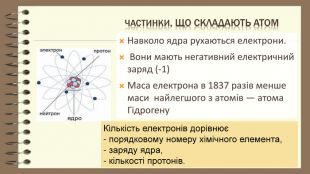
Частинки, що складають атом. Навколо ядра рухаються електрони. Вони мають негативний електричний заряд (-1) Маса електрона в 1837 разів менше маси найлегшого з атомів ― атома Гідрогену Кількість електронів дорівнює - порядковому номеру хімічного елемента, - заряду ядра, - кількості протонів.
Періодичний закон, сформульований Д.І. Менделєєвим у 1869 р. Властивості хімічних елементів, а тому властивості утворених ними простих і складних речовин перебувають у періодичній залежності від величини атомних мас елементів. Порядковий номер = = заряд ядра атома = кількість протонів = кількість електронів Сучасне формулювання періодичного закону. Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів.


про публікацію авторської розробки
Додати розробку



























-

Крамар Світлана
12.10.2023 в 21:48
щиро дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Щербій Вікторія
23.09.2023 в 12:28
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Процюк Лариса Вікторівна
10.04.2023 в 00:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Куценко Свiтлана
24.09.2022 в 19:40
Дукую за вашу працю.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук