Конспект уроку з хімії для 8 класу "Енергетичні рівні та підрівні. Їх заповнення електронамив атомах хімічних елементів № 1- 20
Автор: вчитель хімії Новоукріїнської ЗОШ № 3 Варона Людмила Миколаївна
8клас Урок №10 Тема. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20
Мета
навчальна: уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I—III періодів; формувати вміння учнів
визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу.
розвиваюча: розвивати творчі здібності учнів, уважність,
виховна: сприяти розширенню політехнічного світогляду учнів, виховувати любов до предмету.
Тип уроку: засвоєння нових знань, формування вмінь і навичок
Форми роботи: евристична бесіда , фронтальна робота з класом , практичне використання знань, умінь та навичок.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, кубик, мультимедійна презентація.
Хід уроку
І. Актуалізація опорних знань.
Фронтальна бесіда
- Як побудований атом?
- Що таке – електрон?
- В чому особливість руху електрона навколо ядра?
- Що таке орбіталь?
- Чим відмінні електронні орбіталі?
- Які форми може мати електронна хмара?


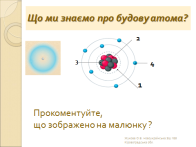
ІІ. Мотивація навчальної діяльності.
Під час хімічних реакцій ядро атома не змінюється, а змін зазнають оболонки атома, які називають електронними оболонками. Знаючи будову електронних оболонок можна пояснити властивості хімічних елементів. Тому під час вивчення хімії велика увага приділяється вивченню будови електронних оболонок атомів.
Сьогодні ми поглибимо ваші знання про будову електронних оболонок атомів елементів,навчимось складати електронні та електронно-графічні формули елементів
ІІІ. Вивчення нового матеріалу
І. Зв’язок між будовою атома та його положенням у періодичній системі
Знаючи положення елемента у періодичній системі можна визначити будову його атома
- Заповнимо таблицю(фронтальна робота з класом):
|
Поняття в періодичній системі |
Зв’язок з будовою атома |
|
І. Порядковий номер елемента |
1. Заряд ядра 2. Кількість протонів 3. Кількість електронів |
|
ІІ. Номер періоду |
Кількість електронних шарів (енергетичних рівнів) |
|
ІІІ. Номер групи |
Кількість електронів на зовнішньому шарі для елементів головних підгруп |
- Тренувальні вправи. Відповіді пальцями долоні або на файлах фломастерами.
Яку будову має атом магнію?
- Порядковий номер 12, тому заряд ядра +12, у ядрі 12 протонів, навколо ядра обертаються 12 електронів.
- 3 період, тому електрони рухаються по 3 шарам
- 2 група головна підгрупа, тому на зовнішньому енергетичному рівні (шарі) знаходиться 2 електрона
ІІ. Поняття про енергетичні рівні
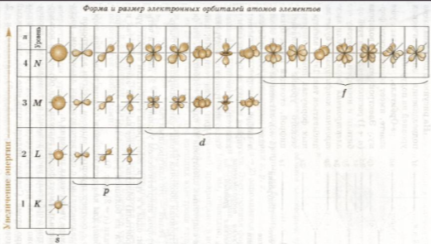
1. Орбіталі характеризуються не тільки формою, але й енергією. Декілька орбіталей, що мають рівну або близьку енергію, утворюють енергетичний рівень або енергетичний шар.
Отже, в електронній оболонці електрони розташовуються шарами – електронними шарами (енергетичними рівнями).
2. Виділяють 7 рівнів.
Енергетичний рівень позначають арабськими цифрами від 1 до 7 (n = 1, 2, 3, 4, … 7) або великими літерами латинського алфавіту K, L, M, N, O, P Q.
Номер періоду, в якому розміщений хімічний елемент, вказує на кількість енергетичних рівнів (шарів), по яких рухаються електрони.
 Наприклад.
Наприклад.
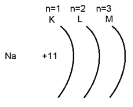 Хімічний елемент Натрій розташований в третьому періоді, який вказує на наявність трьох енергетичних рівнів для атома Натрію (1, 2, 3).Таку ж кількість рівнів мають атоми елементи цього періоду. (Mg, Al, Si, P, Cl, Ar).
Хімічний елемент Натрій розташований в третьому періоді, який вказує на наявність трьох енергетичних рівнів для атома Натрію (1, 2, 3).Таку ж кількість рівнів мають атоми елементи цього періоду. (Mg, Al, Si, P, Cl, Ar).
3. Чим ближче до ядра розміщений енергетичний рівень, тим меншим запасом енергії наділені його електрони.
Електрони, що рухаються на віддаленішому від ядра енергетичному рівні, мають більший запас енергії.
ІІІ. Розподіл електронів на енергетичних рівнях
На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2
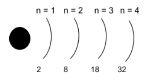 n =1, N = 2∙12 = 2
n =1, N = 2∙12 = 2
n = 2, N = 2∙22 = 8
n = 3, N = 2∙32 =18
n = 4, N = 2∙42 =32
На першому енергетичному рівні може бути не більше 2 електронів
на другому не більше 8
на третьому не більше 18
на четвертому не більше 32
ІV. Поняття про підрівні
1. За формою і енергією атомних орбіталей електрони одного рівня поділяються на підрівні.
Число енергетичних підрівнів дорівнює номеру енергетичного рівня .
Підрівні позначаються так само, як і орбіталі (s, p, d, f).
2. Схема електронної будови атома
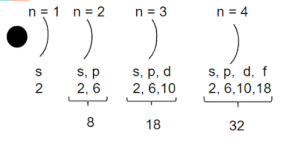
- перший енергетичний рівень складається з одного s-підрівня, утвореного однією s-орбіталлю; максимальна ємність рівня – 2 електрони;
-другий рівень складається з двох підрівнів (s i p), утворених однією s-орбіталлю і трьома p-орбіталями (всього чотири); максимальна ємність рівня – 8 електронів;
-третій рівень складається з трьох підрівнів (s, p, i d), утворених однією s-орбіталлю, трьома р-орбіталями і п’ятьма d-орбіталями (всього девять); максимальна ємність рівня – 18 електронів;
- четвертий енергетичний рівень складається з чотирьох підрівнів (s, p, d, f), утворених однією s-орбіталлю, трьома р-орбіталями , п’ятьма d-орбіталями і сімома орбіталями( всього шістнадцять); максимальна ємність рівня – 32 електрони.
V. Електронна формула
Заповнення електронами енергетичних рівнів і підрівнів відображають за допомогою електронних і графічних електронних формул атомів.
1. Електронна формула атома – це запис розподілу електронів в атомі за допомогою коефіцієнтів, якими позначаються енергетичні рівні (1, 2, 3 …7), символів підрівнів (s, p, d, f) та верхніх індексів, що дорівнюють числу електронів на підрівні.
Наприклад
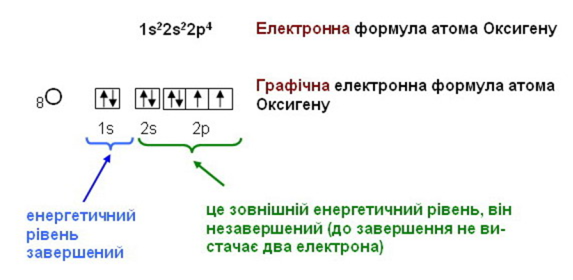
- Електронна формула атома Гелію:
1s2 (читається один-ес-два) позначено перший енергетичний рівень з наявним одним s-підрівнем, заповненим двома електронами, тобто рівень завершений .
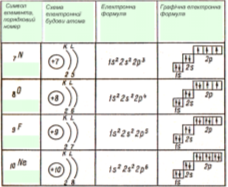
- Електронна формула атома Нітрогену
1s22s22р3 (читається один-ес-два-два-ес-два-два-пе-три) позначено перші два енергетичні рівні: на першому рівні міститься два s-електрони, на другому – два s-електрони та три р-електрони (це електронна формула атома Нітрогену)
- Електронна формула атома Калію 39K 1s22s22p63s23p64s1.
2. Правила заповнення електронами енергетичних рівнів і підрівнів
1). Спочатку електронами заповнюється перший енергетичний рівень, потім другий, і тільки після остаточного заповнення другого енергетичного рівня розпочинається заповнення третього рівня.
2).У межах одного енергетичного рівня першим заповнюється s-підрівень, другим – p-підрівень.
3). На одній орбіталі не буває більше двох електронів.
4). Електрони заповнюють орбіталі спочатку по одному, а якщо електронів більше за число орбіталей, то по два.
5). Число електронів в атомі дорівнює порядковому номеру елемента.
Енергетичні рівні, заповнені максимально можливою для них кількістю електронів називаються завершеними, а енергетичні рівні з меншою кількістю електронів – незавершеними.
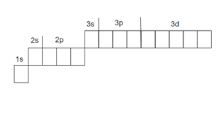
VІ. Графічна електронна формула
1. Графічно орбіталь позначають квадратиком, який має назву енергетичної комірки.
Електрони, які рухаються по орбіталях позначають у вигляді стрілок, спрямованих вгору або вниз, що наочно позначає направлення спіну електрона.
![]()
- вільна (вакантна) орбіталь;
![]() - орбіталь, що містить один електрон, такий електрон називають неспареним;
- орбіталь, що містить один електрон, такий електрон називають неспареним;
![]() - заповнена орбіталь, що містить два електрони з протилежними спінами; такі електрони називаються спареними.
- заповнена орбіталь, що містить два електрони з протилежними спінами; такі електрони називаються спареними.
 Згідно з сучасною теорією будови атома на одній орбіталі не може бути більше двох електронів.
Згідно з сучасною теорією будови атома на одній орбіталі не може бути більше двох електронів.
s-підрівень містить лише одну s-орбіталь ( ![]() ), на ньому можливе перебування двох s-електронів;
), на ньому можливе перебування двох s-електронів;
р-підрівень містить три р-орбіталі ( ![]()
![]()
![]() ), тому на ньому може перебувати максимально шість р-електронів;
), тому на ньому може перебувати максимально шість р-електронів;
d-підрівень налічує п’ять орбіталей ( ![]()
![]()
![]()
![]()
![]() ), максимальне число d-електронів – 10;
), максимальне число d-електронів – 10;
f-підрівень налічує сім орбіталей ( ![]()
![]()
![]()
![]()
![]()
![]()
![]() ), для їх заповнення знадобиться чотирнадцять f-електронів
), для їх заповнення знадобиться чотирнадцять f-електронів
2. Графічна електронна формула – це відображення розподілу електронів за енергетичними комірками.
1Н ![]() Графічна електронна формула атома Гідрогену
Графічна електронна формула атома Гідрогену
|
|
|
|
|
|
3S1 |
3P0 |
3d0 |
||||||
|
|
2S2 |
2P6 |
↑ |
|
|
|
|
|
|
|
|
||
|
1S2 |
↑↓ |
↓↑ |
↑↓ |
↓↑ |
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
11Na
Графічна електронна формула атома Натрію
VІІ.Алгоритм складання електронних і графічних електронних формул атомів хімічних елементів
1. Визначити загальне число електронів у атомі (вказує порядковий номер елемента).
2. Визначити число енергетичних рівнів (вказує номер періоду).
3. Записати можливі підрівні в межах рівня.
4. Дотримуючись правил заповнення електронами енергетичних рівнів та підрівнів, записати електронну формулу атома.
ІV. Закріплення набутих знань, формування умінь і навичок
Для того, щоб ви навчилися записувати електронні і графічні електронні формули атомів, ви повинні дотримуватись даного алгоритму.
![]() 1Н ) 1Н 1S1 1Н
1Н ) 1Н 1S1 1Н
![]() 1е
1е
![]() 2Не ) 2Не 1S2 2Не
2Не ) 2Не 1S2 2Не
![]() 2е
2е
|
|
2S1 |
2Р0 |
||
|
1S2 |
↑ |
|
|
|
|
↓↑ |
|
|
|
|
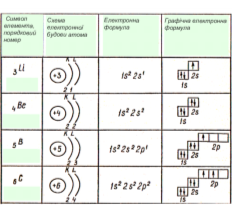
3Li ) ) 3Li1S22S1 3Li
2е 1е
|
|
2S |
2Р3 |
||
|
1S2 |
↑↓ |
↓ |
↓ |
↓ |
|
↓↑ |
|
|
|
|
![]()
7N ) ) 7N 1S22S22Р3 7N
![]() 2е 5е
2е 5е
17Cl ) ) ) 17Cl 1S22S22Р63S23Р5
2е 8е 7е
|
|
|
|
|
|
3S2 |
3P5 |
3d0 |
||||||
|
|
2S2 |
2P6 |
↑↓ |
↓↑ |
↑↓ |
↑ |
|
|
|
|
|
||
|
1S2 |
↑↓ |
↓↑ |
↑↓ |
↓↑ |
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
17 Cl
![]()

|
|
|
|
|
|
3S1 |
3P0 |
3d0 |
||||||
|
|
2S2 |
2P6 |
↑ |
|
|
|
|
|
|
|
|
||
|
1S2 |
↑↓ |
↓↑ |
↑↓ |
↓↑ |
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Графічна електронна формула атома Натрію
V. Підбиття підсумків уроку. Оцінювання учнів.
VI. Домашнє завдання:
Підручник 8 кл П.П. Попель Л.С.Крикля §6,7. стор. 34- 43 вивчити,
стор. 32-34 повторити.
Побудуйте схему будови атомів з порядковими номерами №8, №16, запишіть їх електронну формулу, розподіл електронів по квантових комірках.
-
Дякую Вам за роботу!
-
-
Дякую


про публікацію авторської розробки
Додати розробку
