Презентація до уроку з хімії для 8 класу "Енергетичні рівні та підрівні. Їх заповнення електронамив атомах хімічних елементів № 1- 20"
Про матеріал
Презентація до уроку з хімії для 8 класу "Енергетичні рівні та підрівні. Їх заповнення електронамив атомах хімічних елементів № 1- 20" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


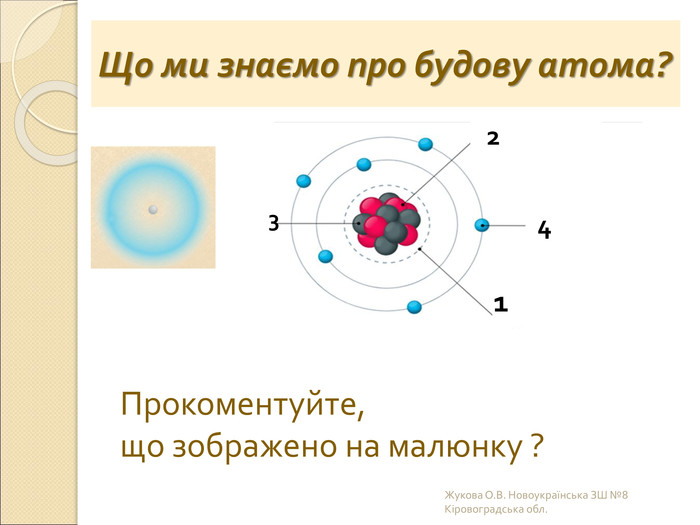

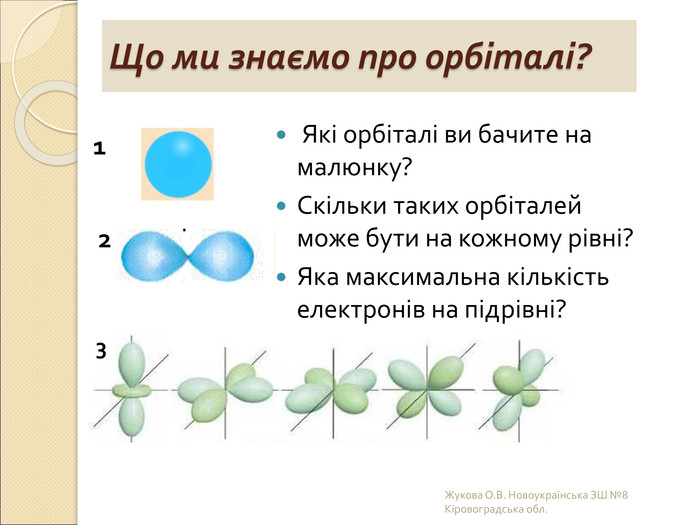





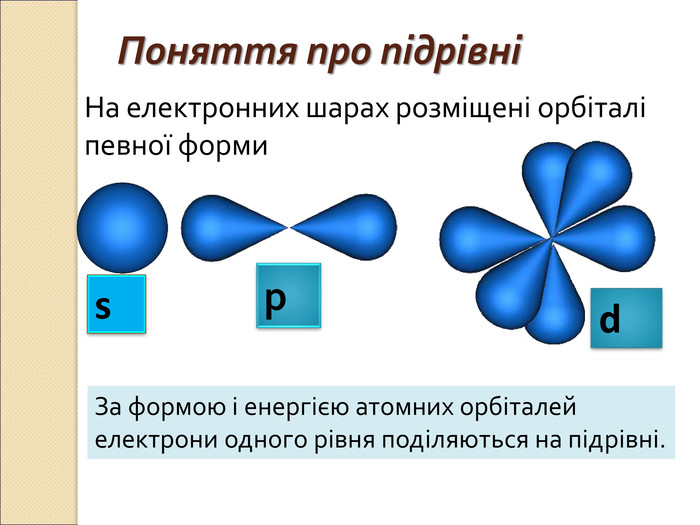
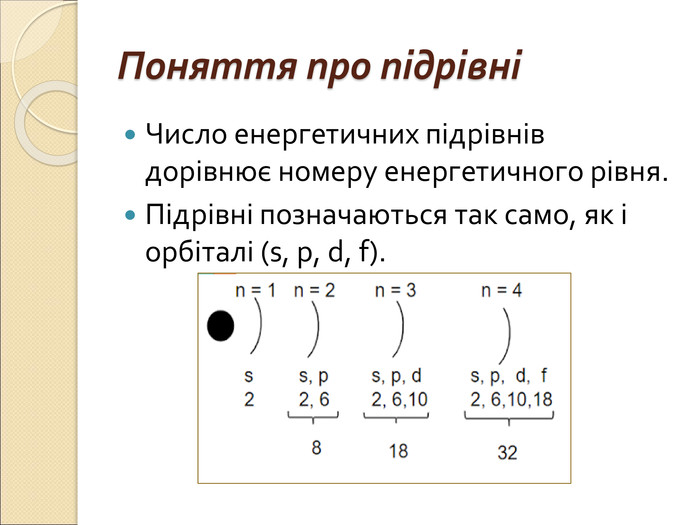

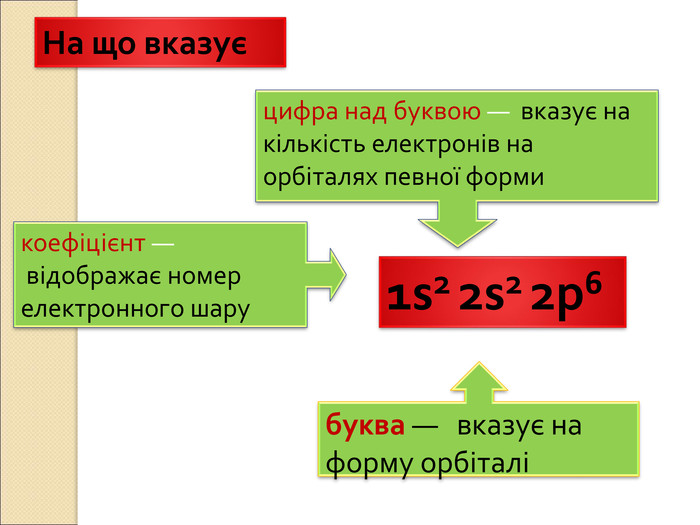
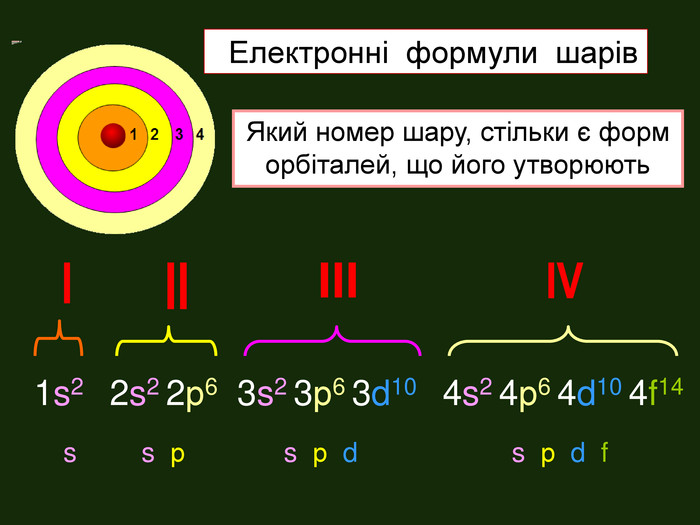

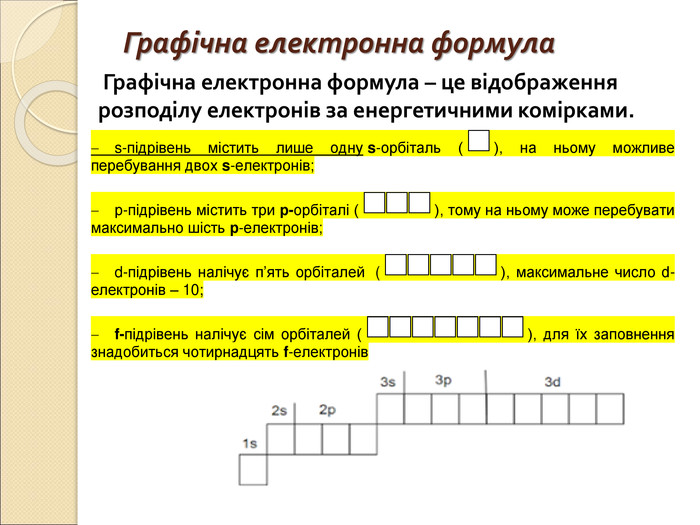
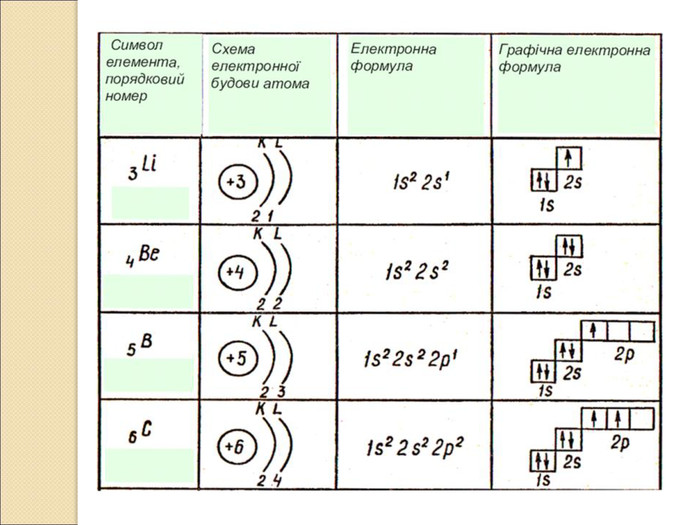
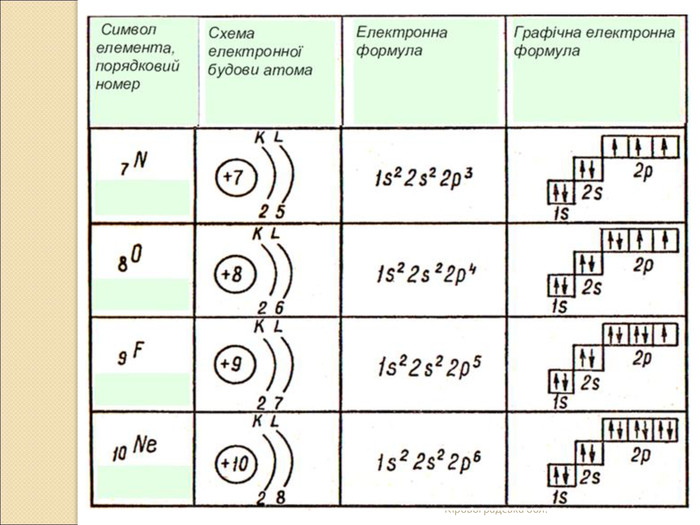
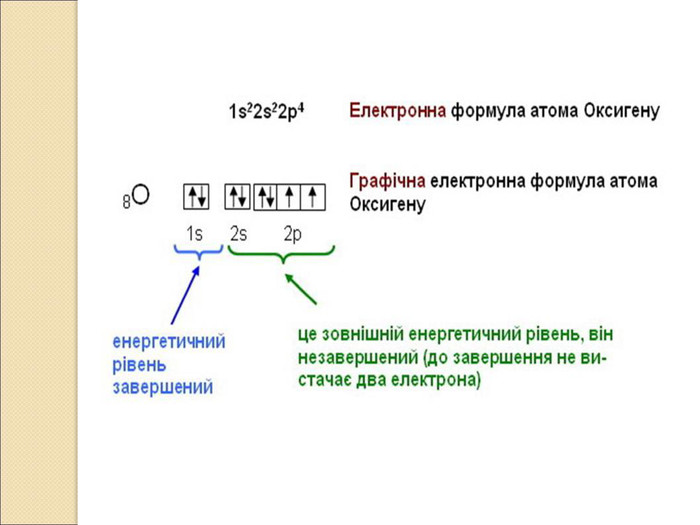



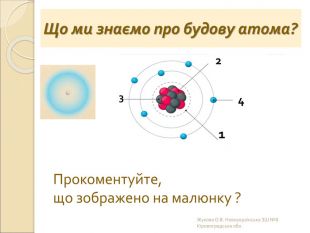







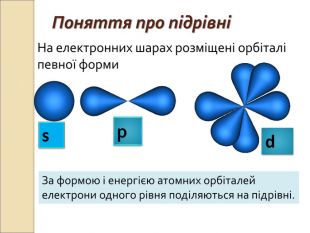
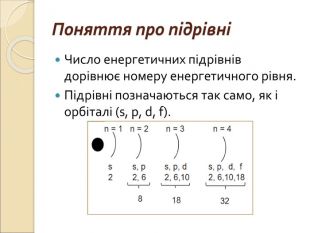

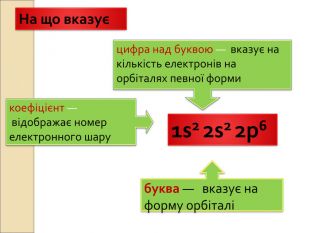
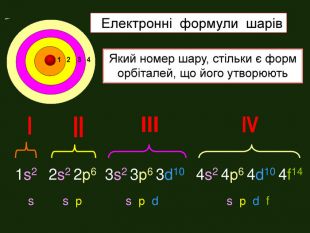

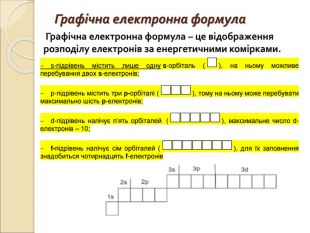
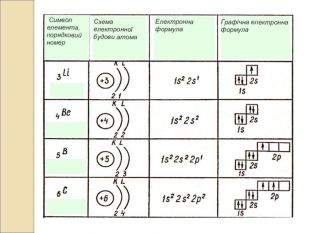
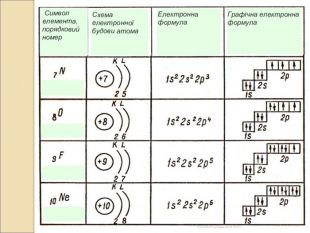
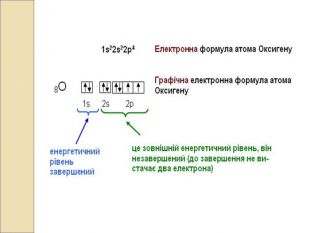


-

Лаптєва Інна
15.10.2024 в 11:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
23.09.2024 в 18:42
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пономаренко Ліна Володимирівна
13.10.2023 в 01:41
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костіна Неля Миколаївна
24.09.2023 в 08:39
Дякую за роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ципльонок Валентина Володимирівна
10.10.2022 в 20:26
Дякую за роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ivanenko Olena
26.09.2022 в 20:59
Щиро дякую. Ваша презентація допомогла в підготовці до уроку.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Казімко Ольга Сергіївна
24.09.2022 в 17:08
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ящук Юлія Леонідівна
09.07.2022 в 15:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Оксана Михайлівна
27.10.2020 в 22:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків