Конспект уроку з хімії для 8 класу " Будова електронних оболонок атомів та йонів. Основний та збуджений стан атома"
Автор: Вчитель хімії Новоукраїнської ЗОШ №3 Ворона Людмила Миколаївна
Урок №12 .Тема. Будова електронних оболонок атомів та йонів. Основний і збуджений стан атома. Особливості заповнення електронних оболонок елементів великих періодів.
Мета:
навчальна: продовжити формувати уміння і навички складати електронні і графічні електронні формули, навчити записувати електронні конфігурації атомів та йонів, а також атомів в основному і збудженому станах; познайомити з особливостями заповнення електронних оболонок у елементів великих періодів.
розвиваюча: розвивати пізнавальний інтерес, увагу, логічне мислення.
виховна: оволодівати вмінням працювати злагоджено на уроці, індивідуально і в колективі..
Тип уроку: комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Форми роботи:
фронтальна робота з класом, бесіда, перевірка знань у формі гри з кубиком,
практичне використання знань, умінь та навичок.
Обладнання: періодична система, мультимедійна презентація, кубик.
Хід уроку
І. Актуалізація опорних знань.
1. Повторення основних питань у формі гри з кубиком.
1) Як побудований атом?
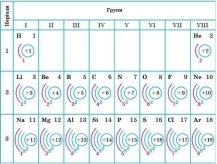
2) Що можна визначити в будові атома за відомим порядковим номером? (заряд ядра, кількість протонів, кількість електронів)
3) Що можна визначити в будові атома за відомим порядковим номером періода? (кількість енергетичних рівнів)
4) Що можна визначити в будові атома за відомим номером групи? ( кількість електронів на зовнішньому енергетичному рівні для елементів головних підгруп)
2. Перевірка домашньої вправи
№48 а) Не (Гелій), б) Na(Натрій) , в) F (Флуор), г) Na(Натрій).
ІІ. Мотивація навчальної діяльності.
Ми навчилися писати електронні конфігурації для атомів елементів малих періодів. А як відбувається цей процес у атомів елементів великих періодів? Ми знаємо, як записуються електронні конфігурації для атомів, а як записати їх для йонів? Нарешті, ви вже чули, що атоми можуть бути в основному і збудженому стані. Сьогодні ми познайомимося, як записуються графічні електронні конфігурації для атомів в основному і збудженому станах.
ІІІ. Вивчення нового матеріалу
І. При складанні електронної формули атома будь-якого елемента корисно пам’ятати декілька очевидних закономірностей:
- Загальна кількість електронів в атомі дорівнює порядковому номеру елемента.
- Загальна кількість енергетичних рівнів відповідає номеру періоду, в якому розміщується елемент.
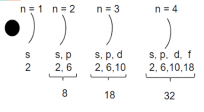
- Енергетичні рівні розщеплюються на енергетичні підрівні (S, P, d, f). Кількість енергетичних підрівнів на даному рівні співпадає з номером цього рівня.
- Енергетичні підрівні складаються з орбіталей.
Одна орбіталь s-підрівня:
Три орбіталі p-підрівня:
П’ять орбіталей d-підрівня
Сім орбіталей f-підрівня:

ІІ. Заповнення електронами енергетичних рівнів атомів елементів
малих періодів.
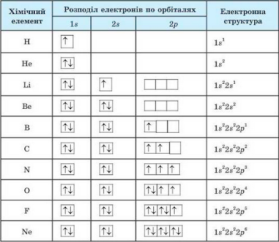
 1. Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра і зростанням їх енергії.
1. Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра і зростанням їх енергії.
Першим заповнюється перший енергетичний рівень, потім другий, і тільки після остаточного заповнення другого енергетичного рівня
розпочинається заповнення третього рівня.
2.У межах одного енергетичного рівня першим заповнюється s-підрівень, другим – p-підрівень.
3. На одній орбіталі не буває більше двох електронів.
4. Електрони заповнюють орбіталі спочатку по одному, а якщо електронів більше за число орбіталей, то по два.
ІІІ. Заповнення електронами енергетичних рівнів атомів елементів
великих періодів.
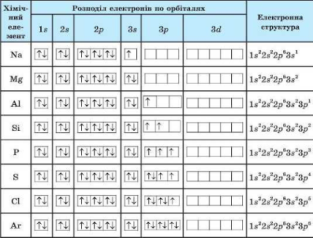
- Заповнення електронами енергетичних рівнів у елементів великих періодів відбувається також в порядку зростання енергії електронів.
- Наприклад, у елементів 4 періоду спочатку заповнюється
4S-підрівень (К та Са), а потім 3d – підрівень.
Причина такої послідовності полягає у тому, що, підрівень 4s характеризується більш низькою енергією, ніж підрівень 3d. Тому такий стан зовнішніх електронів Калія і Кальція більш стійкий.
19К ) ) ) ) 19К 1S22S22P63S23Р64S1 або [Ar] 4S1
2е 8е 8е 1е
|
|
|
|
|
|
|
|
|
4S1 |
|
||||||
|
|
|
|
|
|
3S2 |
3P6 |
3d0 |
↑ |
|
||||||
|
|
2S2 |
2P6 |
↑↓ |
↓↑ |
↑↓ |
↑↓ |
|
|
|
|
|
|
|
||
|
1S2 |
↑↓ |
↓↑ |
↑↓ |
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
20Са ) ) ) ) 20Са 1S22S22P63S23Р64S2 або [Ar] 4S2
2е 8е 8е 2е
|
|
|
|
|
|
|
|
|
4S2 |
|
||||||
|
|
|
|
|
|
3S2 |
3P5 |
3d0 |
↑↓ |
|
||||||
|
|
2S2 |
2P6 |
↑↓ |
↓↑ |
↑↓ |
↑↓ |
|
|
|
|
|
|
|
||
|
1S2 |
↑↓ |
↓↑ |
↑↓ |
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
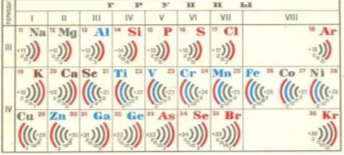
- У наступних елементів, це елементи побічних підгруп, заповнюється 3d – підрівень. Після його заповнення починається заповнення 4Р- підрівня.
ІV. Електронна будова йонів
Атом - найдрібніша частинка хімічного елемента, що складається з ядра й електронів.
Йон – це заряджена частинка, в яку перетворюється атом, віддаючи або приймаючи електрони.
Атоми металів віддають валентні електрони і перетворюються на позитивно заряджені йони.
3Li ) ) 3Li 1S22S1 атом літію,
2е 1е
3Li+ ) 3Li 1S2 (або 1S22S0) йон літію
2е
12Mg ) ) ) 12Mg 1S22S22P63S2 атом магнію
2е 8е 2е
12Mg2+ ) ) 12Mg2+ 1S22S22P6 (або 1S22S22P63S0) йон магнію
2е 8е
Атоми неметалів приймають електрони і перетворюються на негативно заряджені йони.
9F ) ) 9F 1S22S22P5 атом флуору
2е 7е
9F- ) ) 9F - 1S22S22P6 йон флуору
2 е 8е
16S ) ) ) 16 S 1S22S22P63S2 3Р4 атом сульфуру
2е 8е 6е
16S2- ) ) ) 16 S2- 1S22S22P63S2 3Р6 йон сульфуру
2е 8е 8е
V. Основний і збуджені стани атома
Якщо атом має вакантні електронні орбіталі на останньому рівні, то під час утворення хімічного зв’язку з іншими атомами він здатний переходити в збуджений стан, коли енергія зовнішніх електронів зростає, а спарені електрони розпаровуються і переходять на вільні орбіта лі. У такому разі кількість неспарених електронів збільшується і зростає валентність елемента.
|
2S2 |
2P2 |
|
|
|
↓↑ |
↑ |
↑ |
|
C основний стан атома ( незбуджений стан)
![]()
![]()
![]()
|
2S1 |
2P3 |
|
|
|
↑ |
↑ |
↑ |
↑ |
С* збуджений стан атома
|
3S2 |
|
3p4 |
|
|
|
3d0 |
|
|
|
|
↓↑ |
↑ |
↑ |
|
|
|
|
|
S основний стан атома (незбуджений стан)
![]()
![]()
![]()
|
3S2 |
|
3p3 |
|
|
|
3d1 |
|
|
|
↑↓ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
S*
збуджений стан атома
|
3S1 |
|
3p3 |
|
|
|
3d2 |
|
|
|
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
збуджений стан
S** атома
Можливі валентності Сульфуру ІІ, ІV , VІ (відповідно до кількості неспарених електронів)
VІ. Підведення підсумків уроку.
V. Домашнє завдання
Повторити § 6,7, вивчити конспект.
Виконати вправу: Написати електронну конфігурацію атома та йона для елементів з порядковими номерами №13, № 17.


про публікацію авторської розробки
Додати розробку
