Тема. « Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали». Урок присвячено 150 роковинам від відкриття Періодичного закону Дмитра Івановича
Тема: Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали.
Урок присвячено 150 роковинам від відкриття Періодичного закону Дмитра Івановича Менделєєва
Мета уроку:
- навчальна - ознайомитися з основними історичними фактами, пов'заними із відкриттям періодичного закону та створення періодичної системи хімічних елементів Д.І. Менделєєва;
- розвиваюча – формувати ключові природничі компетенції, розуміння термінів «період», «група», «підгрупа», усвідомлення взаємозв'язку між розміщенням лужних металів та подібністю їх властивостей;
- виховна – виховувати комунікативність, увагу, партнерське співробітництво та працелюбність і цілеспрямованість на прикладі наукового подвигу Д.І.Менделєєва.
Тип уроку. Засвоєння знань.
Методи та техніки. Веббінг, сторітелінг, демонстрація, навчальна гра
« Хімічне лото», робота за схемою, робота по варіантах.
Наочність. Табл. «Правила техніки безпеки», періодична таблиця елементів,виставка літератури про Д.І.Менделєєва, друковані саморобні картки «Хімічне лото».
Обладнання та матеріали: кристалізатор, пінцет, ніж, вода, фенолфталеїн, контейнери з літієм та натрієм.
Очікувані результати. Учень
◙ відтворює основні етапи життєвого та наукового шляху Д.І.Менделєєва;
◙ розуміє поділ періодичної таблиці на періоди та групи;
◙ розрізняє головну та побічну підгрупи;
◙ називає лужні елементи;
◙ спостерігає та описує їх фізичні властивості;
◙ усвідомлює зміну хімічних властивостей у групі, планує і проводить експеримент;
◙ записує рівняння реакцій лужних металів з киснем, водою.
Структура уроку
- Організація класу. 3хв.
- Мотивація навчальної діяльності. 4хв.
- Засвоєння знань 10хв.
- Творчий розвиток. 14хв.
- Підсумки. Релакс. 10хв.
- Домашнє завдання. 4хв.
Хід уроку
І. Організація класу. Повідомлення теми, мети та завдань на урок.
8 лютого 1834 року народився вчений, ім'я якого ми згадуємо практично на кожному уроці хімії. Це – Дмитро Іванович Менделєєв. Першого березня 1869 року молодий, тоді ще маловідомий російський учений Д.І.Менделєєв розіслав багатьом ученим – хімікам різних країн – невеликий друкований аркуш під заголовком: «Випробування системи елементів, яка грунтується на їх атомній масі та хімічній подібності».
Сучасники ще не підозрювали, що в науці сталася велика історична подія: у хаосі різних відомостей про природу і властивості хімічних елементів та їх сполук встановилися ясність і порядок.
Питання про методи роботи Дмитра Івановича дуже цікаве та важливе. Багато серйозних наукових досліджень були присвячені історії відкриття Менделєєва. За словами самого вченого, це було зовсім просто: треба було тільки розташувати всі елементи в ряд за збільшенням їх атомних мас – і періодична повторюваність цих атомних мас та хімічних властивостей елементів відразу себе виявили. Чи так це було насправді?
ІІ. Мотивація навчальної діяльності. Визначення завдань.
В дитинстві нас з вами завжди супроводжували цікаві казки. Сьогодні ми розпочнемо знайомство з ще однією хімічною казкою. І розпочнемо це знайомство загадкою.
Не за горами, не за долами,
Не на Марсі, а у класі
живуть собі сім братів
та вісім сестер.
Кожна має по дві дочки,
А п'ять братів по два синочки.
Ми маєм з вами розгадати,
Як цю сім’ю хімічну звати.
Якщо ти хімію вивчаєш,
Загадку швидко відгадаєш.
(Періодична таблиця)
Отже, наше завдання – вивчити царство хімічних елементів, розібратись з будовою періодичної таблиці та зрозуміти, про яких сестер і братів велась мова у загадці. Ви з попереднього класу вмієте користуватись періодичною таблицею. Пригадаємо, що вам про неї відомо.
◙ читання назв та символів елементів;
◙ визначення відносної атомної маси елемента;
◙ місце знаходження елементів: металів та неметалів;
◙ записи формул вищих оксидів елементів;
◙ визначення валентності у сполуках з Оксигеном і Гідрогеном.
Далі ми дослідимо, чому елементи саме так розміщені у періодичній таблиці, чи є певний зв'язок між властивостями елементів та їх розміщенням у даній таблиці, скільки ще інформації можна з неї почерпнути. Отож, якщо ви озброїтесь увагою та працьовитістю, то зрозумієте, що періодична таблиця – це універсальна підказка і шпаргалка для учня на весь період вивчення хімії у школі.
ІІІ. Засвоєння та первинне осмислення знань.
А. Основні історичні факти класифікації елементів.
До 1750 року було відомо 15 хімічних елементів. У наступні 50 років було відкрито ще 20, тобто їх стало удвічі більше. На першу половину ХІХ ст. (1801-1850 рр.) припадає відкриття ще 24 хімічних елементів. У 1869 р. кількість відомих хімічних елементів сягнула 63, а речовин – сотні тисяч. Виникла потреба у їх класифікації, оскільки хіміки спостерігали подібність у властивостях деяких хімічних елементів та їх сполук.
Перша класифікація хімічних елементів датується 1786 – 1787 роками. Її автором став Антуан Лавуазьє. Який поділив відомі на той час елементи на метали і неметали.
Прошу нагадати :
◙ Який елемент утворює кисень?(Оксиген)
◙ Який елемент обов'язково присутній в молекулах кислот?(Гідроген)
Відгадайте , який елемент ховається у загадці:
Струму добрий провідник,
В світі третій мандрівник.
З букви А я починаюсь,
Срібно – білий я й згинаюсь.
А іще зовусь «крилатим»…
В третю групу завітати
У таблицю маєш ти,
Щоб ім'я моє знайти.(Алюміній)
Виділіть з названих елементів окремо метали, окремо неметали.
Продовжимо наш історичний екскурс. У 1829 р. німецький хімік Йоган Деберейнер поділив елементи на тріоди, відповідно до подібностей їх властивостей. У 1863р. англійський хімік Джон Ньюлендс звернув увагу на те, що властивості елементів періодично повторюються. У 1864 р. німецький хімік Лотар Мейєр розмістив елементи за зростанням атомних мас і розділив на 6 груп за валентністю. Він найближче підійшов до відкриття періодичного закону. У 1869 році завдяки пошуку закономірностей у зміні властивостей елементів, російському хіміку Дмитру Івановичу Менделєєву вдалося відкрити загальний закон природи – періодичний закон, який став основою для організації хімічних елементів у періодичну таблицю.
Б. Поняття про лужні метали.
Користуючись періодичною таблицею, визначте назви лужних металів та поясніть, скориставшись Вікіпедією, назву «Лужні». Отож,
◙ у якій групі знаходяться дані елементи?
◙ пригадайте, що ми вчили про основи, та вкажіть формули відповідних гідроксидів;
Демонстрація. Фізичні властивості лужних металів.( на прикладі Літію та Натрію):
◙ м'які, легко ріжуться ножем,
◙ сріблясто – білий колір.( звернути увагу школярів, що натрій пластичніший).
Таким чином, із зростанням відносної атомної маси знижується температура плавлення і кипіння.(знайти за допомогою мобільних пристроїв відповідні дані і порівняти їх)
ІV. Творчий розвиток знань.
Ознайомимось із хімічними властивостями лужних металів. Та пригадаємо правила техніки безпеки при виконанні хімічного експерименту.
Демонстрація. Взаємодія Літію та Натрію з водою.
У кристалізатори наливаємо по 20 мл води. Добавляємо по 2 краплі фенолфталеїну. З контейнерів послідовно виймаємо шматочки металів та відрізаємо ножем, обов'язково звертаємо увагу на швидке потемніння металів і на те, що Натрій різати легше. Опускаємо метали у кристалізатори.
Спостерігаємо взаємодію, виділення газу, утворення малинових «хвостів» в кристалізаторах. Реакція Натрію є активнішою.
2 Na + 2H2O = 2NaOH + H2 ↑
2Li + 2H2O = 2LiOH + H2 ↑
Висновок. Лужні метали взаємодіють з водою, утворюючи відповідні луги та водень. Швидке потемніння металу на повітрі вказує на його взаємодію із киснем та утворення оксидів. В періодичній таблиці, як ви вже знаєте, є рядок із загальними формулами вищих оксидів.
Завдання.
Варіант 1. Записати рівняння реакцій взаємодії калію та цезію з водою і киснем. Назвати продукти обох реакцій.
Варіант 2. Записати рівняння реакцій взаємодії рубідію та францію з водою і киснем. Назвати продукти обох реакцій.
Тому запишемо рівняння реакцій, що відповідають такій схемі
Cl2
↑
O2 ← Na → S
↓
H2О
2 Na + 2H2O = 2NaOH + H2 ↑
2 Na + Cl2 = 2 NaCl
4 Na + O2 = 2 Na2О
2 Na + S = Na2S
Вчитель пояснює учням особливості гідридів та нітридів металів.(Цю інформацію можна задати як навчальне домашнє дослідження). Назви інших сполук вони вказують самостійно.
V. Підсумки . Релакс.
Вкажіть дату народження Д.І.Менделєєва.
Знайдіть в періодичній таблиці елемент, назва якого присвячена вченому та визначте номери групи, періоду, до якої родини він належить. На дошці запишіть прізвище вченого та створіть кластерне завдання, наприклад, про металічні елементи, які мають важливе значення для людини:
Магній – «антистресовий»,
Ферум – «ворог весняної анемії»,
Натрій – разом з Калієм – «помпа» для клітинних мембран,
Молібден – пігменти для фарб,
Меркурій(срібло) – захисник від бактерій,
Кальцій – міцні кістки, здорове серце. (Додаток1)
Тепер повернемося до нашої загадки. Отож, про які брати і сестри йшлося у ній?
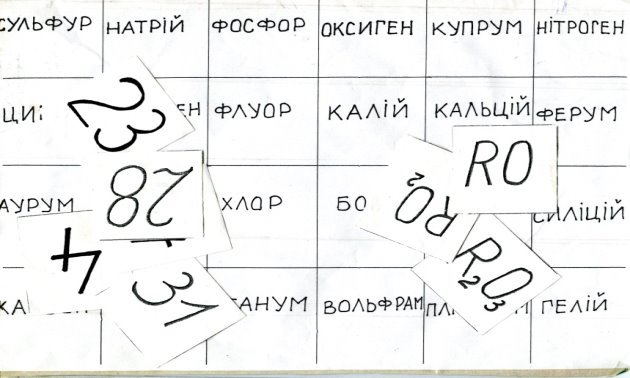
Навчальна гра « Хімічне лото».
На кожну парту друковану картку (Додаток1)
Завдання1. Накрити лише клітинки з символами лужних елементів відповідними порядковими номерами.
Завдання2. Накрити усі символи відповідними їм загальними формулами вищих оксидів.
Завдання3. Накрити клітинки із символами елементів однієї із лужними групи, але побічної підгрупи. Вказати номери їх періодів.
Завдання4. Знайти елемент за його «адресою»:
◙ 3 групаА, ІІ період;
◙ 3 група підгрупаВ, ІV період;
◙ 3 група головна підгрупаА, V період.
Запропонувати школярам самостійно скласти подібні завдання один одному.
VІ. Домашнє завдання. §4, стр. 24 №7а) -усно, №10-письмово, №14.Додатково знайти інформацію про Г. Деві.
Література
1. Романова Н.В. Загальна та неорганічна хімія: Підруч. для студ. вищ навч. закл. – К.; Ірпінь: ВТФ «Перун», 2007. – 480 с.
2. Савчин М.М. Хімія : підруч. для 8 кл. загальноосвіт. навч. закл./ М.М.Савчин. – К.: Грамота, 2016. – 224 с.: іл.



про публікацію авторської розробки
Додати розробку
