Конспект уроку з хімії для 8 класу на тему "Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями."
- Відповідно до нової освітньої програми особистість, що навчається, сама будує власний освітній процес, а найважливішою функцією педагога є стимулювання й підтримка процесу самоосвіти та саморозвитку особистості учня.
- Оновлення мети та змісту навчання, зокрема хімії, потребує оновлення методичного інструментарію вчителя, переходу до використання більш ефективних педагогічних технологій, націлених на організацію продуктивної освітньої діяльності учнів.
- Запропонований конспект уроку призначений для надання допомоги вчителям у підготовці та проведенні уроків хімії у 8 класі 11 – річної школи та складений відповідно до чинної програми з хімії для загальноосвітніх навчальних закладів. Він має за мету зорієнтувати вчителів хімії у виборі педагогічних технологій для реалізації компетентнісного підходу до навчання та розвитку креативного мислення учнів.
УРОК № 54
Тема. Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями. Мета:
• розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі властивостей середніх солей;
• розвивати навички й уміння складати рівняння хімічних реакцій на прикладі хімічних властивостей середніх солей; розвивати сфери розумових дій: наглядно-образних, індукції, рефлексії, абстрагування, уміння працювати з інформацією;
• формувати уміння працювати в співпраці; виховувати мотиви діяльності «я – здатний, я – знаю, я – хочу, я – творю».
Тип уроку: поглиблення й систематизація знань. Метод: частково-пошуковий, дослідницький.
Форма проведення: лабораторне дослідження властивостей речовин в класно-урочній системі.
Форми роботи: розповідь учителя, демонстраційний експеримент, робота з опорною схемою, робота у групах та парах.
Прийоми розумової діяльності: порівняння та аналіз, спостереження, формулювання висновків, міркування, припущення, висування гіпотези, експеримент. Обладнання:
• Періодична система хімічних елементів Д. І. Менделєєва,
• таблиця розчинності,
• ряд активності металів, розчини реактивів.
Запланований результат:Експериментально переконатися, що розчинні і нерозчинні солі піддаються дії хімічних реагентів, температури, води.
Особистісна значущість: Визначити, під дією яких факторів руйнуються мінерали і гірські породи, тобто відбувається процес фізичного вивітрювання.
План уроку:
1. Робота в парах( Що знаємо, що дізнаємося про солі? ) 2. Соціалізація (Обмін думками).
3. Бесіда про передбачувані властивості солей Запитання:
У вас в колонці «дізнаємося» виявилися терміни: обміну, розкладу, заміщення. Що означають ці терміни? (Учні припускають, що це типи
хімічних реакцій)
4. Дослідницька робота «Вивчення властивостей солей».
5. Захист експерименту
6. Робота з таблицями «Солі» та «Взаємозв'язок між класами неорганічних сполук». 7. Закінчити рівняння реакції, визначити тип реакції.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання
III. Актуалізація опорних знань.
• Робота в парах. Що знаємо, що дізнаємося про солі?
Завдання: Розташувати дані терміни в логічній послідовності (2 хв).
Видані карточки з термінами : «Сіль, кислота, основа, лакмус, фіолетовий, синій, червоний, розчинна, нерозчинний, Мех(КЗ)у, загальна формула, вапно, луги, МеОН, НхКЗ нейтралізація, обміну, розкладу, заміщення, гідроксид металу, основний оксид, кислотний оксид, вода, метилоранж, жовтий ».
• Соціалізація.
Я знаю - склад солей, номенклатуру, класифікацію. Завдання 1. Закінчити речення очікувань, використовуючи метод «Мікрофона».
1.Я знаю, що солі складаються з_______________ та ____________________________.
2.Я знаю, що сучасною українською номенклатурою назва солі утворюється від назви _______________ та ____________________
3.Я знаю, що солі класифікують на _____________ , ___________ , ___________ ,____________ , ___________________.
Завдання 2. Скласти формулу за назвою, вибери варіант.
Кальцій хлорид - ___________, магній бромід - _______________
Алюміній сульфат -__________, ферум (ІІІ) силікат - _____________ Натрій фосфат - _____________, купрум (ІІ) нітрат - _________________ Завдання 3. У даному переліку речовин підкресли солі, позначу групу. Дай назву середнім солям.
HCl, CaO, H2O, NaBr, Br2O7, CuSO4, NaHCO3, FeOHCl, NaKSO4, SO2, HNO3 , К2[Zn (ОH)4].
IV. Мотивація навчальної діяльності
Ми вивчили хімічні властивості оксидів, кислот, основ. За результатами наших досліджень ми склали таблицю взаємодії класів неорганічних сполук.
Звернімося до цієї таблиці. Таблиця 1. Взаємозв'язок між класами неорганічних сполук.
|
|
Кислотний оксид |
Основний оксид |
Кислота |
Основа |
Сіль |
|
Кислотний оксид |
--- |
+ |
--- |
+ |
--- |
|
Основний оксид |
+ |
--- |
+ |
--- |
--- |
|
Кислота |
--- |
+ |
--- |
+ |
+ Якщо сіль, утворена слабшою кислотою |
|
Основа |
+ (тільки розчинна) |
--- |
+ |
--- |
+ Якщо утворюється нерозчинна сіль або основа |
|
Сіль |
--- |
--- |
+ Якщо сіль, утворена слабшою кислотою |
+ Якщо утворюється нерозчинна сіль або основа |
? |
За допомогою цієї таблиці й демонстраційного експерименту вивчимо хімічні властивості солей…(Оголошення теми та мети уроку).
V. Демонстрація 10. Хімічні властивості солей
Дослід 1. Взаємодія солей з кислотами
Цю властивість кислот ми вивчали. В якому випадку можлива ця реакція?
(Якщо новоутворена кислота слабша за кислоту, що реагувала)
До розчину натрій карбонату додаємо кілька крапель сульфатної кислоти: Учень на дошці записує рівняння реакції, називає ознаку реакції:
К2СO3 + Н2SO4 = К2SO4 +Н2O + СO2á Ознака реакції — виділення газоподібної речовини.
Вчитель . Карбонатна кислота, що утворилася, слабша за сульфатну. Висновок роблять разом. Солі реагують із кислотами, якщо кислота, яка утворилася, слабша за ту кислоту, що реагувала.
Дослід 2. Взаємодія солей з основами - лугами
Вчитель. Ці реакції ми розглядали, вивчаючи властивості лугів. — Які речовини при цьому утворювалися? (Нерозчинні основи) До розчину алюміній сульфату по краплях додаємо натрій гідроксид. Учень на дошці записує рівняння реакції і робить висновок:
А12(SO4)3 + 6NaОН = 2Аl(ОН)3â +3Na2SO4
Висновок. Солі взаємодіють з лугами, якщо утворюється нерозчинна сіль або основа.
Дослід 3. Взаємодія солей з солями.
Вчитель.
1) Візьмемо дві солі. До натрій сульфату додамо барій хлорид. Спостерігаємо утворення білого осаду, отже, відбулася хімічна реакція.
ВаС12 + Na2SO4= ВаSO4â + 2NаС1
білий осад Звернімося до таблиці розчинності:
- Яка із речовин є нерозчинною ? (ВаSO4 — нерозчинна сіль)
2) Візьмемо знову дві солі. До натрій сульфату додамо калій карбонат. Видимих ознак реакції немає. Запишемо рівняння реакції:
Na2SO4 (розч.) + К2СO3 (розч.) = К2SO4 (розч.) + Nа2СO3 (розч.)
Подивіться в таблицю розчинності. Всі солі розчинні, реакція не протікає. Висновок. Розчини солей взаємодіють між собою, якщо в результаті реакції одна із новоутворених солей є нерозчинною.
Додаємо «плюс» у таблицю.
Крім перелічених властивостей солі можуть взаємодіяти з металами.
Дослід 4. Взаємодія солей з металами
Візьмемо дві пробірки.
У першу наливаємо розчин купрум (П) сульфату й кидаємо дві гранули цинку.
У другу наливаємо розчин цинк сульфату й кидаємо два шматки мідного дроту.
Спостерігаємо за обома пробірками.
- Що відбулося в першій? (На шматочках цинку з'явився червоний наліт міді)
- А у другій пробірці ? (Змін немає)
Звернімося до ряду активності металів. Така реакція можлива, якщо метал, який додається, активніший за той, що входить до складу солі. Запишемо рівняння реакції:
СuSO4 + Zn = Сu + ZnSO4
Сu + ZnSO4 ≠
Висновок. Розчини солей взаємодіють з не дуже активними металами тільки тоді , коли метал, який додається, активніший за той, що входить до складу солі.
VІ. Закріплення вивченого матеріалу
Варіаційно - групові експериментальні завдання по інструкції
Кожна пара учнів виконує роботу в залежності від інструкції, яка лежить на парті. Згідно з цією інструкцією видані реактиви.
Побажання . Щоб життя своє не наражати на небезпеку,
Ти свято дотримуйся всіх правил техніки безпеки.
Використайте всі свої уміння: доповідати, слухати, формулювати висновки, проводити експеримент, спостерігати, виділяти ознаки та умови реакції, відзначати перетворення з речовинами, складати рівняння, аналізувати реакції, схему.
Інструкція №1
1. Випробуй видані солі сульфат алюмінію і хлорид магнію на дію інших солей. Для цього з'єднай сульфат алюмінію з хлоридом барію, а хлорид магнію - з рештою реактиву.
2. Відзначте ознаки реакції
3. Зробіть висновок про швидкість і умови реакції
4. Складіть рівняння .
Інструкція № 2
1.З'єднай видані солі сульфат алюмінію і хлорид магнію з лугами NaOH, Ca (OH) 2
2. Відзначте ознаки реакції
3. Зробіть висновок про швидкість і умови реакції
4. Складіть рівняння. Інструкція № 3
1. Нагрійте у полум'ї спиртівки малахіт (Cu2(OH)2CO3), крейду
2. Відзначте ознаки реакції
3. Зробіть висновок про швидкість і умови реакції
4. Складіть рівняння
5. Перевірте складене вами рівняння (див. на звороті)
Інструкція № 4
1. Подійте виданими кислотами НСl, H2SO4 (розбавленими) на мінерали і гірські породи: мармур, вапняк. 2. Розкажіть про свої спостереження, зробіть висновок.
Захист групових завдань
1) пари учнів з однаковими інструкціями об’єднуються у групи ; 2) один представник від групи записує на дошці рівняння реакцій, що підтверджують результат виконаної роботи.
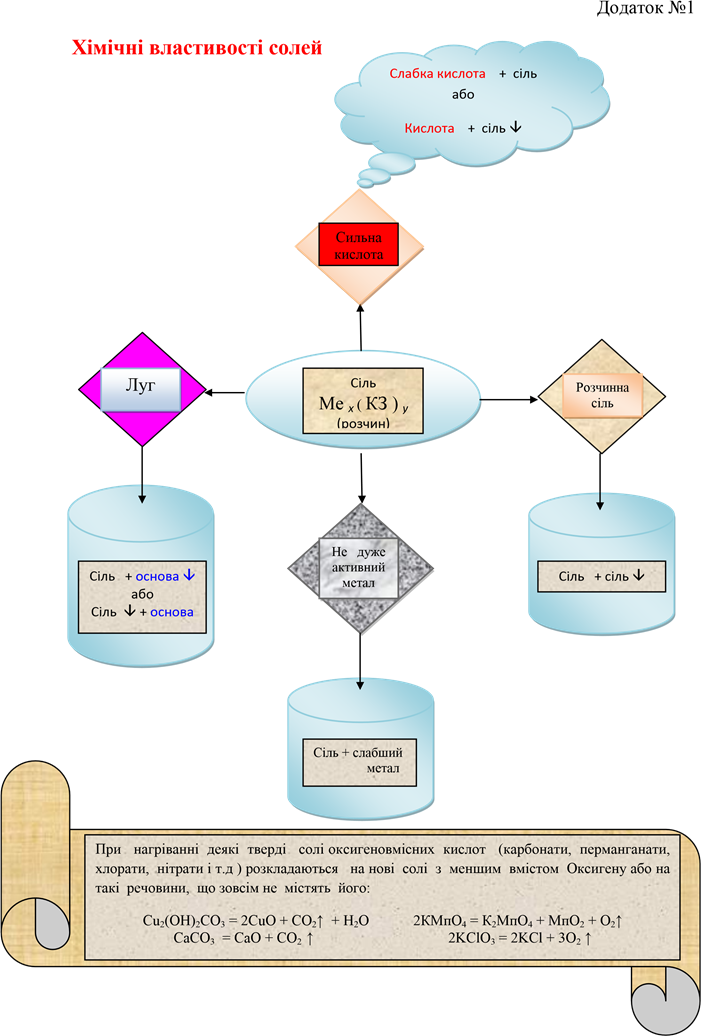
3)зводимо результат у таблицю, робимо висновок про хімічні властивості солей у вигляді схеми ( Додаток №1)
Виконання вправ
Завдання 1
Учень заради експерименту занурив шматочки металу в розчини кислот. Поясніть, що спостерігатиме учень у кожній пробірці, і підтвердьте свої припущення рівняннями хімічних реакцій:
а) Мg + Н2SO4 à б)Аg + НС1à
в) Аl+ Н2SO4 à г) Са + НС1 à
д) Аg + Н2SO4à е) Сu + Н2SO4 à
ж) Zn + Н3РO4à з) Нg +Н2СO3à
Завдання 2(диференційоване)
"Сатурнове дерево "
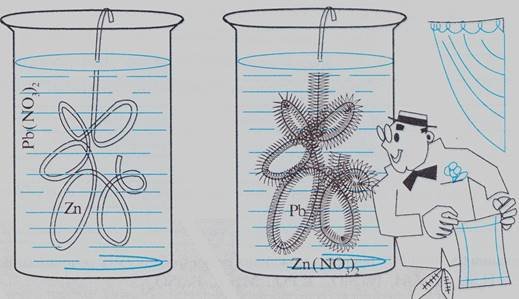
Середній рівень Обґрунтуйте явище, зображене на малюнку.
Складіть рівняння відповідної реакції.
Достатній рівень Виберіть пари металів і солей, які дають аналогічний ефект, і запишіть рівняння їх взаємодії:
а)AgNO3 і Сu; б) і ZnС12; в) МgSO4 і Fе.
Високий рівень Складіть та розв’яжіть задачу за рівнянням будь –якої із складених вами реакцій.
VІІ. Домашнє завдання:
• опрацювати §38; повт. конспект уроку;
• виконати завдання ст..212 № 5 - 8;
• Творче завдання. Підготувати повідомлення про поширення солей у природі та їх практичне значення.
Рефлексія:
• Чи сподобався вам урок і чому?
• Ваші пропозиції по організації і проведенню наступного уроку?
• Ваше відношення до хімії перед уроком і після нього?
• Чи переконалися ви в тому, що мінерали і гірські породи піддаються фізичному вивітрюванню?

про публікацію авторської розробки
Додати розробку
