Конспект уроку з хімії для 8 класу "Періодичний закон Д,І, Менделєєва. Періодична система Д.І. Менделєєва. Її структура
Автор: учитель хімії Новоукраїнської ЗОШ №3 Ворона Людмила Миколаївна
8 клас Урок № 6.Тема . Періодичний закон Д. І. Менделєєва. Періодична система хімічних елементів Д.Ш. Менделєєва, її структура.
Мета: навчальна: ознайомити учнів з історією відкриття періодичного закону та періодичної системи Д. І. Менделєєва; сформулювати періодичний закон хімічних елементів; ознайомити учнів з будовою періодичної системи хімічних елементів Д. І. Менделєєва; сформувати початкові навички визначення положення хімічного елемента в періодичній системі; продовжити знайомство із символами й назвами елементів за сучасною українською номенклатурою;
розвиваюча: - розвивати вміння чітко формулювати й висловлювати свої думки, застосовувати теоретичні знання для розв’язування проблемних питань;
виховна: формувати комунікативні компетентності; виховувати свідоме ставлення до вивчення хімії, бажання здобувати нові знання
Тип уроку: комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Форми роботи: евристична бесіда , фронтальна робота з класом, робота з текстом підручника та таблицями..
Обладнання: мультимедійна презентація, періодична система хімічних елементів, картки хімічних елементів (№1- №19), сигнальні картки (так, ні) , портрет Д. І. Менделєєва.
Хід уроку
І. Актуалізація опорних знань.
Фронтальна робота з класом:
1. Пригадайте, на які 2 групи Л. Лавуазьє та Я. Берцеліус запропонували поділити елемента та утворені ними прості речовини? (метали і неметали).
2. На які родини поділяються елементи? (лужні метали, галогени, інертні елементи)
Гра «так» чи «ні».
- До групи лужних металів належать: Літій, Натрій, Рубідій, Цезій (Так)
- До галогенів належать: Хлор, Бром, Манган, Оксиген (Ні)
- До групи інертних елементів належать:Гелій, Неон, Ферум, Аргон (Ні)
- Хімічна активність лужних металів зростає із збільшенням відносної атомної маси (Так)
- Хімічна активність галогенів спадає із збільшенням відносної атомної маси (Так)
- Оксиди лужних металів виявляють основний характер. (Так)
7. Натрій і Калій взаємодіють з водою за звичайних умов (Так)
8. Метали натрій і калій м’які, легко ріжуться ножем. (Так)
9. Усі лужні метали мають однакову густину, а також однакові значення температур плавлення та кипіння. (Ні)
10. Галогени взаємодіють з металами, утворюючи солі (Так)
11. Інертні елементи – типові неметали (Ні)
12. Галогени – типові неметали (Так)
ІІ. Мотивація навчальної діяльності.
Ви вже знаєте, що було багато спроб створити класифікацію хімічних елементів. Ньюлендс, Мейєр близько підійшли до відкриття періодичного закону, помітивши залежність властивостей елементів від їх атомних мас.
Але вони не зуміли узагальнити факти, що спостерігали.
Закон, що об’єднує всі знання про хімічні елементи в струнку природну систему, був відкритий російським ученим Д.І. Менделєєвим.
Ознайомимося з тим, яким шляхом йшов вчений, які факти отримав і які зробив висновки.
Графічним відображенням періодичного закону є періодична система, про яку ви вже знаєте з курсу хімії 7 класу. Пригадаємо цю інформацію, доповнимо її новими знаннями. Ви повинні знати як побудована періодична система і вміти користуватися нею.
ІІІ. Вивчення нового матеріалу
- В основу класифікації Д. І. Менделєєв поклав значення відносної атомної маси. Виявити залежність властивостей від відносної атомної маси було важко з двох
причин:
- не всі елементи було відкрито (63 елемента проти 118 на сучасному етапі)
- відносні атомні маси у деяких елементів було визначено неточно.
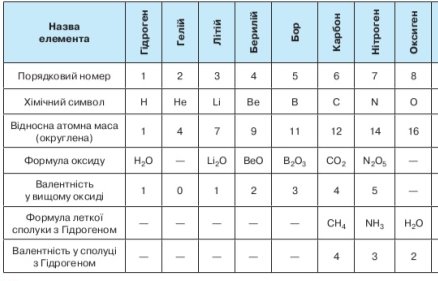 2. Оформлення карток з інформацією про хімічні елементи.
2. Оформлення карток з інформацією про хімічні елементи.
На кожний елемент із 63 відомих Д.І. Менделєєв склав картку, де зазначив символ хімічного елемента, відносну атомну масу, формулу вищого оксиду, валентність у вищому оксиді, формулу леткої сполуки з Гідрогеном.
3. Потім вчений розставив елементи в порядку зростання відносних атомних мас, пронумеровав їх, а наданий номер назвав порядковим номером.
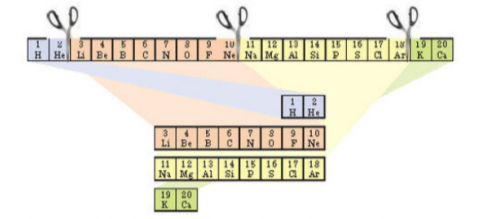 В цьому ряду побачив закономірні зміни властивостей елементів.
В цьому ряду побачив закономірні зміни властивостей елементів.
-Знайдіть, де стоять елементи із відомих вам родин.
- лужні метали стоять не поряд, а через кілька елементів, так саме розташовані галогени та інертні гази.
4. Д.І. Менделєєв поділив ряд на відрізки і розмістив їх один під одним. При цьому елементи з подібними властивостями опинилися один під одним. Отримався прообраз сучасної періодичної системи.
5. Розглянемо, які закономірності спостерігав Д.І. Менделєєв у кожному відрізку:
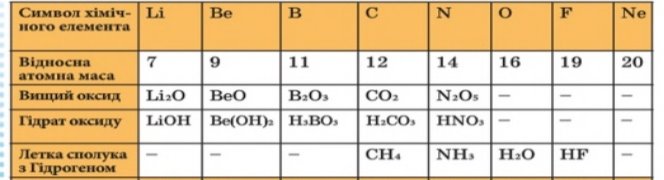
Li Be B C N O F
![]()
Металічні властивості спадають, неметалічні властивості зростають
![]()
![]() Вищі Li2O BeO B2O3 CO2 N2O5 - -
Вищі Li2O BeO B2O3 CO2 N2O5 - -
![]()
![]() оксиди
оксиди
основний амфотерний кислотні оксиди
оксид оксид
гідрати LiOH Be(OH)2 H3BO3 H2CO3 HNO3 - -
![]()
![]() оксидів H2BeO2
оксидів H2BeO2
основа амфотерний кислоти
гідроксид
летка
сполука - - - СН4 NH3 H2O HF
з Гідрогеном
(Вища валентність елемента у сполуці з Оксигеном дорівнює номеру групи. Валентність елемента в сполуці з Гідрогеном дорівнює 8 – номер групи.
Аналогічно змінюються властивості елементів і сполук від Na до Cl.
На основі спостережень Менделєєв сформулював періодичний закон:
Зміна хімічних властивостей елементів від Li до F
Зміна хімічних властивостей елементів від Na до Cl
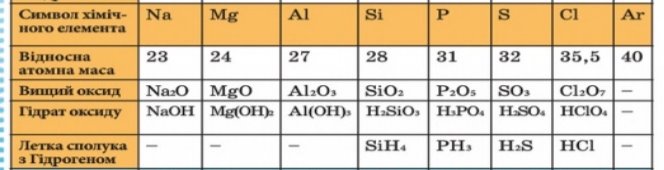
а) металічні властивості спадають, неметалічні – зростають;
б) валентність в сполуках з Оксигеном зростає;
в) характер вищих оксидів та відповідних їм гідратів оксидів змінюється від основного через амфотерні до кислотних;
г) валентність в летких сполуках з Гідрогеном спадає.
6. Виявлені закономірності Д.І. Менделєєв сформулював у вигляді періодичного закону (1869р.)
Властивості елементів і властивості утворених ними простих і складних сполук перебувають у періодичній залежності від величини атомних мас.
На основі цього закону і побудована періодична система хімічних елементів.
Періодична система хімічних елементів — графічне зображення періодичного закону.
- Будова періодичної системи:
а) Елементи, розташовані в періодичній системі утворюють 7 періодів.
Період – це горизонтальний ряд хімічних елементів, розміщених відповідно до зростання їх відносних атомних мас, що починається лужним металом і закінчується інертним елементом.
Знайдіть у підручнику на сторінці………., що називають періодом.
Періоди поділяють на малі та великі, відповідно до кількості елементів, що їх утворюють.
Періоди
|
Малі |
Великі |
|
1,2,3 періоди |
4,5,6,7 періоди |
б) Елементи, розташовані в періодичній системі, утворюють 8 груп.
Знайдіть у підручнику на сторінці………., що називають групою.
Група – це вертикальний стовпчик, в якому один під одним розміщені елементи подібні за властивостями.
Наприклад, вища валентність елемента відповідає номеру групи.
Кожна група ділиться на підгрупи.
Підгрупи
![]()
![]()
|
Головна (А) |
Побічна (В)
|
|
Складається з елементів і малих і великих періодів |
Складається з елементів лише великих періодів |
в) вниз таблиці винесено загальні формули вищих оксидів і летких сполук з Гідрогеном
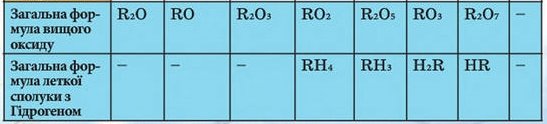
г) Елементи з порядковими номерами 58-71 та 90-103, особливо схожі за властивостями, утворюють два сімейства — лантаноїдів та актиноїдів.
ІV. Закріплення набутих знань
1. Дайте правильну відповідь:
1). Скільки періодів містить періодична система? (Сім ).
2). Які бувають періоди?(малі в великі)
3).Чим відрізняються між собою періоди? (Кількістю хімічних елементів, у 1-3 періодах хімічні елементи розташовані в один ряд, в інших – у два ряди).
4). Скільки хімічних елементів містить 1 період? (2).
5). Скільки хімічних елементів містить 2 та 3 періоди? (По 8 елементів).
6). Скільки хімічних елементів містить 4 період? (18 елементів).
7). Скільки груп містить періодична система? ( 8).
8). На які дві підгрупи поділяється кожна група? (головна і побічна)
9) Яка підгрупа є головною? (до складу якої входять елементи малих і великих періодів)
10) Яка підгрупа є побічною? (яка складається тільки з елементів великих періодів)
11) Сформулюйте періодичний закон хімічних елементів.
2. Охарактеризувати положенням елемента в періодичній системі за планом
|
Назва елемента |
Порядковий номер |
Відносна атомна маса |
Номер періоду |
Номер групи |
підгрупа |
|
К - Калій |
19 |
39 |
4 |
І |
головна |
|
|
|
|
|
|
|
- Узагальнимо інформацію про зміни властивостей елементів в періодах і групах, складемо таблицю:
|
Властивості |
|
|
|
Металічні |
Послаблюються |
Посилюються |
|
Неметалічні |
Посилюються |
Послаблюються |
|
Вища валентність за Оксигеном |
Збільшується |
Постійна |
|
Валентність в летких сполуках з Гідрогеном |
Зменшується |
Постійна |
V. Підведення підсумків уроку.
VІ. Домашнє завдання
Вивчити §2,3 (П.П.Попель,Л.С. Крикля)
Виконати вправу №16 ст20
Скласти кросворд «Періодична система»
2.
-


про публікацію авторської розробки
Додати розробку
