Презентація уроку з хімії для 8 класу "Періодичний закон Д,І, Менделєєва. Періодична система Д.І. Менделєєва. Її структура
Про матеріал
Презентація уроку з хімії для 8 класу "Періодичний закон Д,І, Менделєєва. Періодична система Д.І. Менделєєва. Її структура Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




















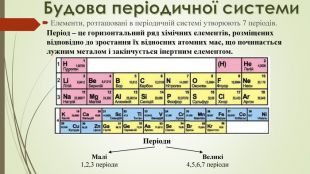
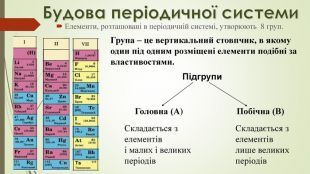


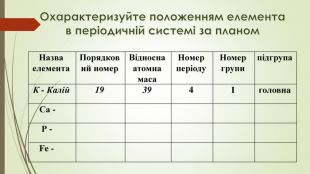


-

Лаптєва Інна
18.09.2024 в 23:23
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бурдейна Вікторія
09.07.2023 в 23:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Задорожна Ніна Олександрівна
21.09.2022 в 13:02
Дякую за чудову розробку
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Куценко Свiтлана
17.09.2022 в 20:33
Щіро вдячна Вам за Вашу працю.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ivanenko Olena
12.09.2022 в 20:10
Щиро дякую. Ваша розробка допомогла в підготовці до уроку.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тодоров Леонід
18.09.2021 в 23:26
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Біліченко / Bilichenko Марина / Maryna
11.10.2020 в 18:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кудлай Наталія Олександрівна
26.09.2020 в 15:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків