Конспект уроку з хімії для 8 класу "Періодичний закон і електронна будова атомів"
[Введите текст]
Урок № 13 .Тема. Періодичний закон і електронна будова атомів (Електронні та графічні електронні формули атомів хімічних елементів № 1-20. Поняття про радіус атома)
Мета
навчальна: продовжити знайомство учнів з рухом електронів у атомах; удосконалювати уявлення про основні поняття (електронна орбіталь, енергетичний рівень), сформувати в учнів поняття «радіус атома»;
розвиваюча: розвивати пізнавальний інтерес, увагу, логічне мислення, вміння самостійно робити висновки та оцінювати свою роботу на уроці, розвивати предметну, комунікативну, полікультурну компетентність.
виховна: оволодівати вмінням працювати злагоджено на уроці, індивідуально і в колективі, старанно і вчасно виконувати завдання, поважати працю однокласників і вчителя.
Тип уроку: формування і застосування знань, умінь і навичок.
Форми роботи: евристична бесіда , фронтальна робота з класом, робота з текстом підручника, перевірка знань у формі гри з кубиком, робота з опорною схемою.
Обладнання: таблиця Д.І. Менделеєєва, мультимедійна презентація, кубик.
Хід уроку
І. Актуалізація опорних знань.
1. Перевірка домашньої вправи : Написати електронну конфігурацію атома та йона для елементів з порядковими номерами №13, № 17.
13Al ) ) ) 12Al 1S22S22P63S23P1 атом алюмінію
2е 8е 3е
13Al3+ ) ) 13Al3+ 1S22S22P6 (або 1S22S22P63S0) йон алюмінію
2е 8е
17Cl ) ) ) 17Cl 1S22S22P63S2 3Р5 атом хлору
2е 8е 7е
17Cl - ) ) ) 17Cl- 1S22S22P63S2 3Р6 йон хлору
2е 8е 8е
2. Повторення основних питань у формі гри з кубиком:
1) Як побудований атом?
2) Як можна визначити заряд ядра атома?
3) Як визначити кількість електронів в атомі?
4) Як визначити кількість електроних шарів?
5) Як визначити кількість електронів на зовнішньому енергетичному рівні?
6) Чим відрізняються за будовою електронних оболонок атом та йон одного і того ж елемента?
7) Коли атом перетворюється на катіон, а коли на аніон?
3. Виконання тестів (зміст на екрані, відповіді пальцями долоні або сигнальними картками)
1) Атом якого елемента має електронну конфігурацію:
А. 1S22S22P4 1. K
Б. 1S22S22P63S2 2. Si
В. 1S22S22P63S23P2 3. Mg
Г. 1S22S22P63S23P64S1 4. О
(Відповідь: А- 4, Б-3, В – 2, г – 1)
2) Установіть відповідність між хімічними елементами і будовою зовнішніх енергетичних рівнів їхніх атомів
А … 4S2 1 Ca
Б …3S23P5 2 B
В … 3S23P2 3 Cl
Г … 2S22P1 4 Si
(Відповідь: А- 1, Б-3, В – 4, г – 2)
|
S |
|
P |
|
|
↑↓ |
↓ |
↓ |
|
3) Вкажіть кількість неспарених електронів на завнішньому енергетичному рівні у даних елементів, якщо вони перебувають в основному (незбудженому) стані:
А С 0 C
Б Ве 1
|
S |
|
P |
|
|
↓↑ |
|
|
|
В P 2 Ве
Г Cl 3
|
S |
|
P |
|
|
d |
|
|
|
|
↓↑ |
↓ |
↓ |
↓ |
|
|
|
|
|
P
|
S |
|
P |
|
|
d |
|
|
|
|
↓↑ |
↑↓ |
↓↑ |
↓ |
|
|
|
|
|
Cl
(Відповідь: А- 2, Б-0, В – 3,Г – 1)
ІІ. Мотивація навчальної діяльності.
Пригадайте, як читається періодичний закон Д.І.Менделєєва:
Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів. Чим можна пояснити періодичну зміну властивостей елементів? Що в будові атома змінюється періодично? Мета нашого уроку- встановити залежність властивостей елементів від будови атома.
ІІІ. Вивчення нового матеріалу
І. Фізична суть періодичного закону
1. Що в будові атома змінюється періодично?
- заряд ядра – постійно зростає від 1 до 118;
- загальна кількість електронів - постійно зростає від 1 до 118;
- кількість енергетичних рівнів – зростає від 1 до7
- кількість електронів на зовнішньому рівні змінюється періодично від 1 до8 (за винятком 1 періода)
2. За кількістю зовнішніх електронів можна передбачити хімічний характер елемента
- якщо електронів мало, від 1 до 3, то елемент виявляє металічні властивості.
- якщо електронів від 4 до 8, то елемент виявляє неметалічні властивості.
- Періодичність зміни електронної будови атомів елементів спричиняє періодичність зміни їх властивостей.
ІІ. Класифікація елементів за електронною будовою
1. В залежності від того, який підрівень заповнюється електронами, елементи поділяються на родини.
|
s - елементи |
Елементи, в яких заповнюється s-підрівень зовнішнього рівня |
Це перші два елементи кожного періода (Елементи ІА - ІІ А груп, Не) |
|
р - елементи |
Елементи, в яких заповнюється р-підрівень зовнішнього рівня |
Це останні 6 елементів періода (Елементи ІІІА - VІІІ А груп) |
|
d - елементи |
Елементи, в яких заповнюється d-підрівень передостаннього рівня |
Це елементи побічних підгруп |
|
f - елементи |
Елементи, в яких заповнюється f-підрівень третього ззовні рівня |
Це лантаноїди та актиноїди |
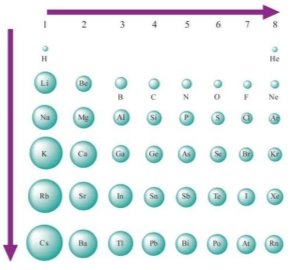
ІІІ. Зміна радіусів атомів елементів у періодах і підгрупах
- Радіус атома — величина, що визначається розмірами електронної оболонки атома і дорівнює середній відстані між ядром атома та найвіддаленішою орбітальною електронною оболонкою атома.
- Радіуси атомів елементів у періоді зменшуються зліва направо
Li C F

![]()
![]()


![]() ) ) ) ) ))
) ) ) ) ))
2е 1е 2е 4е 2е 7е
Зліва направо зростає заряд ядра і кількість електронів на зовнішньому рівні.
Електрони сильніше притягуються до ядра, радіус атома зменшується.
- Радіуси атомів елементів у підгрупах зростають зверху донизу.
|
2е1е
2е 8е 1е
2е 8е 8е 1е
|
В головних підгрупах зверху донизу зростає кількість енергетичних рівнів , на яких розміщені електрони.
Чим більше енергетичних рівнів має атом, тим більше його радіус.
Зверху донизу зростають заряди ядер, але зростаючі позитивні заряди екрануються (ніби нейтралізуються) негативними зарядами внутрішніх електронів. Тому визначальним чинником, який впливає на радіуси атомів елементів є кількість енергетичних рівнів, на яких перебувають електрони. |
 Радіус атома зменшується
Радіус атома зменшується
![]()
ІV. Зміна металічних і неметалічних властивостей елементів
- У періодах, із збільшенням порядкового номера елементів, металічні властивості спадають, а неметалічні властивості зростають.
Це пояснюється тим, що із зростанням заряду ядра, зростає електронегативність (здатність атома притягувати до себе електрони від інших атомів), зменшується радіус атома. в результаті притягання валентних електронів зростає.
Чим сильніше притягуються електрони, тим сильніші неметалічні властивості елементів .Чим слабше притягуються електрони, тим сильніші металічні властивості елементів
2.У головних підгрупах, із збільшенням порядкового номера елемента, металічні властивості зростають, а неметалічні спадають. Це пояснюється тим, що в підгрупах зростає кількість енергетичних рівнів, тому радіус атома зростає, електронегативність спадає, притягання зовнішніх електронів послаблюється, що призводить до підвищення металічних властивостей.
V. Залежність властивостей сполук елемента від його положення у періодичній системі
|
Елемент |
Вищий оксид |
Гідрат оксиду |
Летка сполука з Гідрогеном |
|
К - лужний метал |
К2О - основний оксид |
КОН - основа |
не утворює |
|
S - неметал |
SO3 - кислотний оксид |
H2SO4 - кислота |
H2S |
|
Al - метал |
Al2O3 - амфотерний оксид |
Al(OH)3 або H3AlO3 |
не утворює |
|
Cr- метал |
CrO3 - кислотний оксид |
H2CrO4 - кислота |
не утворює |
|
Р |
|
|
|
|
Mg |
|
|
|
|
Zn |
|
|
|
|
N |
|
|
|
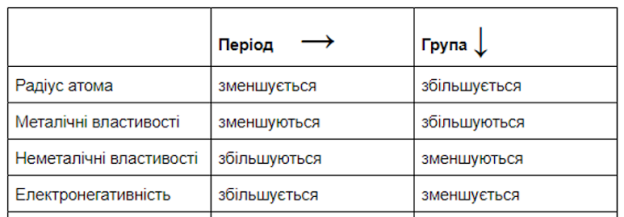
Кислотні властивості вищих оксидів та гідратів оксидів (кислот) посилюються в періодах зліва направо, а в головних підгрупах знизу догори.
Основні властивості вищих оксидів та гідратів оксидів (основ) послаблюються в періодах зліва направо, а в головних підгрупах знизу догори.
|
|
Період → |
Група ↓ |
|
Основні властивості сполук |
зменшуються |
збільшуються |
|
Кислотні властивості сполук |
збільшуються |
зменшуються |
ІV. Підведення підсумків уроку.
V. Домашнє завдання
Опрацювати §8 підручника, виконати вправи №55, №58.


про публікацію авторської розробки
Додати розробку



