Презентація до уроку з хімії для 8 класу "Періодичний закон і електронна будова атомів"
Про матеріал
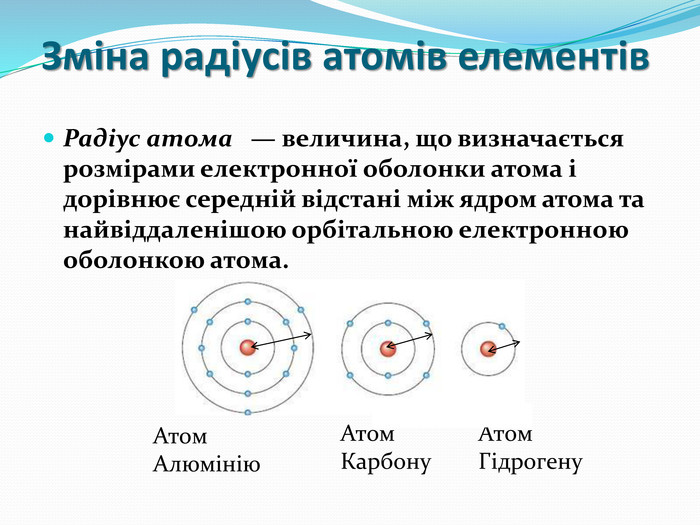
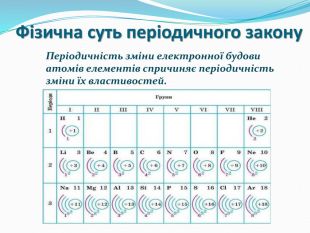
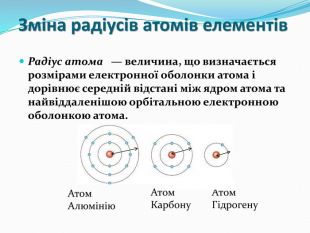
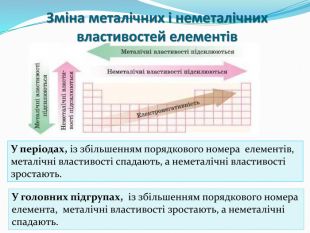
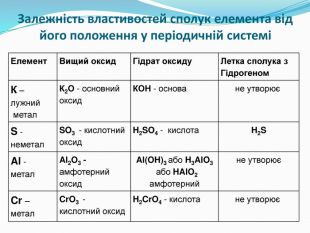
презентація до уроку з хімії для 8 класу "Періодичний закон і електронна будова атомів". Поняття про радіус атомів. Перегляд файлу
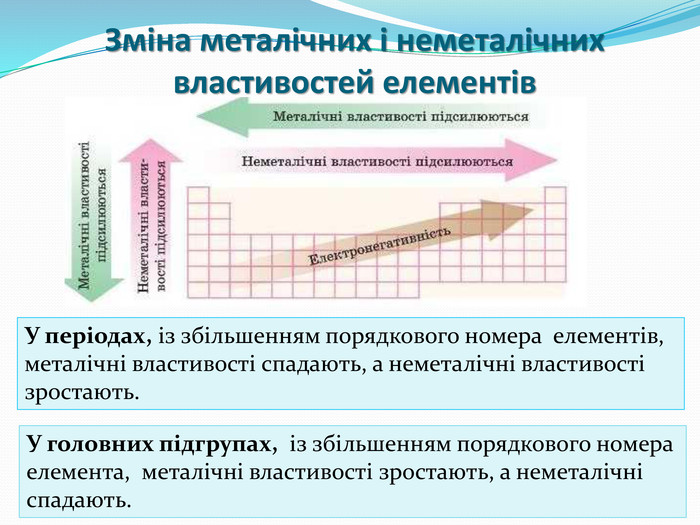
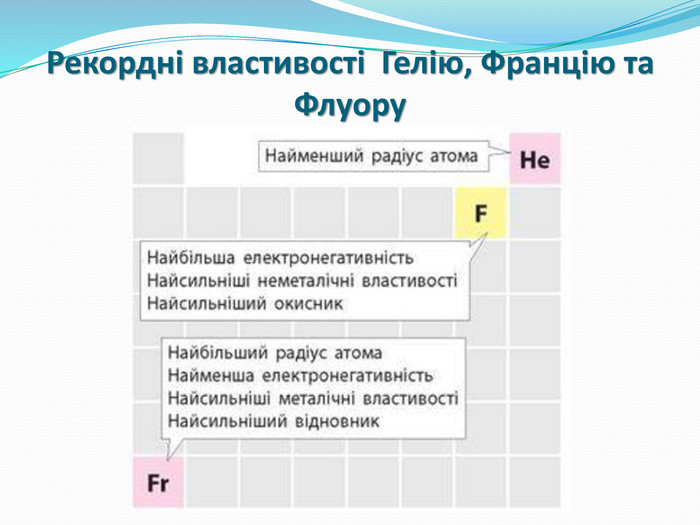
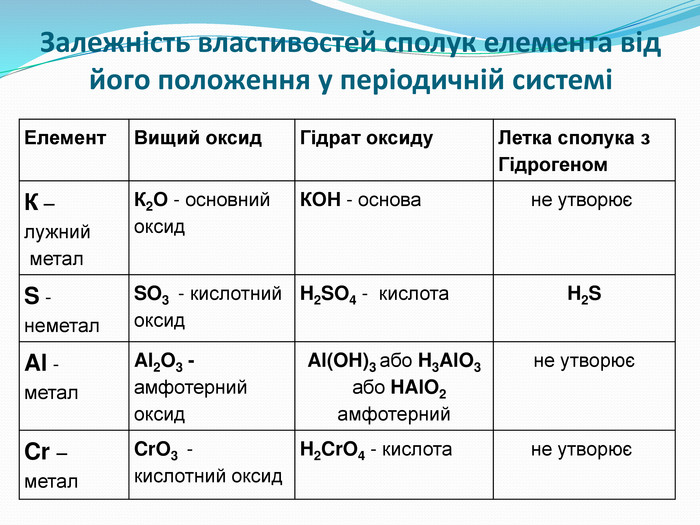
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



























-

Медведчук Тетяна
19.10.2023 в 08:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Смакоуз Тамара Василівна
08.10.2023 в 14:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Котюк Тетяна Валеріївна
03.10.2023 в 06:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Куценко Свiтлана
19.10.2022 в 19:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Щербина Тетяна
05.11.2020 в 10:15
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 2 відгука