Конспект уроку з хімії для 9-го класу на тему "Спільні й відмінні ознаки органічних і неорганічних сполук. Особливості будови атома Карбону в основному та збудженому станах"
Розробка уроку з хімії для 9-го класу. Перший урок з теми "Органічні сполуки". Мета: показати подібність і відмінності органічних і неорганічних речовин; ознайомити з предметом вивчення органічної хімії, розмаїттям органічних сполук; розкрити особливості органічних сполук порівняно з неорганічними; ознайомити учнів з короткою історією розвитку органічної хімії; ознайомити учнів з теорією хімічної будови О. М. Бутлерова; формувати уявлення учнів про структурні формули органічних речовин.
Міністерство освіти і науки України
Комунальна установа В-Піщанська загальноосвітня школа І-ІІ ступенів
КОНСПЕКТ УРОКУ
на тему:
«Спільні й відмінні ознаки органічних і неорганічних сполук. Особливості будови атома Карбону в основному та збудженому станах»
Вчитель: Леоненко В. В.
Урок № 29 / 1 Клас 9 Дата _________ Вчитель: Леоненко В. В.
Тема уроку: Спільні й відмінні ознаки органічних і неорганічних сполук. Особливості будови атома Карбону в основному та збудженому станах.
Освітньо-виховні завдання теми:
- назвати характерні особливості органічних сполук; елементи органогени та найважливіші органічні сполуки;
- розрізняє органічні та неорганічні сполуки, природні й синтетичні сполуки;
- пояснює причини різноманітності органічних сполук;
- називає особливості будови атома Карбону в основному та збудженому станах.
Мета:
Навчальна: показати подібність і відмінності органічних і неорганічних речовин; ознайомити з предметом вивчення органічної хімії, розмаїттям органічних сполук; розкрити особливості органічних сполук порівняно з неорганічними; ознайомити учнів з короткою історією розвитку органічної хімії; ознайомити учнів з теорією хімічної будови О. М. Бутлерова; формувати уявлення учнів про структурні формули органічних речовин.
Розвиваюча: розвивати уявлення про єдність живої та неживої природи; розвивати ініціативу, творчість; формувати колективні якості на основі організації колективної навчальної праці; розвивати в учнів уміння самостійно здобувати знання удосконалювати вміння аналізувати, узагальнювати, порівнювати.
Виховна: виховувати волю, наполегливість, уміння керувати своїми діями й діями товаришів для досягнення поставленої мети; сприяти формуванню етичних взаємовідносин – доброзичливості, взаємодопомоги.
Базові поняття і терміни: неорганічна хімія, поширеність речовин у природі, валентність, теорія.
Міжпредметні та внутрішньо-предметні зв’язки: біологія, фізика.
Тип уроку: вивчення нового матеріалу.
Методи, форми та прийоми навчання: створення психологічного настрою, розповідь вчителя, фронтальна бесіда, проблемне запитання, виконання вправ, рефлексія, робота з підручником, наочний (мультимедійні засоби навчання).
Обладнання: мультимедіа: проектор, презентація Power Point.
Структура уроку і хронометраж:
I. Організаційний момент (1-2 хв.)
ІІ. Актуалізація опорних знань (2-3 хв.)
ІІІ. Мотивація навчальної діяльності (2-3 хв.)
IV. Вивчення нового матеріалу (20-25 хв.)
V. Узагальнення і систематизація знань (5-7 хв.)
VI. Підведення підсумків (4-5 хв.)
VII. Домашнє завдання (1-2 хв.)
Хід уроку:
І. Організаційний етап:
Добрий день! Рада вітати Вас на уроці! Давайте повернемося один до одного і усміхнемось один одному і нехай наш урок пройде у такому гарному настрої. Сідайте, будь-ласка. Назвіть відсутніх. (Слайд 1)
ІІ. Актуалізація опорних знань:
Давайте згадаємо деякий матеріал із попередніх класів, заповнюючи таблицю: (Слайд 2)
- Що таке речовини?
- Які класи неорганічних сполук ви знаєте?
- З яких елементів вони складаються?
- Яка кількість неорганічних речовин на землі?
- Яка валентність Карбону у сполуках?
- Які типи хімічного зв’язку зустрічаються у неорганічних сполуках?
- Яка роль неорганічних сполук для організму людини?
Порівняльні ознаки органічних та неорганічних речовин
|
Ознаки для порівняння |
Неорганічні речовини |
Органічні речовини |
|
Елементний склад. |
Неорганічні речовини утворюють майже всі елементи періодичної системи. |
Органічні речовини утворюють в основному такі елементи як С, Н, О, N, яких називають органогенами. Рідше до складу органічних сполук входять S, P та галогени. |
|
Кількість речовин. |
Близько 200 тисяч. |
Понад 10 млн. |
|
Валентність Карбону. |
Карбон проявляє валентність ІІ і IV. |
Карбон проявляє валентність лише IV. Атоми Карбону можуть сполучатися між собою, утворюючи молекули різноманітної форми. |
|
Тип зв’язку, кристалічна ґратка, фізичні властивості. |
Більшість неорганічних сполук немолекулярної будови, тому їм притаманна висока температура кипіння й плавлення. Тип хімічного зв’язку ковалентний, йонний або металічний. |
Органічні речовини молекулярної будови, тому вони мають низькі тамператури плавлення. Тип хімічного зв’язку переважно ковалентний. |
|
Утворення гомологів й ізомерів. |
Явище ізомерії зустрічається дуже рідко. |
Характерне явище ізомерії. |
|
Фізіологічна роль. |
Необхідні в процесах життєдіяльності організмів. |
Роль у процесах життєдіяльності організмів особлива. |
ІІІ. Мотивація навчальної діяльності:
Всі речовини ділять на неорганічні та органічні. Як і неорганічні, так і органічні речовини відіграють для людини важливу роль. Ще в давнину люди вміли вилучати олію із насіння соняшника та деяких інших рослин, пізніше навчилися вилучати цукор із цукрових буряків, картоплі, крохмалю. Вони випікали хліб, виготовляли сир, вино, оцет, несвідомо здійснювали реакції за допомогою органічних речовин.
Ми починаємо новий розділ хімії – органічна хімія. У цьому розділі ми ознайомимося з найважливішими органічними речовинами, їх поширенням у природі, хімічними властивостями та застосуванням цих сполук. Отже, запишемо тему уроку (Слайд 3)
ІV. Вивчення нового матеріалу:
Сьогодні будемо працювати за планом: (Слайд 4)
- Органічна хімія. Предмет її вивчення.
- Органічні речовини. Особливості сполук.
- Особливості будови атома Карбону в основному і збудженому станах.
- Теорія хімічної О. М. Бутлерова.
- Явище ізомерії.
- Органічних сполук значно більше за кількістю, ніж неорганічних. Тривалий час органічні речовини виділяли в окрему групу речовин, які можна було одержати тільки з рослин чи тварин під впливом таємної життєвої сили (віс віталіс). Але теорія «віталізму» проіснувала недовго. У 1828 р. німецький хімік Велер (Слайд 5) добув із неорганічної речовини органічну – сечовину (СО(NH2)2). Нині синтезують усе більше органічних речовин невідомих природі, вивчають їхні властивості.
Органічною хімією називають галузь хімії, предметом якої є вивчення органічних сполук та їх перетворення. Завдяки досягненням органічної хімії сучасна промисловість випускає нові матеріали, різноманітні полімери і пластмаси, ліки, засоби захисту рослин, вироблення синтетичних тканин, барвників, харчових добавок. Досягнення органічної хімії використовують для розв’язання екологічних проблем, як очищення водойм, зменшення забруднення повітря викидами. (Слайд 6)
- Органічні речовини містяться в рослинах, організмах тварин і людини. Серед них – білки, жири, цукор, глюкоза, крохмаль, вітаміни, ефірні масла. Але є органічні речовини, які містяться не тільки в живих організмах. Вони становлять основу горючих копалин – нафта, природний газ, вугілля (Слайд 7)
Органічні речовини – це сполуки Карбону.
Тобто, до складу кожної органічної речовини будуть входити атоми Карбону. Крім Карбону можуть входити Гідроген, Оксиген, Сульфур, Нітроген і Фосфор. Усі ці елементи називають елементами-органогенами. (Слайд 8)
Майже всі органічні сполуки складаються з молекул і тому мають невисокі температури плавлення й кипіння, деякі є леткими. Тому квіти, фрукти, ягоди мають різноманітні запахи.
Значна кількість органічних речовин розчиняються у спирті, ацетоні, бензині, але не розчиняються у воді.
При нагріванні багато органічних речовин загорається, а деякі обвуглюються (вата).
- Карбон – особливий елемент. Жоден елемент не здатен утворювати таку кількість сполук. Це пояснюється наявністю на зовнішньому енергетичному рівні (2s i 2p) чотирьох електронів (атом Карбону не здатен ні віддавати, ні приєднувати вільні електрони з утворенням йонів).
Розрізняють основний та збуджений стан атома Карбону. У органічних сполуках Карбон знаходиться у збудженому стані. У результаті надходження енергії до атома Карбона s-електрони розпаровуються на зовнішньому енергетичному рівні. Розглянемо будову зовнішнього електронного рівня атома Карбону. (Слайд 9)
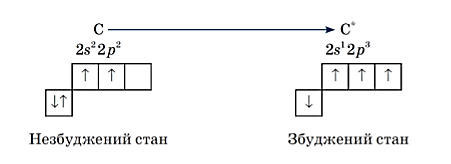
Мал. 1. Будова атома Карбону в основному і збудженому станах. Органічних речовин набагато більше, ніж неорганічних – понад 20 млн. Їх чисельність і різноманітність можна пояснити здатністю атома Карбону:
- Виявляти досить високу валентність;
- Утворювати не лише прості (одинарні) зв’язки, а й кратні (подвійні і потрійні);
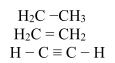 .
.
- Головною метою вчених-хіміків є синтезувати і вивчити якомога більше органічних сполук. Для цього була необхідна теорія, що дозволила б пояснити вже відомі факти й нові відкриття. Такою теорією в органічній хімії є теорія хімічної будови, основні положення якої сформулював російський вчений О. М. Бутлеров у 1861 році. (Слайд 10) Наведемо основні положення теорії хімічної будови:
- У молекулах речовин існує чітка послідовність хімічного з’єднання атомів, відповідно до їх валентності, що називається хімічною структурою (будовою). Для зображення валентності Бутлеров застосовував штрихи (риски) між атомами. Звідси, є такі види запису формул: молекулярна, структурна, електронна.
- Хімічні властивості речовин визначаються природою елементарних складових, їх кількістю і порядком з’єднання.
- Існування речовин з однаковим складом і молекулярною масою, але різною будовою, зумовлене явищем ізомерії. (Слайд 11)
- Ізомерія – це явище, за якого можуть існувати кілька речовин, що мають той самий склад і ту саму молекулярну масу, але відрізняються хімічною будовою і властивостями.
Речовини, що мають однаковий склад молекул, але різну хімічну будову, і тому мають різні властивості, називаються ізомерами.
- Оскільки в конкретних реакціях змінюються лише деякі частини молекули, то дослідження будови продукту реакції допомагає визначити будову вихідної молекули.
- Хімічна природа (реакційна здатність) окремих атомів молекули змінюється залежно від оточення, тобто від того, з якими атомами інших елементів вони з’єднані. (Слайд 12)
V. Узагальнення і систематизація знань:
(Фронтальна бесіда)
- У чому полягає умовність терміна «органічна хімія»?
- Які особливості органічних речовин сприяли виділенню органічної хімії в окремий розділ науки?
- У деяких підручниках з хімії відомості про органічні сполуки входять до розділу про елементи IV групи періодичної системи. Наскільки праве таке розташування матеріалу? Обґрунтуйте «за» і «проти».
- Які речовини називаються органічними?
- Обґрунтуйте аргументи «за» і «проти» такого визначення з погляду хіміків, біологів, істориків.
- Як визначити приналежність речовини до органічних сполук?
- Подумайте! Наведіть факти, що свідчать про матеріальну єдність органічних і неорганічних речовин.
Давайте повернемося до таблиці і заповнимо другу колонку. (Слайд 13)
Давайте пройдемо експрес-тест (Слайд 14-22)
VI. Підбиття підсумків:
(Рефлексія)
Наш урок добігає кінця. Давайте проаналізуємо, що ми навчилися на сьогоднішньому уроці, відповівши на питання:
- Сьогодні на уроці я дізнався?
- Для мене було цікавим те, що…
- Найбільше мені сподобалося…
Дякую за активну участь на уроці. (Слайд 27)
VII. Домашнє завдання:
- Опрацювати § ___________, вивчити поняття в зошиті, положення теорії О. М. Бутлерова.
- Зобразіть структурні формули молекул органічних сполук: CH4, CHCl3, C2H4, CH3NH2, (CH3)2O. (Слайд 28-30)

про публікацію авторської розробки
Додати розробку
