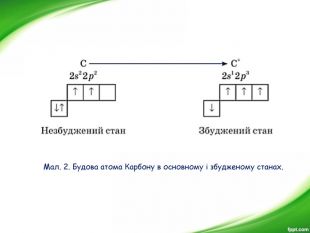
Презентація з хімії для 9-го класу на тему "Спільні й відмінні ознаки органічних і неорганічних сполук. Особливості будови атома Карбону в основному та збудженому станах"
Про матеріал
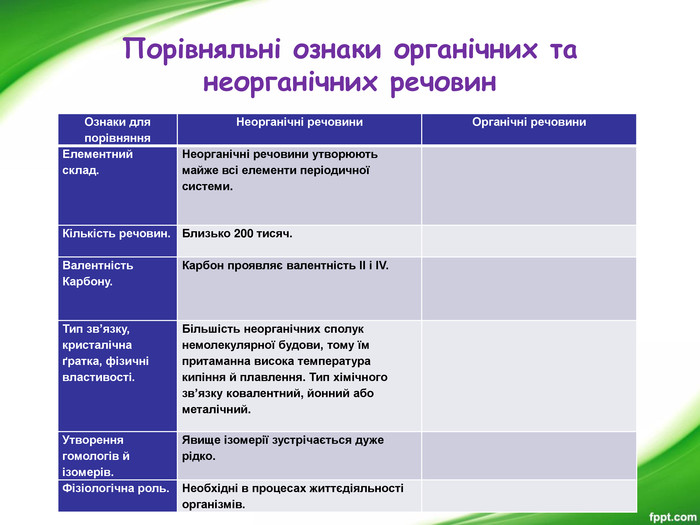
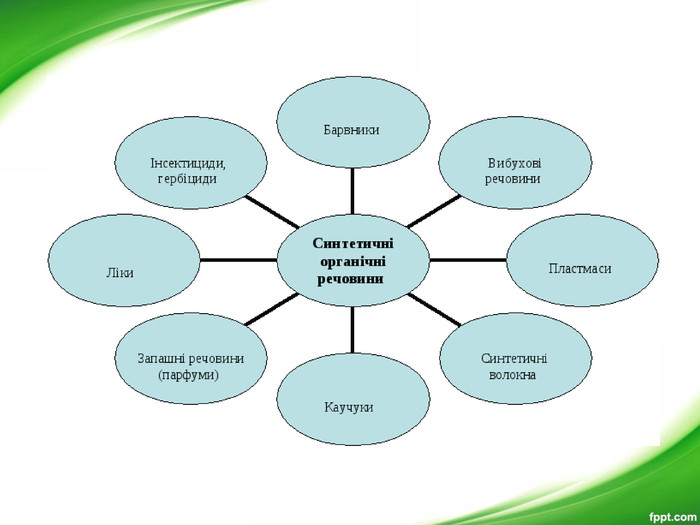
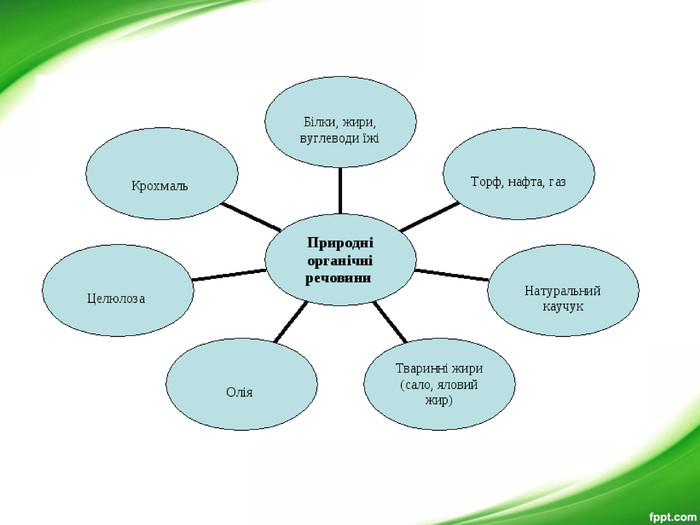
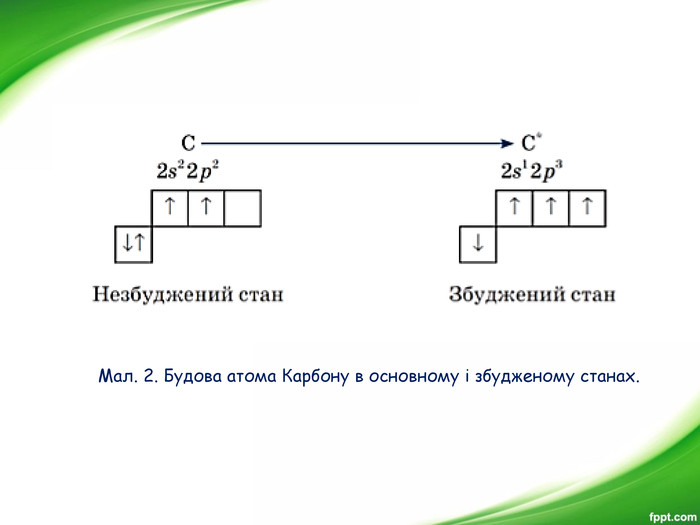
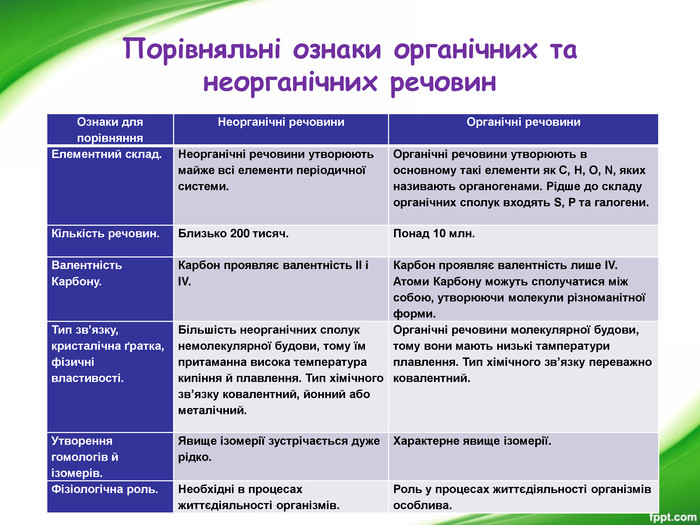
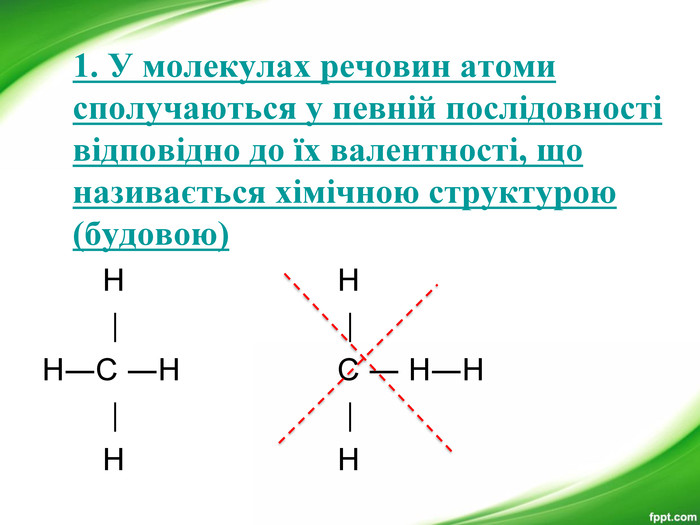
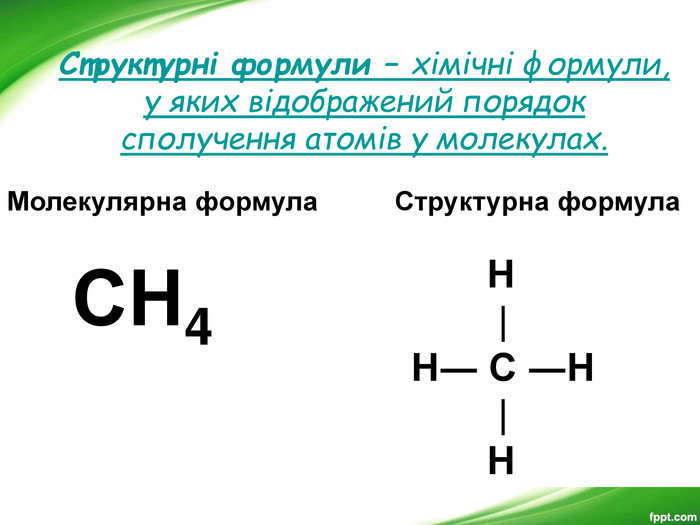
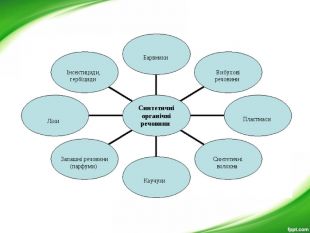
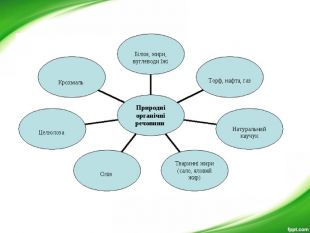
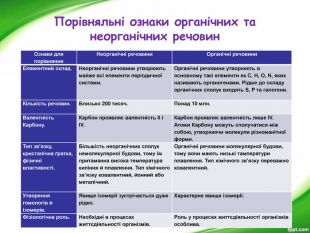
Презентація з хімії для 9-го класу допоможе вчителям організувати і провести цікавий урок з теми "Органічні речовини". Мета уроку: показати подібність і відмінності органічних і неорганічних речовин; ознайомити з предметом вивчення органічної хімії, розмаїттям органічних сполук; розкрити особливості органічних сполук порівняно з неорганічними; ознайомити учнів з короткою історією розвитку органічної хімії; ознайомити учнів з теорією хімічної будови О. М. Бутлерова.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









































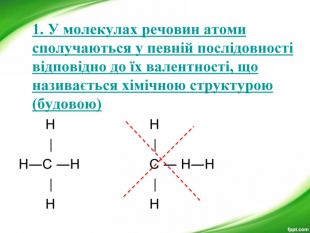

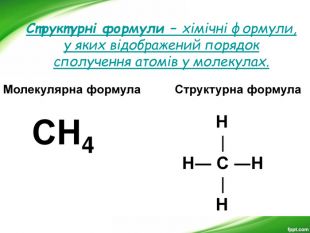





-

Осіпчук Валентина
14.01.2023 в 13:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Новик Олена
26.09.2022 в 16:38
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Almener Alisa
11.05.2021 в 17:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Янголенко Оксана Миколаївна
12.01.2021 в 21:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Туровець Олександр Антонович
17.02.2018 в 11:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука