Конспект уроку з хімії для 9 класу на тему "Швидкість хімічних реакцій"
Розробка уроку з хімії у 9 класі
Тема: Швидкість хімічних реакцій
Мета: : Сформувати поняття про швидкість хімічної реакції; розглянути фактори, які впливають на швидкість хімічної реакції: природа реагуючих речовин, температура, концентрація, поверхню зіткнення реагуючих речовин, каталізатори та інгібітори. Розвивати в учнів уміння самостійно працювати з новою інформацією, новим матеріалом, вміння аналізувати та виділяти головне, основне у вивченому матеріалі. Виховати відповідальне ставлення учнів до навчання, прагнення до творчої, пізнавальної діяльності. Розвивати мислення, самоосвітні, комунікативні компетентності, прививати інтерес до предмета.
Тип уроку: засвоєння нових знань.
Форми роботи: Фронтальна бесіда, проблемне навчання, лабораторний експеримент, робота в групах, розповідь учителя.
Обладнання та реактиви: Періодична система хімічних елементів Д.І., штатив з пробірками, цинк, розчини хлоридної кислоти, цинкова пиль, магнієві та залізні ошурки, гідроген пероксид, манган(ІV) оксид.
Хід уроку.
Найвищалюдська радість —
всемогутня радість пізнання.
І. Організація класу.
ІІ Актуалізація опорних знань
ІІІ Мотивація навчальної діяльності.
Якщо уявити пані хімію живим організмом, то хімічні реакції – серце цього організму. Щомиті в усьому світі, у природі, у будь-якому організмі відбувається безліч хімічних реакцій, які протікають з різною швидкістю.
Демонстраційний експеримент:
1) До розчину натрій карбонату додати розчину хлоридної кислоти. Скільки часу триває реакція?
2) запалити свічку; а ця реакція проходить повільніше, чи швидко?
- А скільки часу проходить реакція утворення іржі на стальному виробі? На виробництві, в природі деякі реакції тривають роками, іноді віками. Для багатьох виробничих процесів важливо знати час перебігу реакцій та ті фактори, що впливають на перебіг реакцій. Як ви думаєте, по що ми говоритимемо на уроці?
Так, про швидкість хімічної реакції. Наші завдання:
- Вивчити, що таке швидкість хімічної реакції;
- Розв’язати проблему: від чого залежить швидкість хімічної реакції та чи можна керувати цією швидкістю.
ІV. Засвоєння нових знань.
- Що таке швидкість хімічної реакції?
Давайте згадаємо, що мається на увазі під швидкістю у фізиці?
(Це довжина шляху, пройденого фізичним тілом за одиницю часу. ).
Що змінюється в часі при механічному русі? (Координати тіла, отже, довжина шляху).
Швидкість якого процесу - це зміна якої фізичної величини за одиницю часу.
- Що ж змінюється під час хімічної реакції?
Щоб відбулася хімічна реакція необхідне зіткнення частинок однієї речовини з частинками іншої. Така взаємодія призводить до утворення нових речовин. Чим більша частота таких зіткнень, тим з більшою швидкістю відбувається хімічна реакція. З плином часу зменшується кількість моль вихідних речовин, але збільшується кількість моль продуктів реакції в певному об’ємі. Чим швидше змінюється кількість речовини реагентів і продуктів реакції за певний час в певному об’ємі, тим більша швидкість реакції. Тому швидкість реакції – це зміна кількості речовини реагенту (чи продукту) в одиниці об’ємі за одиницю часу.
Величина що показує вміст кількості речовини в одиниці об’єму називається концентрацією.
![]() ,
,
де c – концентрація ![]() , ν – кількість речовини [моль], V – об’єм [л].
, ν – кількість речовини [моль], V – об’єм [л].
![]() Розрахувати швидкість можна по зміні концентрації або вихідних речовин, або продуктів. Формула буде виглядати наступним чином:
Розрахувати швидкість можна по зміні концентрації або вихідних речовин, або продуктів. Формула буде виглядати наступним чином:
![]()
Або:
![]()
Якщо для розрахунку взято концентрація вихідних речовин, то ставиться знак «-», якщо продуктів, то «+».
Швидкість реакції вимірюється в моль / (л • сек).
Отже, швидкість хімічної реакції - це зміна концентрації одного з реагуючих речовин або продуктів реакції в одиницю часу.
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика. Серед учених, що зробили вагомий внесок у її розвиток, багато імен, зокрема: Якоб Вант-Гофф (перший лауреат нобелівської премії з хімії (1901 р), якої удостоєний був за ряд відкриттів, одне з яких правило, що носить його ім’я), Сванте Арреніус (лауреат нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури), а також Петер Вааге, М. М. Семенов та інші.
- Чинники, що впливають на швидкість хімічної реакції.
В повсякденному житті виникає необхідність управляти швидкістю хімічних реакцій. Так, для розпалювання печі необхідно прискорити реакцію горіння, а для гасіння пожежі – уповільнити и припинити. Небажаною є і реакція ржавіння заліза. Якщо людина не може припинити цей процес, то хоча б повинна вміти зменшити його швидкість. Але, щоб управляти швидкістю хімічних реакцій, необхідно знати від чого вона залежить.
Постановка проблеми: Яки чинники та яким чином впливають на швидкість хімічних реакцій.
Завдання для груп.
Щоб розв’язати цю проблему, я пропоную вам стати дослідниками . Прошу вас об’єднатися в групи, і, користуючись інструктивною карткою, виконати лабораторний дослід . На основі побаченого зробити висновки, від чого залежить швидкість хімічної реакції.
Лабораторний дослід 11.
Тема: Вплив площі поверхні контакту реагентів, концентрації і температури на швидкість реакції цинку з хлоридною кислотою.
Інструктивна картка.
Пригадайте правила техніки безпеки при роботі із кислотами, нагрівними приладами, скляним посудом.
- Дослідження впливу площі поверхні контакту реагентів.
В одну пробірку покласти кусочок цинку, а в другу – цинкового пилу такої ж маси. Додати в кожну пробірку по 2 мл розбавленої хлоридної кислоти. Що спостерігаєте ? Зробіть висновки, в якій пробірці реакція відбувається швидше і чому?
Пояснення: подрібнення частинок реагуючих речовин збільшує площу контакту їх, зростає ймовірність частішого стикання активних частинок реагентів. Тому зі збільшенням площі поверхні стикання швидкість реакції зростає.
Приклад із життя: Перші цукрові заводи вибухали в повітря. На той час не було цьому пояснення. В фасувальних цехах заводу стояв «туман» - цукрова пудра. Маленький розмір крупинок цукрової пудри забезпечував максимальну площу поверхні для взаємодії з киснем. Якщо всі разом пилинки згорали – відбувався вибух потужної сили. На сучасних заводах стоять спеціальні фільтри, які перешкоджають накопиченню цукрової пудри в цехах.
- Дослідження впливу концентрації реагентів.
У дві пробірки покласти по гранулі цинку. В обидві пробірки додати по 1 мл 20%-го розчину хлоридної кислоти, а потім в одну з пробірок додати ще 1 мл дистильованої води (зменшити концентрацію кислоти в два рази) . Спостерігайте, в якій з пробірок інтенсивніше виділяється газ. Зробіть висновок, чи вприває концентрація кислоти на швидкість реакції.
Пояснення: Зі збільшенням концентрації реагентів збільшується частота зіткнень активних частинок, тому швидкість реакції зростає.
Приклад із життя: У січні 1967 року під час тренувань на космічному кораблі «Аполлон» сталася трагедія. Три американські космонавти живцем згоріли за 15 секунд. Атмосфера в кабіні американських космічних кораблів складалася з 100% кисню. Причиною пожежі стала випадкова іскра. Швидке поширення полум’я стало можливим через високу концентрацію кисню. Надалі атмосфера в космічних кораблях була розрахована 60% кисню і 40% азоту.
Розповідь учителя:
У 1867 р. норвезькі дослідники Гульдберг та Вааге сформулювали закон діючих мас. Який виражає зв’язок між швидкістю реакції та концентраціями речовин.
Закон діючих мас: Швидкість гомогенної реакції пропорційна добутку концентрацій реагуючих речовин.
Для реакції виду aA(г)+bB(г)→cC(г)+dD(г) кінетичне рівняння матиме вигляд:
![]() ,
,
де k – константа швидкості реакції, c(A) та c(B) – концентрації речовин А та В відповідно, a та b – коефіцієнти із рівняння реакції.
Як ви думаєте, від чого залежить k?
- Від природи речовин.
- Від температури.
Приклад:
N2 + 3Н2 → 2NН3.
![]() .
.
- Дослідження впливу температури на швидкість реакції.
Помістіть у дві пробірки по гранулі цинку і додайте по 1 мл розчину хлоридної кислоти. Нагрійте реагенти в одній з пробірок. Де інтенсивніше виділяється газ? Зробіть висновок, як вприває температура на швидкість реакції.
Пояснення: З підвищенням температури зростає кількість активних молекул, прискорюється хаотичний рух частинок. , вони частіше зустрічаються одна з одною. Тому швидкість реакції зростає. Охолодження сповільнює швидкість реакції, тому харчові продукти довше зберігаються при низьких температурах.
Приклад із життя: Під час проведення операцій на серці та мозку тіло людини охолоджують до 20-25 градусів для того, щоб сповільнити реакції, які відбуваються в організмі.
Розповідь учителя:
Голландський вчений Вант-Гофф визначив зв’язок між швидкістю реакції та температурю.
Правило Вант-Гоффа:
Із збільшенням температури на кожні 10 ˚C швидкість реакції збільшується в середньому у 2–4 рази.Числа від 2 до 4 називається температурним коефіцієнтом і позначається γ.
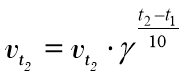 ,
,
де ![]() та
та ![]() – швидкість хімічної реакції за температури t1 та t2 відповідно
– швидкість хімічної реакції за температури t1 та t2 відповідно ![]() , γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 – кінцева та початкова температура відповідно [˚C].
, γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 – кінцева та початкова температура відповідно [˚C].
Завдання №2 для груп:
Узагальнивши результати дослідів, скласти опорну схему «Залежність швидкості реакції від різних чинників». Користуючись підручником, визначте, чи всі чинники , які впливають на швидкість реакції, ми дослідили.
Учні опрацьовують матеріал підручника, роблять висновок, що іще швидкість реакції залежить від природи реагуючих речовин та каталізатора.
Демонстраційний експеримент №5
Залежність швидкості реакцій металів (цинк, магній, залізо) з хлоридною кислотою від активності металу та концентрації кислоти.
У одну пробірку помістити магнієві ошурки, в другу – гранулу цинку, в третю – ошурки заліза. Долити по 1 мл розчину хлоридної кислоти. Що спостерігаєте?
Отже, швидкість реакції залежить від активності металів, тобто від природи реагуючих речовин (будови атомів, типів хімічних зв’язків, типів кристалічних граток). Де знаходяться метали у витиску вальному ряді? Який метал найактивніший, які менш активні? Чи узгоджується це із результатами лосліду? Реакції протікають у напрямі руйнування менш міцних зв’язків і утворення речовин з більш міцними зв’язками. Так, для розриву зв’язків у азоті і водню потрібні високі енергії,для розриву полярних молекул потрібно менше енергії, і швидкість реакції значно більша. Реакції між йонами в розчинах електролітів протікають практично миттєво.
Розповідь учителя.
Пригадайте добування кисню в лабораторії. При розкладі пероксиду гідрогену використовувався каталізатор – Манган(ІV) оксид.
- Що таке каталізатори?
Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.
Позитивні каталізатори збільшують швидкість реакції, а негативні зменшують. Речовини, які сповільнюють швидкість реакції, називаються інгібіторами. Явище прискорення швидкості реакції за допомогою каталізатора називається каталізом.
Як саме впливають каталізатори на швидкість реакції вияснимо з експерименту.
Демонстрація. Розкладання гідроген пероксиду в присутності каталізатора.
У дві пробірки налийте по 2 мл 3% розчину гідроген пероксиду. У першу пробірку опустіть тліючу скіпку (вона залишається без змін). В другу пробірку добавте на кінчику шпателя манган(ІV) оксид і також опустіть тліючу скіпку.
Про що свідчить яскраве спалахування скіпки?
За інтенсивністю виділення газу порівняйте швидкість розкладу гідроген пероксиду в обох пробірках.
![]()
Зробіть висновок про вплив каталізатора на швидкість реакції.
Механізми дії каталізаторів до кінця не з’ясовані. Існує велика кількість теорій про те яким саме чином діють каталізатори. Вчені до цих пір працюють над цим питанням. Можливо хтось із вас в майбутньому відкриє цей механізм, й одержить невеличку, розміром у 1,5 млн. доларів, нобелівську премію.
Не для всіх реакцій використовують каталізатор. Для кожної каталітичної реакції існує свій каталізатор.
Каталізатори досить поширені в живій природі. Такі каталізатори називають ферментами. За їх участю відбуваються реакції в клітинах живих організмів, перетравлення їжі в шлунку та інше.
Каталізатори використовують майже на кожному хімічному виробництві: виробництво сульфатної кислоти, аміаку та інші.
Каталізатори використовують у фільтрах призначених для очистки викидів від шкідливих газів (платинові фільтри вихлопних газів автомобілів).
Щоб зрозуміти дію каталізатора, послухайте легенду.
Помирав старий араб. Все його багатство складалося із 17 білих верблюдів. Він зібрав своїх синів і об”явив останню волю: моєму старшому сину, який є опорою сім”ї, я заповідаю половину верблюдів; середньому – третину, а наймолодший син повинен отримати дев”яту частину спадку. Після смерті батька сини почали ділити верблюдів.Але 17 не ділиться ні на 2, ні на 3, ні на 9. Йшов через пустиню старий дервіш, бідний, як усі вчені, він вів чорного облізлого верблюда. До нього й звернулися брати за допомогою. Він віддав їм свого верблюда. Скільки стало верблюдів ? 18. Старший син отримав половину - 9, середній – третину, тобто 6, а менший – дев”яту частину, тобто 2 . 9+6+2=17. А чорний верблюд залишився зайвим. Ось цей верблюд подібний ферменту. Він, як і всі каталізатори, зробив можливим процес, який без нього не відбувся б, а сам залишився без змін.
Випереджальне навчання. Учню попередньо було дано завдання підготувати сповіщення про ферменти як біологічні каталізатори.
Сповіщення учня:
В сучасній хімічній промисловості більшість процесів каталітичні. Переробка нафти, одержання барвників, виробництво сульфатної кислоти, амоніаку, полімерів, гуми - не можуть обійтися без каталізаторів.
Каталізатори використовують і у фільтрах, призначених для очистки викидів шкідливих газів.
Особливого значення в харчовій промисловості набувають ферменти - каталізатори білкової природи. За наявності ферментів тісто піднімається і збільшується в об’ємі. Тому хлібобулочні вироби такі пухкі і пористі.
Щоб швидко перетворити молоко в сметану, ряжанку та йогурт підприємства використовують фермент протеазу, який сприяє швидкому згоранню молока. Ферменти для виготовлення сиру називаються «сичужний фермент» або «пепсин». Словосполучення «сичужний фермент» означає «засолений і висушений шматочок шлунка молодих савців». Зараз на підприємствах використовують молокозгортаючі ферменти не лише тваринного, але й хімічного й рослинного походження.
Фермент целлюлаза використовують в пральних порошках. Його здатність розщеплювати білок широко використовують для виведення плям від шоколаду, соусів, крові. Головною особливістю прання з порошками, які містять комплекси ферментів є те, що прання повинне відбуватися в теплій воді, так як гаряча вода згубна для ферментів.
Використання ферментів в медицині пов’язано з їх здатністю заживлювати рани, розчиняти тромби. Застосування в лабораторії фермента глюкозооксидази дозволяє визначити вміст цукру в сечі і крові людини, фермента алкогольдегідрогенази – визначити наявність алкоголю в крові.
Нітрит натрію (NaNO2) – це речовина інгібітор, яку використовують у виробництві м’ясної і рибної продукції. Вона відома як харчова добавка Е250, що уповільнює процеси окиснення і сприяє збереженню рожевого кольору м’ясних і рибних виробів.
Вправа «Мозковий штурм».
Учні підводять підсумки залежності швидкості реакції від температури , разом складають опорну схему.
|
Фактор |
Приклад реакції |
Висновок |
|
Природа реагентів |
HCl + Zn = ZnCl2 + H2↑- швидкість менша HCl+ Mg = MgCl2 + H2↑- швидкість більша, бо Mg активніший |
Чим активніший реагент, тим швидкість реакції більша |
|
Поверхня зіткнення реагентів |
Zn (пор.) + HCl – швидк. більша Zn (гран.) + HCl – швидк. менша |
Чим більша площа зіткнення реагентів, тим більша швидкість реакції |
|
Концентрація реагентів |
HCl (10%) + Zn - швидкість менша HCl (20%) + Zn – швидкість більша |
Чим вища концентрація реагентів, тим більша швидкість реакції |
|
Температура |
HCl + Zn = ZnCl2 + H2↑- швидкість менша HCl+ Zn = ZnCl2 + H2↑- швидкість більша при підвищ. t0 |
При підвищенні температури на кожні 100 швидкість реакції зростає у 2-4 рази (правило Вант-Гоффа) |
|
Присутність каталізатора |
|
Каталізатори прискорюють швидкість реакції, інгібітори сповільнюють |
V. Закріплення знань.
Вправа «Незакінчене речення»
- Зміна концентрації реагуючих речовин за одиницю часу – це …
- Вплив температури на швидкість реакції визначається правилом …
- Речовина, яка прискорює швидкість реакції, називається …
- Речовина, яка сповільнює швидкість реакції, називається …
- З підвищенням температури швидкість реакції …
Дайте відповіді на запитання:
- Що згоряє швидше дерев’яна: дошка чи дерев`яні ошурки? (ошурки)
- Чому не можна під час пожежі відкривати вікна? (збільшується концентрація кисню)
- Чому влітку зростає небезпека харчових отруєнь (Швидкість реакції більша, бо більша температура)
- Чому харчові продукти довше зберігаються у вакуумних упаковках (немає доступу кисню)
5) Чому, аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують (збільшується площа поверхні реагуючих речовин)
6) В разі отруєння лікарі призначають активоване вугілля. Порадьте, як необхідно прийняти цей засіб, щоб ефект дії пігулок був максимально швидким (його треба подрібнити, збільшити плошу поверхні)
7) Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. Чому? (Бо мідь за своєю природою менш активна)
8) Для чого в давнину наші пращури пристосовували на самовар чобіт? (Щоб збільшити доступ повітря,а, отже, збільшити концентрацію кисню)
VІ. Рефлексія.
- Чи задоволений ти своєю роботою на уроці?
- Хто із товаришів працював найактивніше?
- Що виявилося складним?
- Над чим треба іще попрацювати?
VІІ. Домашнє завдання.
Опрацювати відповідний параграф підручника. Підготувати сповіщення на тему : «Про умови зберігання харчових продуктів»


про публікацію авторської розробки
Додати розробку
