Урок з теми: "Відносна густина газів"
|
Тема |
Відносна густина газів |
|
Мета |
- Сформувати уявлення про відносну густину газів, вивести формулу для визначення відносної густини газів; сформувати уміння обчислювати відносну густину газів, розв'язувати задачі з використанням цієї величини; - розвивати уміння порівнювати властивості газоподібних речовин на прикладі визначення їх відносної густини; - виховувати позитивні якості особистості. |
|
Обладнання та матеріали |
Періодична таблиця хімічних елементів Д. І. Менделєєва, картки з завданнями, калькулятори. |
|
Базові поняття й терміни |
Маса, об'єм, густина, нормальні умови, молярна маса, молярний об'єм. |
|
Тип уроку |
Засвоєння нових знань. |
|
Форми й методи |
Самостійна робота, постановка проблемного питання, розв'язування задач, колективна робота в класі, робота з таблицею, інтерактивна вправа «Мікрофон» |
Структура уроку
І. Організаційний етап
ІІ. Актуалізація опорних знань
ІІІ. Вивчення нового матеріалу
1. Відносна густина газів.
- Узагальнення й систематизація знань
- Домашнє завдання
- Підбиття підсумків уроку
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Самостійна робота
І варіант: ІІ варіант:
1. Обчислити молярну масу:
I – Al2O3, CuCl2, NaOH. II – H2S, Cr2O3, H2SO4.
- Визначити число молекул та атомів, та об‘єм:
І – кисню кількістю речовини 7 моль. ІІ – водню кількістю речовини 5 моль.
- Розрахуйте кількість речовини:
І – (купрум(ІІ) оксиду масою 10г.) ІІ – (купрум(І) оксиду масою 15г.)
4. Розрахуйте кількість речовини:
І – водню об‘ємом 5,6л. ІІ – кисню об‘ємом 8,9л.
III. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
ВІДНОСНА ГУСТИНА ГАЗІВ.
Проблемне питання:
Є 2 гази, які займають рівні об‘єми за однакових умов і містять однакове число молекул. Чи матимуть вони однакову масу?
(учні міркують)
Розв‘язуємо проблемну ситуацію шляхом доведення:
Запис в зошит
За умов (VPT) = const, за законом Авогадро:
N1 = N2, тоді ![]()
![]()
якщо V=1л, то m=ρ, а ![]()
![]() - відносна густина, тобто відношення густини одного газу до густини другого або густина одного газу за другим.
- відносна густина, тобто відношення густини одного газу до густини другого або густина одного газу за другим.
Що ж виражає відношення величин мас, густини, молекулярних мас?
Математично – у скільки разів одна величина більша за другу.
Фізично – у скільки разів один газ важчий за другий, якщо обидва вони займають рівні об’єми за рівних умов.
Приймемо, що кількість речовини п деякого газу дорівнює 1 моль (н. у.), тоді т = M , V = VМ і вираження густини набуває вигляду:
![]() чи
чи ![]() .
.
Ця формула використовується для визначення молярних мас невідомих газоподібних речовин за експериментальними результатами вимірювання їх густини. Оскільки молярний об'єм газів за однакових умов — величина постійна, то за постійних тиску й температури (наприклад, за н. у.) густина газу визначається тільки його молярною масою. Це дозволяє ввести величину відносної густини одного газу за іншим, котра показує, у скільки разів молярна маса одного газу відрізняється від молярної маси іншого:
![]()
Часто густину визначають відносно найлегшого газу — водню:
![]()
Оскільки (H2) = 2 г/моль, то ![]() , звідси
, звідси ![]() .
.
Густину можна розраховувати й за іншими газами, при цьому в знаменнику ставиться молярна маса газу, за яким розраховується густина. Наприклад, густина за киснем ![]() .Учитель звертає увагу учнів на те, що порівнюються молекулярні маси газів і не слід забувати, що молекули газів простих речовин двоатомні (крім інертних газів, у яких молекули одноатомні).
.Учитель звертає увагу учнів на те, що порівнюються молекулярні маси газів і не слід забувати, що молекули газів простих речовин двоатомні (крім інертних газів, у яких молекули одноатомні).
Щоб учні не змішували поняття «густина газу» і «відносна густина газу», треба звернути увагу на те, що густина має розмірність г/л, а відносна густина – величина безрозмірна.
Розв'язування задач.
- У скільки разів кисень важчий за водень?
![]()
![]()
- Яка відносна густина карбон(ІV) оксиду за воднем, киснем, повітрям?
![]()
![]()
![]()
- Відносна густина парів йоду за воднем 127. Запишіть молекулярну формулу йоду.
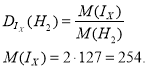
- Визначити молярну масу кисню, якщо відомо, що маса 1л (н.у.) = 1,43г.
![]()
ІV. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Колективна робота в класі
Завдання.
- Розрахуйте густину амоніаку NH3 за воднем і за повітрям.
- Знайдіть молярну масу газу, якщо його густина за воднем дорівнює 15.
- Яка молекулярна формула фосфору, якщо у газоподібному стані він має відносну густину за воднем 62?
Робота з таблицею.
Учні заповнюють таблицю. Цю роботу можна провести у вигляді естафети, організувавши дві чи три команди (учні по черзі виходять до дошки й заповнюють таблицю).
|
Варіант
|
Формула газу
|
Кількість речовини, моль |
Молярна маса, г/моль
|
Об'єм газу, л
|
Кількість молекул |
Відносна густина |
|
|
|
за воднем |
за повітрям |
|||||
|
І |
H2S N2 |
0,7 3 |
|
|
|
|
|
|
II |
CH4 N2 |
2,5 0,8 |
|
|
|
|
|
|
III |
CO2 Cl2 |
1,8 0,1 |
|
|
|
|
|
V. ДОМАШНЄ ЗАВДАННЯ
1. Вивчити § 22
2. Виконати завдання №163, №164*.
VІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Використовуємо технологію колективно-групового навчання «Мікрофон», яка надає можливість кожному щось сказати швидко, по черзі, висловлюючи свою думку чи позицію.
Сьогодні на уроці ми:
- дізналися …
- навчилися …
- було цікавого.
Додаток
Картка № 1.
І варіант:
1. Обчислити молярну масу: Al2O3, CuCl2, NaOH.
2. Визначити число молекул та атомів, та об‘єм: кисню кількістю речовини 7 моль.
3. Розрахуйте кількість речовини: (купрум(ІІ) оксиду) масою 10г.
4. Розрахуйте кількість речовини: водню об‘ємом 5,6л.
Картка № 2.
ІІ варіант:
1. Обчислити молярну масу: H2S, Cr2O3, H2SO4.
2. Визначити число молекул та атомів, та об‘єм: водню кількістю речовини 5 моль.
3. Розрахуйте кількість речовини: (купрум (І) оксиду) масою 15г.
4. Розрахуйте кількість речовини: кисню об‘ємом 8,9л.


про публікацію авторської розробки
Додати розробку
