Конспект уроку з теми: "Закон Авогадро. Молярний об'єм газів"
|
Тема |
Закон Авогадро. Молярний об'єм газів |
|
Мета |
- Сформувати уявлення про суть закону Авогадро, ввести поняття молярного об'єму газів; вивести формулу обчислення кількості речовини з використанням молярного об'єму газів; сформувати навички розв'язування задач з використанням об'єму газу за нормальних умов; - розвивати вміння розмірковувати та використовувати теоретичні знання при вирішуванні розрахункових задач; - виховувати уміння співпрацювати у колективі та об’єктивно оцінювати свою роботу та роботу інших; на основі використання міжпредметних зв‘язків (фізика, математика) сприяти формуванню елементів наукового світогляду. |
|
Обладнання |
Періодична система хімічних елементів Д.І.Менделєєва, підручник, збірник задач: Кукса С.П. «600 задач з хімії», картки з завданнями, комп’ютер. |
|
Базові поняття й терміни |
Моль, об'єм речовини, тиск, температура, агрегатний стан речовини — газоподібний, молярна маса. |
|
Тип уроку |
Комбінований, з використанням комп’ютерної підтримки. |
|
Форми й методи |
Інтерактивна вправа «Мікрофон», «Мозковий штурм», «Результат», розповідь, робота з підручником, доповідь учня, колективне обговорення, самостійна робота в парах, прийом «Взаємоперевірка», робота зі схемою, тренувальні вправи |
Структура уроку
- Організаційний етап
- Актуалізація опорних знань
- Повідомлення теми, мети, завдань уроку та мотивація навчальної діяльності
- Вивчення нового матеріалу
- Закон Авогадро.
- Молярний об'єм газів.
- Розв'язування задач із використанням молярного об'єму газу.
- Узагальнення й систематизація знань
- Домашнє завдання
- Підбиття підсумків уроку
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Інтерактивна вправа «Мікрофон»
- Що таке кількість речовини?
- У яких одиницях вимірюється кількість речовини?
- Якою літерою позначається кількість речовини?
- Як позначається стала Авогадро?
- Чому дорівнює число Авогадро?
- Формула визначення кількості речовини, використовуючи сталу Авогадро.
- Формула визначення числа молекул, атомів або йонів.
- Що таке молярна маса?
- Чому чисельно дорівнює молярна маса?
- Формула визначення кількості речовини, використовуючи масу.
III. ПОВІДОМЛЕННЯ ТЕМИ, МЕТИ, ЗАВДАНЬ УРОКУ ТА МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Мозковий штурм
Спробуйте заплющити очі і пригадати все, що ви пов’язуєте зі словом «ГАЗ».
(учитель вислуховує учнів, записує вислови на дошці).
Пригадайте з курсу фізики: за якою формулою можна розрахувати об’єм газу?
ІV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ЗАКОН АВОГАДРО.
Розповідь учителя
Учитель пояснює суть закону Авогадро.
Запис в зошит: 1 моль будь-якого газу за н.у. містить 6,02 ∙ 1023 молекул.
В однакових об‘ємах різних газів за однакових умов міститься рівне число молекул.
Робота з підручником стор.19 мал.3.
Варто акцентувати увагу учнів на тому, що цей закон справедливий тільки для ідеальних газів (у газах розміри молекул незначні порівняно з міжмолекулярними відстанями, тому їх розмірами можна знехтувати) і не застосовується для рідин.
Доповідь учня
«Історична роль закону Авогадро»
2. МОЛЯРНИЙ ОБ'ЄМ ГАЗІВ.
Колективне обговорення.
Відповідно до закону Авогадро у рівних об'ємах різних газів за однакових умов міститься рівне число молекул. Яка ще величина характеризується однаковим числом частинок? (Відповідь: моль.)
Учитель пропонує об'єднати ці два судження. Необхідно дійти висновку про те, що
1 моль будь-якого газу за однакових умов займає однаковий об'єм. Це перший наслідок, що випливає із закону Авогадро.
Розповідь учителя.
Учитель конкретизує умови: тиск 101,3 кПа й температура 273 K, тобто 1 атм. і 0°С (1 градус Цельсія дорівнює 1 градусу Кельвіна, 0 °С = 273 K, тоді 1 °С дорівнює 274 K, а -1 °С дорівнює 272 K). Ці (умови називаються нормальними.
За таких умов 1 моль будь-якого газу займає об'єм, що дорівнює приблизно 22,4 л. Цей об'єм називається молярним: VM = 22,4 л/моль.
Завдання.
Вивести формули для розрахунку кількості речовини газу за відомим об'ємом і об'єму газу — за відомою кількістю речовини.
Розповідь учителя.
За якими ще формулами розраховується кількість речовини (з використанням молярної маси й числа Авогадро).
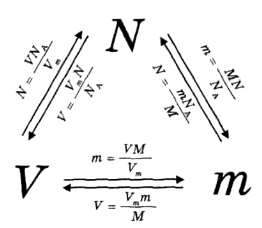
Варто простежити, щоб формули ![]() були записані на дошці одночасно. Учитель пропонує об'єднати ці формули з урахуванням того, що кількість речовини однакова, тобто ліві частини рівнянь рівні. Зрозуміло, будуть рівні й праві частини, тобто
були записані на дошці одночасно. Учитель пропонує об'єднати ці формули з урахуванням того, що кількість речовини однакова, тобто ліві частини рівнянь рівні. Зрозуміло, будуть рівні й праві частини, тобто ![]() Можна дати таку схему:
Можна дати таку схему:
3. РОЗВ'ЯЗУВАННЯ ЗАДАЧ ІЗ ВИКОРИСТАННЯМ МОЛЯРНОГО ОБ'ЄМУ ГАЗУ.
Завдання.
Учням пропонуються для розв'язування задачі таких типів (усі об'єми дані за нормальних умов).
- Знайти об'єм газу за відомою кількістю речовини. (Який об‘єм займе 0,5 моль водню?)
- Знайти кількість речовини газу за відомим об'ємом. (Скільки моль становить 2,8 л вуглекислого газу?)
- Знайти масу певного об'єму газу. (Визначте масу азоту, що знаходиться в балоні об‘ємом 2л.)
- Знайти об'єм певної маси газу. (Який об‘єм за н.у. займе 68г рідкого аміаку?)
- Знайти число молекул газу за відомим об‘ємом. (Визначити кількість молекул в 5л водню за н.у.)
V. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Самостійна робота (робота в парах).
(Учні працюють на аркушах паперу)
І варіант:
- Під час розкладу води електричним струмом було одержано 6 г водню. Який об'єм займе цей газ (н. у.)?
- Визначте масу кисню, що знаходиться в балоні об'ємом 3 л (н. у.).
3) Скільки молекул азоту знаходиться в балоні об'ємом 20 л (н. у.).
ІІ варіант:
1) Який об‘єм (н.у.) займає 20 г водню?
2) Знайти масу чадного газу (СО), що знаходиться в балоні об‘ємом 15 л (н.у.).
3) Скільки молекул йоду знаходиться в балоні об‘ємом 6л (н.у.)?
Після виконання роботи учні обмінюються завданнями та перевіряють за зразком, який представлений на моніторі комп’ютера і виставляють бали сусіду. Аркуші здають учителю, а він після перевірки виставляє оцінки.
VІ. ДОМАШНЄ ЗАВДАННЯ
1. Вивчити §21
2. Виконати завдання № 155, №156*.
VІІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Інтерактивна вправа «Результат»
Учні по черзі роблять висновки про те, чого вони навчилися на уроці, якого результату досягли.
Додаток
Картка № 1
І варіант:
- Під час розкладу води електричним струмом було одержано 6 г водню. Який об'єм займе цей газ (н. у.)?
- Визначте масу кисню, що знаходиться в балоні об'ємом 3 л (н. у.).
-
Скільки молекул азоту знаходиться в балоні об'ємом 20 л (н. у.).
Картка № 2
ІІ варіант:
1) Який об‘єм (н.у.) займає 20 г водню?
2) Знайти масу чадного газу (СО), що знаходиться в балоні об‘ємом 15 л (н.у.).
3) Скільки молекул йоду знаходиться в балоні об‘ємом 6л (н.у.)?


про публікацію авторської розробки
Додати розробку
