Лабораторна робота "Електроліз"
ЛАБОРАТОРНА РОБОТА
Мета роботи: визначити електрохімічний еквівалент міді застосовуючи закон Фарадея.
Обладнання: склянка з водним розчином сульфату міді (CuSO4); електроди; джерело постійного струму; прилад для вимірювання часу; амперметр постійного струму на 1-6 А; ваги; реостат; вимикач; з'єднувальні провідники;
Хід роботи:
1.Повторити правила безпеки у фізичному кабінеті.
2. Ретельно очистити поверхню мідних пластин наждачним папером.
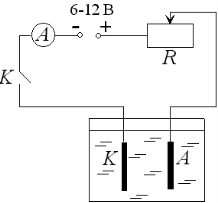 3. Виміряти масу катода m1 до проведення досліду з точністю до 0,01г.
3. Виміряти масу катода m1 до проведення досліду з точністю до 0,01г.
4. Закріпити електроди у тримачі (зважену пластинку з’єднати з від’ємним полюсом джерела) і, не занурюючи їх у ванну з розчином.
5. Скласти електричне коло за наведеною схемою схемою.
6. Занурити електроди у ванну з розчином, замкнути коло, встановити за допомогою реостата силу струму в колі не більшу 1А і зафіксувати час.
7. Процес електролізу повинен тривати 5-20 хвилин, при цьому силу струму в колі підтримуйте незмінною (за допомогою реостата).
9. Визначити масу міді, що виділилась на катоді.
10. Зробити необхідні обчислення та занести результати до таблиці.
Закон Фарадея. Маса речовини, яка виділилася на електроді, прямо пропорційна заряду, який пройшов через електроліт:
m = kIt або m=kq
Дивимось таблицю значень електрохімічних еквівалентів. Знайдіть значення k для міді - 0,33 мг/Кл.
В ролі електроліта у нас розчин сульфату міді (CuSO4). Тобто на катоді буде осідати - ____________ .
ЗАВДАННЯ: потрібно визначати масу міді, яка осіла на катоді через 3хв, 5 хв, 10 хв, 25 хв.
Результати вимірювань та обчислень занести до таблиці
|
№ |
Час, хв |
Сила струму |
Початкова маса катода |
Маса катода після досліду |
Маса виділеної речовини |
k (табличне) мг/Кл |
k |
|
1 |
3 |
|
|
|
|
0,33 |
|
|
2 |
5 |
|
|
|
|
0,33 |
|
|
3 |
10 |
|
|
|
|
0,33 |
|
|
4 |
25 |
|
|
|
|
0,33 |
|
Розрахунки :
Висновок : _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________


про публікацію авторської розробки
Додати розробку
