Лекція-практикум "Розчини. Способи вираження концентрації розчинів"
Методична розробка навчального заняття з дисципліни «Аналітична хімія та інструментальні методи», мета якої - ознайомити студентів із значенням розчинів в технології, техніці і природі, сформувати поняття “розчини", "розчинність", "концентрація розчинів", розглянути класифікацію розчинів, фактори, що впливають на розчинність речовин, з'ясувати суть хімічної теорії розчинів та процесу розчинення, навчитися визначати різні види концентрації розчинів, розв'язувати задачі на визначення масової і об'ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
Методична розробка навчального заняття з дисципліни «Аналітична хімія та інструментальні методи»
Навчально-методична карта заняття
Дисципліна: Аналітична хімія та інструментальні методи
Тема заняття: Розчини. Способи вираження концентрації розчинів.
Вид заняття: Лекція-практикум
Мета заняття:
Навчальна: ознайомити студентів із значенням розчинів в технології, техніці і природі, сформувати поняття “розчини”, ”розчинність”, ”концентрація розчинів”, розглянути класифікацію розчинів, фактори, що впливають на розчинність речовин, з’ясувати суть хімічної теорії розчинів та процесу розчинення, навчитися визначати різні види концентрації розчинів, розв’язувати задачі на визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
Розвиваюча: розвивати пізнавальний інтерес до дисципліни, логічне мислення, самостійність при розв’язуванні задач, увагу, пам’ять, уміння
виділяти головне, робити висновки.
Виховна: формувати науковий та політехнічний світогляд компетентного спеціаліста, сприяти розвитку організаційно-управлінської, технологічної та контролюючої функції спеціаліста. Реалізувати всі напрямки програми Національного виховання студентської молоді.
Теоретична: Знати поняття “розчини”,”розчинність”, ”концентрація розчинів”, їх природу, класифікацію, механізм розчинення речовин, визначення різних видів концентрації розчинів.
Практична: Вміти визначати розчинність твердих речовин у воді, розв’язувати задачі на визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
МІЖПРЕДМЕТНІ ЗВЯЗКИ
Забезпечуючі:
Хімія, Вища математика.
Забезпечувані:
Фізчна хімія, Загальна технологія тугоплавких неметалевих і силікатних матеріалів і виробів, Технологія в’яжучих матеріалів, Навчальна практика з технології тугоплавких неметалевих і силікатних матеріалів і виробів, Техніка аналітичних робіт, Безпека життєдіяльності, Основи екології.
Забезпечення заняття
1. Наочні посібники: періодична система хімічних елементів Д.І Менделєєва; таблиця розчинності, таблиця “Залежність розчинності речовин від температури”,“Залежність розчинності речовин від природи розчиненої
речовини”; макети: “Мариновані овочі”, “Сік”, “Молоко, “Алкогольні
напої”, “Оцтова кислота”, ”Парфуми”, “5 % розчин йоду,” “1 % розчин бріліанта зеленого”, “3 % розчин гідроген пероксиду ”, “Краплі назальні”, “Сироп від кашлю”, “Зубна паста”, склянки з написом: “Повітря”, “Морська вода”, “0,2 % розчин хлорного вапна”, “2 % розчин кальцинованої соди ”,
“1 % розчин соди”, колекція сплавів, мінералів.
Реактиви: вода (Н2О); оцтова кислота (СН3СООН), натрій хлорид NaCl,
цукор.
Обладнання: бюкси для зважування - 3 шт., електронні ваги, циліндр мірний 250 см3 – 2 шт., колба плоскодонна 500 см3 -2 шт. , шпателі, склянки, скляні палички.
2. Роздатковий матеріал: опорний конспект “Розчини”
З.ТЗН: презентація “Розчини. Способи вираження концентрації розчинів”, відеофільм “Загальні властивості розчинів”, відеодослід “Розчинення твердих речовин у воді”
Література:
Основна
- З.А. Барсукова Аналитическая химия М.: «Высшая школа», 1990 г.
- М.Є. Полесс И.М. Душечкина Аналитическая химия М.: «Медицина», 1987 г.
- С.А. Шапиро, Я.А. Гурвич Аналитическая химия М.: «Высшая школа», 1973 г.
- М.В. Романова Основи хімічного аналізу К.: «Ірпинь», 1998 р.
Довідкова
- Ю.Ю. Лурье Справочник по аналитической химии М.: «Химия». 1979 г.
- А.А. Ярославцев Сборник задач и упражнений по аналитической химии М.: «Высшая школа», 1966
Додаткова
- К.М. Ольшанова, С.К. Пискарева Аналитическая химия. М.: Химия, 1980 г.
- Р.Т. Марченко Физическая и коллоидная химия М.: «Высшая школа». 1965 г
- Ю.С. Лямеков Физико-химические методы анализа М.: «Химия», 1974 г.
-
А.П. Корешков Основы аналитической химии, т 1-3, М.: «Химия», 1965 г., Ю.М. Волгина М. Стройиздат. 1982
Викладач:
Доброго дня! Я рада бачити Вас знову у нашій творчій лабораторії.
Нас чекає напружена і цікава робота, девізом якої нехай стануть слова видатного вченого М.В. Ломоносова: “Хімії навчитися неможливо, якщо не бачити самої практики і не братися за хімічні операції ”.
План
- Розчини. Поняття про розчини.
- Засоби вираження концентрації розчинів
- Розрахунки при приготуванні розчинів різної концентрації.
Викладач:
Зверніть, будь ласка, увагу на продукцію, що виставлена на столі. Як Ви вважаєте, що є спільним для всіх виставлених предметів?
Очікувана відповідь:
Всі вони або є розчинами або виготовлені з використанням розчинів.
Викладач:
Як Ви думаєте, з якою метою вони виставлені на занятті?
Очікувана відповідь:
Вони пов’язані з темою нашого заняття.
Викладач:
Дійсно, сьогодні ми поговоримо про добре знайомі кожній людині розчини.
Давайте поміркуємо над питанням: чому Вам потрібно вивчати цю тему переглянувши фрагмент відеофільму.
Перегляд фрагменту відеофільму “Загальні властивості розчинів”.
Очікувана відповідь.
Розчини й сам процес розчинення мають велике значення у природі, у нашому житті, у промисловості і сільському господарстві. Найчастіше ми маємо справу не з чистими речовинами, а із сумішами або розчинами.
Викладач:
Дійсно, з розчинами ми зустрічаємось повсякчасно.
Вода морів, річок, озер, ґрунтові води, питна вода — це розчини. Повітря — це розчин газів. Більшість мінералів — це тверді розчини.
Розчини — однорідні системи, що складаються з двох і більше компонентів і продуктів їх взаємодії. Розчини належать до однорідних сумішей. Так, водні розчини складаються з розчинника (води), розчиненої речовини та продуктів їхньої взаємодії — гідратованих (сполучених з молекулами води) йонів.
Розчинність — здатність речовини розчинятися у воді або іншому розчиннику. Розчинність виражають максимальною кількістю грамів речовини, яку можна розчинити в 100 г розчинника при даній температурі. Розчинність іноді називають коефіцієнтом розчинності.
Як Ви вважаєте, чи можна прискорити процес розчинення речовин?
Очікувана відповідь:
Для прискорення розчинення можна розчин нагріти, а також перемішати.
Кількісно розчинність виражають як відношення маси розчиненої речовини в насиченому розчині до 100 г (або 1 л) води (за даної температури). Ця величина називається коефіцієнтом розчинності, або розчинністю.
З біології Ви вже знаєте, що без розчинів не виникло б життя на нашій планеті. Адже доісторичні організми спершу отримували необхідні для життєдіяльності речовини лише з водного середовища.
Людина складається на 80% із води. Всі важливі біологічні процеси існування від найпростіших організмів до людини відбуваються за участю водних розчинів різних речовин. Поживні речовини переносяться по організму всіх живих істот лише у розчиненому стані.
Розчинами є найважливіші фізіологічні рідини - кров, лімфа тощо.
Життєдіяльність людини відбувається завдяки використанню продуктів, що вирощує сільське господарство, внесенню мінеральних добрив до ґрунту, які розчиняються водою, утворюючи розчини, що покращують врожайність, витривалість рослин від хвороб, захищеність від шкідників покращується за рахунок використання різних розчинів.
Розчини використовують також у виробничих процесах. Важко назвати яку-небудь галузь промислового виробництва, де не використовувалися розчини.
Наочні приклади використання розчинів у побуті та житті людини Ви бачите перед собою та на екрані.
Вміти приготувати розчин – це життєва потреба кожного з нас.
Актуалізація життєвого досвіду і опорних знань студентів
Викладач:
Пропоную Вам приготувати найпростіші розчини, які ми використовуємо вдома, під час приготування їжі.
Наприклад, для розморожування риби, з метою збереження корисних мінеральних речовин, застосовують замочування її у розчині солі, який готують з розрахунку 7-10г солі на 1 л води.
Другій розчин ми використовуємо як заправку для салатів: він складається з води, оцту, цукру і солі. За бажанням можна додати і олії.
Перед тим, як приготувати розчини, пригадаємо правила техніки безпеки при роботі з речовинами і скляним посудом.
Правила техніки безпеки при роботі з речовинами і скляним посудом:
- Приступайте до виконання роботи тільки після ознайомлення з текстом інструкції рецептур.
- Користуйтеся чистим і придатним для роботи посудом.
- Роботу проводьте стоячи, тільки над столом.
- Обережно поводьтесь з кухонним посудом і обладнанням! У разі незначних порізів рану обробити йодною настоянкою і накласти марлеву пов'язку.
-
 Під час роботи забороняється:
Під час роботи забороняється:
а б в г
- набирати однією й тією ложкою різні речовини (а);
- брати речовини незахищеними руками (б),
- залишати неприбраними розсипані або розлиті речовини (в),
- залишати відкритими склянки з рідинами та банки з сухими речовинами (г)
Завдання:
Приготувати розчин кухонної солі для розморожування риби та заправку для салату згідно рецептур:
Сольовий розчин:
- сіль – 10 г;
- вода – 1л.
Заправка для салатів:
- вода - 280 г.
- оцет - 220 мл;
- цукор - 45 г;
- сіль - 10 г
Викладач:
На нашій “кухні”, на жаль, немає ємкості на 1 л. Давайте зменшимо об’єм сольового розчину і приготуємо не 1 л, а 250 мл такого розчину. Розрахуйте, будь ласка, скільки ж солі і води нам потрібно буде взяти в даному випадку?
Очікувана відповідь:
На 250 мл води потрібно взяти 2,5 г солі.
Для приготування розчинів Вам знадобляться наступні обладнання і речовини.
Порядок дій при приготуванні розчинів.
Сольовий розчин.
- Зважити 2,5 г кухонної солі.
- Сіль помістити у посудину, в якій готуватимуть розчин.
- За допомогою мірного посуду відміряти 250 мл води.
- Воду повільно долити у посудину з кухонною сіллю і, помішуючи речовини паличкою, приготувати розчин.
-
Приготовлений розчин перелити у банку з етикеткою та закрити корком чи кришкою.
Заправка для салатів:
- Відміряти 280 мл води налити у посудину, в якій готуватимуть розчин.
- Зважити 45 г цукру і помістити у посудину з водою, перемішати до розчинення цукру.
- Зважити 10 г кухонної солі і помістити у посудину з розчином цукру, перемішати до розчинення солі.
- За допомогою мірного посуду відміряти 220 мл оцту, повільно долити у посудину з розчином цукру і солі і, помішуючи речовини паличкою, приготувати розчин.
- Приготовлений розчин перелити у банку з етикеткою та закрити корком чи кришкою.
Викладач:
Чому воду, при приготуванні розчинів не зважують, а відміряють мірним посудом?
Очікувана відповідь:
Воду ніколи не зважують, бо її об'єм і маса збігаються. Так, 1 л води
важить 1 кг, 100 мл—100 г. Тому зважувати воду немає потреби.
Два студента готують задані розчини. Викладач контролює дії студентів і при необхідності допомагає їм.
Викладач:
На прикладі виготовленого сольового розчину, поясніть поняття: “розчинник”, “розчинена речовина”.
Очікувана відповідь:
“Розчинник” – речовина, в якій розчиняють. В нашому прикладі
розчинником є вода.
“Розчинена речовина” – речовина, яку розчиняють. В нашому розчині це – кухонна сіль.
Викладач:
Проблема: А як визначити, яка речовина буде розчинником, а яка розчиненою речовиною, якщо обидві речовини до розчинення перебувають в однаковому агрегатному стані, наприклад оцет і вода, як в нашому другому розчині?
Очікувана відповідь:
Розчинником вважають речовину, якої в розчині більше.
Висновок:
Компонент, якого є більше, називають розчинником, а якого менше – розчиненою речовиною. Якщо один компонент рідина, а другий – тверде тіло або газ, то розчинником називають рідину, незалежно від її кількості в суміші.
Викладач:
- Скільки компонентів входить до складу приготовлених розчинів?
- А скільки взагалі може входити компонентів до складу розчинів ?
Очікувана відповідь:
- До складу першого розчину входить два компонента: вода і сіль, а до складу другого - чотири.
- Не менше двох.
Викладач:
Чи можна стверджувати, що розчини бувають лише рідкими?
Примітка:
Звернути увагу студентів на склянку з повітрям (газоподібний розчин),
зразок мінералу або сплаву (твердий розчин).
Очікувана відповідь:
Ні. Розчини можуть бути рідкими, газоподібними (повітря), твердими (сплави).
Викладач:
- Чи можна стверджувати, що обов’язковим компонентом всіх рідких
розчинів є вода?
- В яких рідинах, крім води, можна розчиняти речовини?
Очікувана відповідь:
- Ні.
- Досить часто для розчинення використовують інші рідини: спирт,
ацетон, бензин, оліфу, рослинну олію, молоко тощо.
Викладач:
Чим розчин відрізняється від суміші?
Очікувана відповідь:
Розчин – однорідна система, а в суміші помітні окремі складові частинки.
Викладач:
Чим розчин відрізняється від складної речовини?
Очікувана відповідь:
Розчини не мають постійного складу.
Викладач:
На вашу думку, що ж таке розчини?
Очікувана відповідь:
Розчини – це однорідні (гомогенні) системи змінного складу, які
складаються з двох або більше незалежних компонентів.
Класифікація розчинів
Розчини
![]()
![]()
![]()
За агрегатним За розчинністю Ненасичені за вмістом
станом: речовин: розчиненої речовини
- рідкі - насичені - концентровані
- тверді - ненасичені - розведені
- газоподібні - перенасичені
- Насичений розчин - це розчин, в якому речовина за даних умов
більше не розчиняється,
- Ненасичений розчин - це розчин, у якому вміст розчиненої речовини
менший, ніж у насиченому за даної температури.
- Перенасичений розчин містить розчиненої речовини більше, ніж
насичений за даної температури. Перенасичені розчини нестабільні і за найменшого впливу досить легко переходять у насичені з вивільненням надлишку розчиненої речовини (надлишок розчиненої речовини переходить в осад). Ці розчини застосовують для очищення речовин методом перекристалізації та вирощення кристалів.
Проблема:
Поясніть:
- Як можна з насиченого розчину зробити ненасичений?
Очікувана відповідь:
Нагріти, додати розчинник.
- Чи можна з ненасиченого розчину зробити насичений?
Очікувана відповідь:
Остудити, додати розчиненої речовини, випарити розчинник.
- Концентровані - кількості розчиненої речовини і розчинника
виражені співставними величинами.
- Розведені – вміст розчиненої речовини значно менший, ніж вміст
розчинника.
Найпоширенішим розчинником є вода. Як Ви вважаєте, чи всі речовини однаково розчиняються у воді.
Очікувана відповідь:
Ні. За розчинністю у воді всі речовини поділяють на три групи:
малорозчинні, розчинні і нерозчинні.
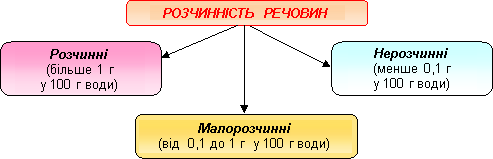
Класифікація твердих та рідких речовин за розчинністю
Вода — полярний розчинник
У молекулі води зв’язки між атомами Оксигену і Гідрогену ковалентні полярні, електронна густина зміщена в бік Оксигену як більш електронегативного елемента. На атомі Оксигену внаслідок цього накопичується негативний заряд, а на атомах Гідрогену — позитивний.
Тому молекула води полярна, вона називається диполем (два полюси — позитивний і негативний).
За розчинністю у воді всі речовини можна поділити на три групи:
1) добре розчинні — в 100 г води за кімнатної температури розчиняється більше 10 г речовини;
2) малорозчинні — в 100 г води за кімнатної температури розчиняється менше 1 г речовини;
3) практично нерозчинні — в 100 г води за кімнатної температури розчиняється менше 0,1 г речовини.
Абсолютно нерозчинних речовин не існує.
Висновок:
Розчинність речовини — це її здатність переходити у розчин.
Розчинність дорівнює концентрації речовини у насиченому розчині. Вона залежить від природи розчиненої речовини і розчинника та зовнішніх чинників — температури і тиску.
2. Способи вираження концентрації розчинів.
Сьогодні Ви готували розчини згідно рецептури, але на виробництві дуже часто приходиться спочатку за допомогою математичних обчислень визначити склад розчину: масу розчиненої речовини, масу чи об'єм розчинника, і тільки після чого приступати до приготування розчину.
Склад розчину кількісно визначається концентрацією: співвідношенням кількості розчиненої речовини і розчинника.
Існують різні способи вираження концентрації розчинів.
Найчастіше використовується масова частка розчиненої речовини (відсоткова концентрація), яка показує, скільки грамів розчиненої речовини міститься в 100г розчину і обчислюється за формулою:
С% = ![]() (%); звідки
(%); звідки
mречовини = ![]() , mрозчину =
, mрозчину = ![]()
Молярна концентрація (См) - показує, скільки молів розчиненої
речовини міститься в 1 л розчину і дорівнює відношенню кількості розчиненої речовини до об’єму розчину: См = ![]() , звідки
, звідки
mречовини = ![]() , а V =
, а V = ![]()
Молярна концентрація еквівалента (нормальна концентрація) СN показує, скільки моль-еквівалентів речовини міститься в 1 л розчину і визначається за формулою: СN = ![]() , [ моль-екв. /л ], звідки
, [ моль-екв. /л ], звідки
mречовини = СN Мекв V , (г) Vрозчину = ![]() , (л)
, (л)
Молярні маси еквівалентів визначають за формулою:
Mекв. речовини =![]() ,
,
де М - молярна маса речовини;
Е - n- валентність (для елементів);
- основність (для кислот);
- кислотність (для основ);
- заряд атома металу х кількість атомів металу (для солей)
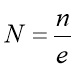
 нормальність
нормальність
е – еквівалент розчину.
Нормальність показує кількість речовини в 1 г-екв. Розчину.
1). 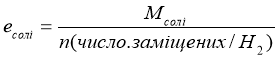
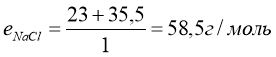
2). 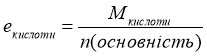
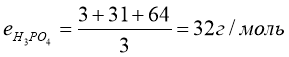
3. 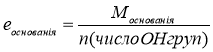
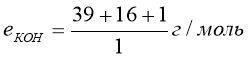
5. 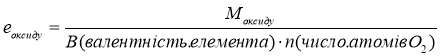
![]()
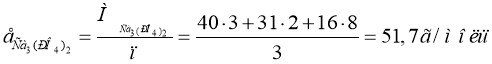
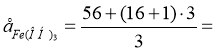
Закріплення знань.
Завдання. Знайти масу грам-еквівалента в таких речовинах:
![]()
![]()
![]()
![]()
![]()
![]()
3. Розрахунки при приготуванні розчинів різної концентрації.
Задача 1. З метою запобігання потемнінню картоплю сульфітують: протягом 5 хв. оброблять водним розчином бісульфіту натрію концентрацією 0,5-1 % .
Яку масу бісульфату натрію (NaНSO3) необхідно взяти для приготування 500 г 0,5 % розчину?
![]() Дано: Розв’язування:
Дано: Розв’язування:
mрозчину = 500 г Використовуємо формулу:
С =0,5 % С% = ![]()
![]() mNaHSO3=? 0,5% =
mNaHSO3=? 0,5% = ![]()
m NaHSO3 =![]()
Відповідь: необхідно взяти 2,5 г бісульфату натрію .
Задача 2. Для дезінфекції обладнання, інвентарю кондитерського цеху, прибирального інвентарю використовують 2% розчин хлорного вапна.
Визначте молярну концентрацію розчину хлорного вапна (Са(СlO)Cl), якщо в 10 л розчину міститься 200 г Са(СlO)Cl?
![]() Дано: Розв’язування:
Дано: Розв’язування:
m Са(СlO)Cl -200г
V =10 л Використовуємо формулу:
![]() См =? См =
См =? См = ![]()
М(Са(СlO)Cl) = 40+ 35,5 + 16 + 35,5 = 127 г/моль
См = ![]()
Відповідь: молярна концентрація розчину хлорного вапна 0,16 моль/л.
Задача 3. Для визначення кислотності хліба методом кислотно-основного титрування використовують робочий розчин натрій гідроксиду.
Скільки грамів натрій гідроксиду (NаОН) потрібно взяти для приготування 250 мл 1 н розчину.
![]() Дано: Розв’язування:
Дано: Розв’язування:
Сн = 1н
V =250 мл=0,25 л Використовуємо формулу:
![]() m(NaОН) =? Сн =
m(NaОН) =? Сн = ![]() , звідки
, звідки
mречовини = m(NaОН) = ![]() ,
,
Мекв (NaОН) =![]()
m(NaОН) = ![]() .
.
Відповідь: потрібно взяти 10 г натрій гідроксиду
Задача 4. Для засолу огірків використовують 7% водний розчин кухонної солі (хлориду натрію NaCl). Саме такий розчин в достатній мірі подавляє життєдіяльність хвороботворних мікроорганізмів та пліснявого грибка, и в той же час не перешкоджає процесам молочнокислого бродіння.
Розрахуйте масу солі і води для виготовлення 1 кг такого розчину?
![]() Дано: Розв’язування:
Дано: Розв’язування:
mрозчину = 1 кг (1000 г)
СNaCl =7 % Використовуємо формулу:
![]() mNaCl=? С% =
mNaCl=? С% = ![]()
mводи=? 7% = ![]() , звідки
, звідки
mречовини = ![]()
mрозчинника = mрозчину - mречовини = 1000г – 70 г = 930г
Відповідь: потрібно взяти 930 г води та 70 г натрій хлориду.
Домашне завдання.
- Опрацювати матеріал підручника за темою заняття.
- Підготувати презентацію на тему “Розчини у нашому житті”


про публікацію авторської розробки
Додати розробку
