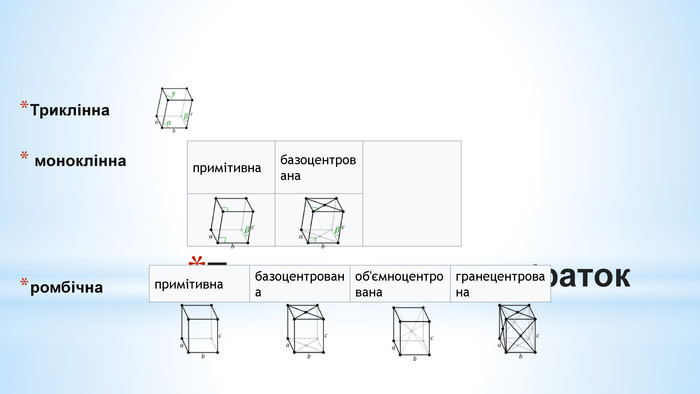
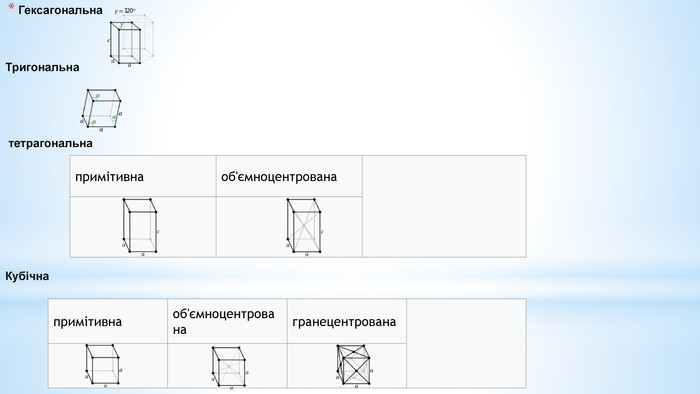
Лекція з теми : "Метали"
Про матеріал
Лекція з теми : "Метали" буде корисною при вивченні таких предметів як Конструкційні матеріали, електротехнічні та конструкційні матеріали, матеріалознавство Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку