Методичка розробка уроку: Методи перевірки титру точних розчинів і встановлення поправочних коефіцієнтів
Група ________ Дата ____________
План уроку з виробничого навчання
Професія: Лаборант хіміко-бактеріологічного аналізу, кваліфікація – 2 розряд
Тема програми 2. Приготування технічних та точних розчинів. Освоєння техніки титрування.
Тема уроку: «Освоєння методів перевірки титру точних розчинів і встановлення поправочних коефіцієнтів».
Мета уроку:
Навчальна – формувати знання, уміння та навички у здобувачів освіти при перевірці титру точних розчинів і встановлення поправочних коефіцієнтів, удосконалити техніку титрування та метод кислотно-основного титрування з використанням індикаторів , узагальнити знання про хімічні методи аналізу.
Виховна – виховувати вимогливість до себе під час роботи з хімічним обладнанням, вміння порівнювати і аналізувати, переводити інформацію в розрахункову частину; організувати себе на виконання поставленого завдання, здійснювати самоконтроль і самоаналіз навчальної діяльності; розвивати навички самостійного вирішення експериментальних хімічних задач почуття відповідальності за виконану роботу, точність, бережливе ставлення до матеріальних цінностей, обережність при роботі з хімічними речовинами.
Розвиваюча – розвивати логічне мислення, інтерес, мовлення, увагу, активність, самостійність пізнавальну діяльність; поглиблювати знання учнів про хімічні реактиви, їх властивості та правила користування ними; вміння застосовувати теоретичні знання на уроках виробничого навчання.
Тип уроку: формування знань, умінь та навичок.
Вид уроку: відпрацювання вправ.
Метод проведення: практичні роботи.
Матеріально-технічне забезпечення: хімічний стакан, конічна колба, піпетка, воронка, дистильована вода, фенолфталеїн, титрувальна установка, реактиви – НCl, NaОН.
Дидактичне забезпечення: інстукційно–технологічна картка, алгоритм
Міжпредметні зв`язки
- Матеріалознавста
- Спеціальна технологія
- Охорона праці
- Хімія
Література
- Е.И.Соловьева «Лабораторний контроль консервного, овощесушильного и пищеконцентратного производства», М., Пищевая промышленность.
- В.П. Крищенко «Практикум по технике лабораторних работ», М., Агропромиздат.
Хід уроку
І. Організаційна частина.
Вітання з учнями групи. Перевірка готовності учнів до роботи та дотримання ними санітарно-гігієнічних вимог при виконанні виробничих завдань (рапорт старости про присутність та готовність групи до занять).
ІІ. Вступний інструктаж
2.1. Повідомлення теми та мети уроку: «Освоєння методів перевірки титру точних розчинів і встановлення поправочних коефіцієнтів».
2.2. Мотивація навчальної діяльності учнів
При приготуванні точних розчинів із наважок реактивів не завжди вдається забезпечити точність відважування, а також залишити незмінною концентрацію розчинів при тривалому зберіганні (більше місяця). Титровані розчини необхідно правильно зберігати з добре притертою пробкою, щоб не попадало повітря і разом з цим волога та пил. Титр розчину може постійно змінюватися в результаті взаємодії їх зі склом. Тому точність концентрації таких розчинів перевіряють шляхом титрування розчинами концентрація, яких відома або розчинами приготовленими із фіксаналів.
Сьогодні ми навчимося: організовувати своє робоче місце з дотриманням безпечних прийомів роботи в лабораторії з реактивами, розчинами та лабораторним посудом.
Готувати до роботи титрувальну установку. Відмірювати об’єми приготовлених розчинів, додавати індикатор, проводити титрування до точки еквівалентності, знімати покази після титрування.
Виконувати розрахунки нормальності розчинів, поправочного коефіцієнту, внесення змін в надписи зазначених на етикетках.
2.3. Актуалізація опорних знань та підготовка учнів до засвоєння нового матеріалу.
2.3.1.Перевірка підготовки учнів до засвоєння нового матеріалу.
На уроках теоретичного навчання Ви отримали базові знання з теми «Поняття про титрування. Метод кислотно-основного титрування (нейтралізації). Індикатори. Автоматичне титрування».
Для перевірки Вашої готовності до уроку пропоную попрацювати з тестовими завданнями в кількості 12 питань, кожна правильна відповідь оцінюється в 0,5 бали час на виконання 5 хвилин;
Робота учнів з тестами, взаємоконтроль, контроль виконаної роботи шляхом обговорення.
|
|
Концентрація точних розчинів виражається… |
А) грами, міліграми; Б) молярність, нормальність, титр; В) літри, мілілітри; |
|
|
Нормальна концентрація це |
А)кількість грам або кг розчиненої речовини, яка міститься в 100г або кг розчину Б)кількість розчиненої речовини в грамах, яка знаходиться в 1мл(см3) розчину В) число молей розчиненої речовини в1 л (дм3) розчину |
|
|
Одиниці концентрації точних розчинів це… |
А)моль/ дм3; Б) г/см3; В)дм3; |
|
|
Нормальність або молярність позначення літерою … |
А) Т Б) Х В) N |
|
|
Титр це… |
А) кількість розчиненої речовини в грамах, яка знаходиться в 1мл(см3) розчину Б) об’єм розчиненої речовини, яка міститься у 1 мл розчину. В) маса розчиненої речовини, яка міститься в 1 кг розчину. |
|
|
Фіксанал або (стандарт-титри) це… |
А) маса точна зваженої кількості речовини; Б)ампула з точно відомою кількістю твердої речовини або розчину; В) індикатор; |
|
|
Призначення бюретки… |
А) вимірювання точних об’ємів рідин при титруванні; Б)вимірювання об’єму приблизних розчинів; В) для аналітичних робіт |
|
|
Відлік показів з мірного посуду проводять… |
А) на рівні очей по і відлік показів проводити нижньому меніску рідини Б) по нижньому меніску рідини В) на рівні очей і відлік показів проводити по верхньому меніску рідини |
|
|
Робочий (титрант) розчин це ...
|
А) розчин із точно відомою концентрацією, яким проводять титрування; Б) розчин, який титрують; В) розчин з недомою концентрацією, яким проводять титрування; |
|
|
Кінцева точка титрування це… |
А) момент титрування, в якому певна ознака розчину показує помітну (різку) зміну. Б) коли змінюється забарвлення титрованого розчину; В) точка кінця хімічної реакції. |
|
|
Індикатор який дає при титруванні рожеве забарвлення |
А) метиленовий синій Б) метилоранж В)фенолфталеїн |
|
|
Індикатори це… |
А) речовина, яка змінює швидкість хімічних реакцій Б)слабкі органічні кислоти або основи, які змінюють своє забарвлення залежно від рН розчину В) речовина, яка прискорює швидкість хімічних реакцій |
Час підійшов кінця зараз ви поміняєтесь тестовими завданнями і ми разом перевіримо правильність відповідей. Я зачитую питання викликаю учня і з’ясовуємо правильну відповідь.
Виставте оцінки за тестові завдання. Ця оцінка буде враховуватись по закінченню уроку.
2 завдання «Дайте назву складовим частинам титрувальної установки» час на виконання до 5 хвилин, кожна відповідь оцінюється по 0,5 бали.
|
|
Прізвище здобувача освіти |
|
|
|
|
|
|
|
|
|
2.4 Формування нових професійних знань, умінь та навичок.
- Організація робочого місця з дотриманням безпечних прийомів роботи в лабораторії з реактивами та розчинами.
- Підбір посуду, інвентарю, розчинів реактивів, індикаторів для перевірки титру точних розчинів.
- Підготовка титрувальної установки.
- Точне відмірювання об’ємів приготовлених розчинів, додавання індикаторів, титрування титрованими розчинами до точки еквівалентності, зняття показів після титрування.
- Виконання розрахунків нормальності розчинів, поправочних коефіцієнтів, написання їх на етикетках.
- Заповнення журналу використання реактивів.
- Прибирання робочого місця.
2.4.1. Демонстрація майстром прийомів роботи:
- Організація робочого місця з дотриманням безпечних прийомів роботи.
Для роботи нам необхідно - хімічний стакан, конічна колба, піпетка, дозатор, фенолфталеїн, титрувальна установка, реактиви – з розчинами НСL - 0,1N концентрації, NaОН – невідної концентрації.
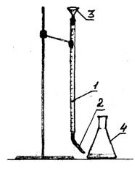
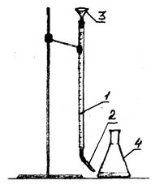
- Підготовка титрувальної установки.
А) Бюретку закріплюю вертикально над основою штативу. Шкалу бюретки обертаю до себе. Висоту бюретки відрегулюю так, щоб її капіляр був на 0,5 – 1,0 см нижче горла колби для титрування, яка стоїть на основі штативу.
Б) Заповнюю бюретку приготованим розчином приблизно до нульової поділки, обережно доливаючи в неї розчин із хімічного стакану через воронку.
В) Промиваю бюретку робочим розчином (хлоридної кислоти НСL- 0,1N концентрації). Для цього зливаю з неї розчин через капіляр у хімічний стакан. Промиту бюретку знову заповнюю розчином кислоти приблизно до нульової поділки і випускаю з капіляра бюретки бульбашки повітря. Для цього капіляр піднімаю вверх і зливаю розчин із бюретки в стакан до того часу, поки він не витисне з капіляра всі бульбашки повітря.
Г) Встановлюю рівень рідини в бюретці на нульовій поділці.
Прибравши з бюретки воронку (!!!), обережно, по краплях (!!!) зливаю розчин у стакан, поки нижній меніск рідини в бюретці не співпаде з поділкою «0».
- Точне вимірювання об’ємів приготованих розчинів та внесення в конічну колбу 10 мл NaОН за допомогою мірної піпетки та дозатора.
- Додавання індикатору фенолфталеїну до титруємого розчину.
До NaОН додаємо 2-3 краплі індикатору (фенолфталеїн), збовтуємого розчин, спостерігаємо зміну забарвлення розчину лугу на рожевий колір;
- Проведення титрування титрованим розчином. Із бюретки поступово додаємо розчин хлоридної кислоти (НСL) відомої концентрацій до тих пір, доки зникне рожеве забарвлення - це свідчення того, що число еквіваленту кислоти дорівнює числу еквіваленту лугу. Таким чином ми досягнемо кінцевої точки титрування або точки еквівалентності коли число еквівалентів титранту (робочого розчину - хлоридної кислоти – НСL - 0,1N концентрації) і титрованого розчину (NaОН) будуть рівні.
- Визначення об’єму витраченого розчину для титрування - знімаємо покази по бюретці по верхньому краю меніску з врахуванням кількості поділок.
- Виконання рахунків нормальності розчинів Знаючи об’єм витраченого титранту (який, знаходиться в бюретці, хлоридна кислота – НСL - 0,1N концентрації)), розраховуємо число еквіваленту лугу (знаходиться в конічній колбі в кількості – 10 мл) користуючись формулою, яка лежить в основі закону еквівалентності
![]() , де
, де
N – нормальність розчинів кислоти та лугу,
V - об'єми розчинів в момент нейтралізації.
звідки N лугу =![]()
Розрахунок: знаючи об’єм відібраного NaOH (10 мл), об’єм та концентрацію робочого розчину (НСL) (0,1Н) - проводимо розрахунок
із закону еквівалентів ![]()
звідки N лугу = ![]() =
= ![]()
- Встановлення поправочного коефіцієнту
Приготовлений самим ретельним чином точний розчин не буде відповідати заданій нормальності і для приведення точності необхідної нормальності, розраховують поправочний коефіцієнт, який позначається літерою (К)
для встановлення поправочного коефіцієнту користуються формулою:
![]()
Отриманий результат записують на етикетку К=?? та дату перевірки
По закінченню роботи робочий розчин злити з бюретки та промити її дистильованою водою.
2.5.2 Закріплення нового матеріалу учнями:
- Організація робочого місця з дотриманням безпечних прийомів роботи
- Точне вимірювання об’ємів приготованих розчинів та внесення в конічну колбу 10 мл
- Додавання індикатору фенолфталеїну до титруємого розчину.
- Проведення титрування титрованим розчином.
- Виконання рахунків нормальності розчинів
- Встановлення поправочного коефіцієнту
Упередження від виробничих помилок
Учні під виконання робіт іноді допускають типові помилки
|
Проблема |
Шляхи вирішення проблеми |
|
Дотримуватись правил роботи при титруванні |
|
Зняти воронку для подальшого правильного встановлення на «0» |
|
Видалити повітря перед початком роботи |
|
По закінченню роботи злити робочий розчин з бюретки та промити дистильованою водою. |
2.6. Майстер оцінює роботу здобувачів освіти на вступному інструктажі.
На вступному інструктажі приймали активну участь здобувачі освіти __________.
За цю роботу отримують оцінки ______.
На поточному інструктажі здобувачі освіти мають змогу підвищити свій рівень знань.
Комплексну оцінку за роботу на уроці ви отримаєте на заключному інструктажі.
Майстер розподіляє учнів по робочих місцях згідно теми уроку, видає завдання.
ІІІ. Поточний інструктаж
1. Контроль організації робочого місця, безпечних прийомів праці.
2. Самоконтроль якості роботи. Комплексний обхід, спостерігання за роботою учнів, їх поведінкою. Індивідуальний інструктаж учнів, надання допомоги учням при необхідності (виправлення помилок).
3. Приймання та оцінювання робіт.
ІV. Заключний інструктаж
1. Підведення підсумків уроку.
2. Аналіз типових помилок, ситуацій, порушень правил поведінки та безпечних прийомів праці.
3. Повідомлення якості виконаних робіт.
4. Заключний інструктаж проводиться майстром в формі бесіди.
V. Домашнє завдання
1. Оформити записи в щоденниках згідно виконаної роботи.
2. Повторити: «Освоєння методів відбору проб сировини та продуктів харчування»
Майстер виробничого навчання
Тема уроку: «Освоєння методів перевірки титру точних розчинів і встановлення поправочних коефіцієнтів».
|
|
Концентрація точних розчинів виражається… |
А) грами, міліграми; Б) молярність, нормальність, титр; В) літри, мілілітри; |
|
|
Нормальна концентрація це... |
А)кількість грам або кг розчиненої речовини, яка міститься в 100г або кг розчину Б)кількість розчиненої речовини в грамах, яка знаходиться в 1мл(см3) розчину В) число молей розчиненої речовини в1 л (дм3) розчину |
|
|
Одиниці концентрації точних розчинів це… |
А)моль/ дм3; Б) г/см3; В)дм3; |
|
|
Нормальність або молярність позначення літерою … |
А) Т Б) Х В) N |
|
|
Титр це… |
А) кількість розчиненої речовини в грамах, яка знаходиться в 1мл(см3) розчину Б) об’єм розчиненої речовини, яка міститься у 1 мл розчину. В) маса розчиненої речовини, яка міститься в 1 кг розчину. |
|
|
Фіксанал або (стандарт-титри) це… |
А) маса точна зваженої кількості речовини; Б)ампула з точно відомою кількістю твердої речовини або розчину; В) індикатор; |
|
|
Призначення бюретки… |
А) вимірювання точних об’ємів рідин при титруванні; Б)вимірювання об’єму приблизних розчинів; В) для аналітичних робіт |
|
|
Відлік показів з мірного посуду проводять… |
А) на рівні очей по і відлік показів проводити нижньому меніску рідини Б) по нижньому меніску рідини В) на рівні очей і відлік показів проводити по верхньому меніску рідини |
|
|
Робочий (титрант) розчин це ...
|
А) розчин із точно відомою концентрацією, яким проводять титрування; Б) розчин, який титрують; В) розчин з недомою концентрацією, яким проводять титрування; |
|
|
Кінцева точка титрування це… |
А) момент титрування, в якому певна ознака розчину показує помітну (різку) зміну. Б) коли змінюється забарвлення титрованого розчину; В) точка кінця хімічної реакції. |
|
|
Індикатор який дає при титруванні рожеве забарвлення |
А) метиленовий синій Б) метилоранж В)фенолфталеїн |
|
|
Індикатори це… |
А) речовина, яка змінює швидкість хімічних реакцій Б)слабкі органічні кислоти або основи, які змінюють своє забарвлення залежно від рН розчину В) речовина, яка прискорює швидкість хімічних реакцій |
|
|
Прізвище здобувача освіти
|
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
Прізвище здобувача освіти
|
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
Прізвище здобувача освіти
|
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
Прізвище здобувача освіти
|
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
5 |
Інструкційна картка
Тема програми. Приготування технічних та точних розчинів. Освоєння техніки титрування.
Тема: Перевірка титру точних розчинів і встановлення поправочних коефіцієнтів.
Посуд і матеріали: хімічний стакан, конічна колба, піпетка, промивалка, дозатор, воронка, дистильована вода, фенолфталеїн, пляшки для зберігання розчинів, титрувальна установка, реактиви – СН3СООН, Н2SO4, НNО3, NaОН, КОН.
Завдання: визначити нормальність та поправочний коефіцієнт приготовлених розчинів: СН3СООН, Н2SO4, НNО3, NaОН, КОН.
Теоретичні відомості:
Концентрацію всіх точних розчинів, які готували із певних наважок або об’ємів реактивів, а також розчини тривалого зберігання необхідно перевіряти шляхом титрування розчинами, приготовленими із фіксаналів в присутності індикатора до точки еквівалентності (випадання осаду або зміна забарвлення).
Розраховують поправочні коефіцієнти концентрації згідно закону еквівалентів
а) із закону еквівалентів ![]() звідси
звідси ![]()
б) встановити поправочний коефіцієнт ![]()
Перевірка титру точних розчинів титруванням і встановлення поправочних коефіцієнтів:
Порядок виконання роботи
РОЗЧИНІВ КИСЛОТ:
-
Підготувати титрувальну установку:
- Промити робочим 0,1н розчином NaОН бюретку два рази;
- Залити робочий 0,1н розчин NaОН через воронку, витіснити повітря із капіляра бюретки;
- Долити 0,1н розчин NaОН в бюретку, зняти воронку та встановити рівень розчину в бюретці на нульовій поділці по нижньому краю меніска.
- Відміряти 10 мл приготовленого 0,1н розчину СН3СООН (концентрацію якого перевіряють) в конічну колбу, додати 3-4 краплі 1% розчину фенолфталеїну та перемішати – в три конічні колби.
- Взяти в праву руку конічну колбу, а лівою рукою повільно додавати із бюретки робочий розчин, одночасно перемішуючи його в конічній колбі до точки еквівалентності (поява світло-рожевого забарвлення, яке не зникає на протязі 30 секунд).
- Зняти покази по бюретці.
- Провести три титрування та розрахувати середнє арифметичне значення об’єму 0,1н розчину NaОН, який витратили на титрування.
- Виконати розрахунки згідно формул.
Примітка:
Для встановлення нормальності лугу - в якості робочого розчину використовують 0,1Н розчин кислоти виготовлений з фіксаналів.
Для встановлення нормальності кислоти - в якості робочого розчину використовують 0,1Н розчин лугу виготовлений з фіксаналів.


про публікацію авторської розробки
Додати розробку