Методична розробка"Електроліз та його застосування"
Мета: незважаючина те, що явище електролізу знайоме вченим більше 200 років, воно й зараз привертає увагу фізиків і хіміків великими можливостями для застосування в технологіях одержання сучасних матеріалів, удосконалювання виробничих процесів. Тому метою даною роботи стало дослідженняможливостей використання електролізу для одержання чистого кадмію і подальшого застосування його в атомних реакторах (додаток Б).
Новизна: досі електроліз в школах вивчався досить коротко (оглядовий курс), а ця робота дає змогу поглибити свої знання в цьому дуже важливому процесі.
Теоретичне значення: поглибитизнання в електролітичних процесах, розібратися у впливі багатьох факторів на процес електролізу.
Практичне значення: визначити основні галузі застосування електролізу в виробничих масштабах.
1
Електроліз
та його застосування
ЗМІСТ
Вступ…………………………………………………………………….…. 3
Розділ 1. Загальні відомості………………………………………………. 4
- Історичні відомості……………………………………………………. 6
- Дисоціація……………………...………………………………………. 7
- Електроліз……………………………………...………………………. 11
- Застосування електролізу………………..……………………………. 12
- Закони Фарадея………………….………………………..…………… 15
- Висновки до розділу 1……………………………………..………….. 17
Розділ 2. Експериментальна частина…………………………..………… 19
2.1 Практичне застосування……………………………………………… 19
2.2 Розрахунок маси речовини…………………...………………………. 20
2.3 Результати та обговорення…………………...……………………….. 22
Висновки……………………………..…………………………………….. 23
Використана література……………………………..……………………. 24
Додатки…………………………………………………………………….. 25
ВСТУП
Мета: незважаючи на те, що явище електролізу знайоме вченим більше 200 років, воно й зараз привертає увагу фізиків і хіміків великими можливостями для застосування в технологіях одержання сучасних матеріалів, удосконалювання виробничих процесів. Тому метою даною роботи стало дослідження можливостей використання електролізу для одержання чистого кадмію і подальшого застосування його в атомних реакторах (додаток Б).
Новизна: досі електроліз в школах вивчався досить коротко (оглядовий курс), а ця робота дає змогу поглибити свої знання в цьому дуже важливому процесі.
Теоретичне значення: поглибити знання в електролітичних процесах, розібратися у впливі багатьох факторів на процес електролізу.
Практичне значення: визначити основні галузі застосування електролізу в виробничих масштабах.
Предмет дослідження: процес електролізу.
Об’єкт дослідження: добування чистого кадмію за допомогою єлектролізу.
Для розуміння електролітичних процесів, в першу чергу, необхідно ознайомитися з теоретичною частиною (історія відкриття, закон Фарадея). На наступному етапі буде розглянуто, яким чином вплив різних факторів відбивається на кінцевих продуктах електролізу. Так само розглянемо різні області застосування електролізу, зокрема, застосування електролізу в промисловості. У другому розділі буде досліджено електроліз під тчас досліду.
РОЗДІЛ 1. Загальні відомості
Електроліз ( від електро- і грецького lysis - розкладання, розчинення, розпад) - сукупність процесів окислювання-відновлення на занурених в електроліт електродах, при проходженні через нього електричного струму. Необхідно відмітити, що електроліз є одним з найважливіших напрямків в електрофізиці, у свій час послужив основою для важливих наукових відкриттів в області електрофізики.
Електролітичними називаються перетворення, що відбуваються при впливі на речовини електричного струму.
Процес електролізу неоднаковий у всіх випадках і залежить від ряду факторів - природи електроліту, типу електролітичної ванни, оптимізації самих електролізних процесів.
Розрізняють технічний і прикладний електроліз, а електролітичні процеси класифікують у такий спосіб:
1. Одержання металевих сплавів
2. Одержання гальванічних покриттів
3. Одержання неорганічних речовин (хлору, водню, кисню, лугів і т.д.)
4. Одержання органічних речовин
5. Очищення металів (мідь, срібло)
6. Одержання металів (магній, цинк, літій, натрій, калій, алюміній, мідь і т.д.)
7. Обробка поверхонь металів (электрополірування, азотування, очищення)
8. Нанесення плівок за допомогою электрофорезу
9. Електродиаліз і знесолення води
Доцільність й актуальність використання електролізу полягає в тому, що з його допомогою відносно легко можна одержати чисті метали, масова частка самого елемента в яких буте наближатися до 100 відсотків. А такі метали як натрій, нікель, чистий водень й інші, одержують тільки за допомогою цього методу. Також мідь й алюміній одержують по більшій частині методом електролізу. Електроліз застосовується для нанесення золота й срібла на ювелірні вироби. Метали, покриті плівкою методом електролізу, у такий спосіб захищають від корозії.
Дослідження електрофізичних процесів, визначення факторів, що впливають на них, установлення нових способів використання процесів електролізу в промислових умовах триває й на сьогоднішній день. Багато факторів ще не зрозумілі, а деталі вимагають доробки.
Першочергові завдання - удосконалити методи електролізу, щоб виробництво було найбільш вигідним, з найменшими витратами електроенергії та з найбільшим виходом продукції. При цьому необхідно враховувати різні фактори, що впливають на кількість і якість продуктів електролізу (матеріал електродів, щільність струму, сила струму, температура електроліту й ін.).
- Історичні відомості
Електрофізика, як наука, сформувалася на рубежі XVIII й XIX століть. Саме тоді були визначені проблеми, рішення яких вивело на новий рівень теорію електрофізики. Поштовхом для створення й розвитку цієї науки послужило створення в 1799 р. італійським фізиком А. Вольтом "вольтового стовпа" - першого в історії людства хімічного джерела струму - й досліди італійського вченого Л. Гальвані.
Електрофізика - досить молода наука. Тільки на початку позаминулого сторіччя було встановлено, що при проходженні електричного струму через водяні розчини солей, відбуваються хімічні перетворення, що приводить до утворення нових речовин.
І тільки на початку минулого століття виникла електрофізика - науковий напрямок по вивченню електрофізичних процесів у розчинах і розплавах речовин. Промислове застосування електролізу стало можливим після появи в сімдесятих роках XIX століття потужних генераторів постійного електричного струму.
На два самостійних розділи – іоніку, що вивчає явища електропровідності й руху заряджених часток під впливом електричного поля, і електродику, що вивчає явища, що відбуваються безпосередньо на поверхні електродів, коли через границю електрод-розчин (розплав) протікає електричний струм, електроліз стали розділяти наприкінці сімдесятих років.
1.2 Дисоціація
Дисоціація - це процес розщеплення нейтральних молекул на позитивні та негативні іони. Одночасно завжди існує зворотній процес рекомбінації окремих іонів у нейтральні молекули.
H2SO4=2H+ + SO42-
NaCl=Na+ + Cl-
При цьому у формуванні іонів важлива роль належить так званим валентним електронам.
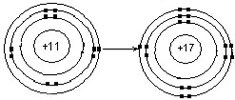
|
Na+ (іон натрія) |
Cl- (іон хлору) |
Зі схеми добре видно як проявляється природна тенденція нейтральних атомів автоматично створювати насичений зовнішній електронний шар в ході їхньої взаємодії у деякому середовищі.
В поведінці 11-го периферійного електрону натрію у присутності хлору переважає тенденція до переходу від „свого” атома до незавершеного зовнішнього шару „чужого” атома хлору. Такий процес дозволяє „вбити двох зайців” – забезпечити насичення зовнішнього електронного шару як і для атома натрію, так і для атома хлору. Адже атом хлору на своєму третьому електронному шарі , а атом натрію на залишеному другому будуть мати по вісім електронів. Зовнішні шари стали завершеними і утворена частинка (іон) стала стабільною.
Цей активний електрон і визначає валентність хімічного елементу.
Зрозуміло, що таких електронів у інших атомів може бути два чи більше, і такою буде відповідна їхньому числу валентність атома.
Тому коли така хімічна субстанція опиняється в електролітичній ванні з електродами, що під напругою, то спостерігається електричний струм з наступними супутніми явищами та характеристиками:
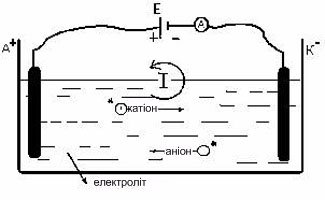
А+ - анод
К- - катод
*Потік іонів, що і являє електричний струм в електролітах.
Тобто – електроліти для розведених у просторі цієї рідини анода та катоду електричне коло не розмикають. Електроліт – це провідник електричного струму.
Зрозуміло, що при підвищенні температури опір електролітів зменшується на відміну від температурної залежності опору металевих провідників, бо підвищується рухомість носіїв електричних зарядів.
Іони для електролітичного струму іноді отримують не тільки з середовища самого електроліту, а інколи і з самих електродів (аноду). Тому, що серед іонів електроліту не всі вони є електро-хімічно активними, коли, наприклад, наявні негативні іони не здатні у даному середовищі віддати свої „надлишкові” електрони. А якщо не буде замкненого потоку електронів на відрізку зовнішнього з’єднання аноду та катоду з джерелом струму, то не буде і електролітичного струму в середині рідини.
На практиці під час електролізу наявного розчину біля електродів замість іонів, що там з’явилися, утворюються вже електрично-нейтральні молекули газу чи шар чистого металу, що складається з нейтральних атомів. Це прояв так званих реакцій відновлення. Основа їхньої сутності у поведінці вільних електронів, яку визначають іони та електричний заряд електрода.
Наприклад: Анод: Cl- → -e + Cl електрон, іоном що спочатку віддається негативним аноду (А+), а потім від аноду переміщується до позитивного полюсу батареї в ході циркуляції електричного струму у даному колі.
Потрібно прийняти до уваги, що в об’ємі розчину біля електродів, весь час повторюються подібні перетворення і тому відбувається неминуче об’єднання окремих атомів хлору у двоатомні молекули. Тобто спостерігач бачить потік пухирців газоподібного хлору, як кінцевий продукт електролізу. Причиною такого об’єднання атомів є ковалентний (парний) хімічний зв’язок. І знову в його основі закладена тенденція поведінки атомів до насичення зовнішнього електронного шару. В цілому реакція електролізу поблизу аноду матиме вигляд:
2Cl- → 2 -e + Cl2
От тільки водні розчини солей та кислот з причини широкої універсальності молекули води (H2O→ H++ OН-) містять не два протилежно заряджені іони, а більше (Na+, Cl-, H+, OH-). У такому випадку в електролізній реакції приймають участь лише два іона: один позитивний (найбільш активний) і один негативний (також найбільш активний). Інші іони участі у реакції не приймають. Їх називають пасивними.
Є спеціальний розділ фізики, який вивчає ці властивості рідини дуже детально. Такі пізнання широко використовуються у біотехнологіях. Останні поступово займають у житті сучасного суспільства лідируюче положення і є однією з цеглин нового суспільства ЗНАНЬ, що приходить на зміну ще актуального для України індустріального періоду. Дуже часто саме за рахунок реакцій електролізу отримують цінні хімічні продукти, що вкрай тяжко добути прямим природнім шляхом. Так у „доелекотролізні” часи алюміній був настільки дорогий, що прикраси з нього могли собі дозволити жінки лише з дуже багатих сімей. Тому для Дмитра Івановича Менделєєва було приємним отримати пам’ятну медаль Французької академії наук саме з алюмінію.
1.3 Електроліз
Електроліз – це явище проходження електричного струму у рідинах, при якому сама рідина не „переживає” ніяких перетворень своєї сутності. Всі реакції відбуваються виключно біля електродів, а у рідини змінюється лише концентрація компонентів.
Зрозуміло, що маса продуктів електролізу залежить від величини заряду, що пронизує розчин. На катоді катіони відновлюються в йони більш низького ступени окисления або в атоми, напр.: Fe3+ + e![]() Fe2+, Сu2+ + 2е
Fe2+, Сu2+ + 2е![]() Сu (е - електрон). Нейтральні молекули можуть брати участь у перетвореннях на катоді безпосередньо або реагувати із продуктами катодного процесу. На аноді відбувається окислення йонів або молекул, поступаючих з об'єму електроліта або приналежному матеріалу анода; в останньому випадку анод розчиняється або окисляється.
Сu (е - електрон). Нейтральні молекули можуть брати участь у перетвореннях на катоді безпосередньо або реагувати із продуктами катодного процесу. На аноді відбувається окислення йонів або молекул, поступаючих з об'єму електроліта або приналежному матеріалу анода; в останньому випадку анод розчиняється або окисляється.
Електроліз включає два процеси: міграцію реагуючих часток під дією електричного поля до поверхні електрода і перехід заряду із частки на електрод або з електрода на частку. Міграція йонів визначається їхньою рухливістю й числами переносу. Процес переносу декількох електричних зарядів здійснюється, як правило, у вигляді послідовності одноелектронних реакцій, тобто постадійно, з утворенням проміжних часток (іонів або радикалів), які іноді існують якийсь час на електроді в адсорбованому стані.
Швидкості електродних реакцій залежать від сполуки й концентрації електроліту, матеріалу електродів, електродного потенціалу, температури, гідродинамічних умов . Мірою швидкості служить щільність струму. Кількість продуктів, що утворяться при електролізі, визначається законами Фарадея. Для виділення 1 грам-еквівалента речовини на електроді необхідна кількість електрики, рівна 26,8 А* ч. Якщо на кожному з електродів одночасно утвориться кілька продуктів у результаті ряду електрохімічних реакцій, частка струму (в %), що йде на утворення продукту однієї з реакцій, називається виходом даного продукту по струму.
1.4. Застосування електролізу
Електрохімічні процеси широко застосовуються в різних галузях сучасної техніки, в аналітичній хімії, біохімії й т.д. У хімічній промисловості електролізом одержують хлор і фтор, луги, хлорати й перхлорати, надсірчану кислоту й персульфати, хімічно чисті водень і кисень і т.д. При цьому одні речовини одержують шляхом відновлення на катоді (альдегіди, параамінофенол й ін.), інші електроокислением на аноді (хлорати, перхлорати, перманганат калію й ін.).
Електроліз у гідрометалургії є однієї зі стадій переробки металовмісної сировини, що забезпечує одержання товарних металів.
Електроліз може здійснюватися з розчинними анодами - процес електрорафінування або з нерозчинними - процес електроекстракції.
Головним завданням при електрорафінуванні металів є забезпечення необхідної чистоти катодного металу при прийнятних енергетичних витратах.
У кольоровій металургії електроліз використається для добування металів з руд та їхнього очищення. Електролізом розплавлених середовищ одержують алюміній, магній, титан, цирконій, уран, бериллій й ін.
Для рафінування (очищення) металу електролізом з нього відливають пластини й поміщають їх як аноди в електролизері(додаток А). При проходженні струму метал, що підлягає очищенню, піддається анодному розчиненню, тобто переходить у розчин у вигляді катіонів. Потім ці катіони металу розряджаються на катоді, завдяки чому утвориться компактний осад уже чистого металу. Домішки, що перебувають в аноді, або залишаються нерозчинними, або переходять в електроліт і видаляються.
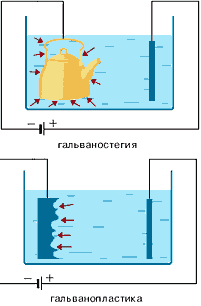
Гальванотехніка – галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металічних, так і неметалічних виробів при проходженні постійного електричного струму через розчини їхніх солей. Гальванотехніка підрозділяється на гальваностегію й гальванопластику.
Гальваностегія (від грец. покривати) – це електроосадження на поверхню металу іншого металу, що міцно зв'язується (зчіплюється) з металлом, який покривається і служить катодом електролізера(додаток А).
Перед покриттям виробу необхідно його поверхню ретельно очистити (знежирити), в іншому випадку метал буде осаджуватися нерівномірно, а крім того, зчеплення (зв'язок) металу покриття з поверхнею виробу буде неміцним. Способом гальваностегії можна покрити деталь тонким шаром золота або срібла, хрому або нікелю. За допомогою електролізу можна наносити найтонші металеві покриття на різних металевих поверхнях. При такому способі нанесення покриттів, деталь використають як катод, поміщений в розчин солі того металу, покриття з якого необхідно одержати. Як анод використовується пластинка з того ж металу.
Гальванопластика – одержання шляхом електролізу точних металевих копій різних як неметалевих, так і металевих предметів, що називаються матрицями.
За допомогою гальванопластики виготовляють погруддя, статуї й т.д.
![]() Гальванопластика використовується для нанесення порівняно товстих металевих покриттів на інші метали (наприклад, утворення "накладного" шару нікелю, срібла, золота й т.д.).
Гальванопластика використовується для нанесення порівняно товстих металевих покриттів на інші метали (наприклад, утворення "накладного" шару нікелю, срібла, золота й т.д.).
![]()
Крім зазначених вище, електроліз знайшов застосування й в інших галузях:
- одержання оксидних захисних плівок на металах (анодирування);
- електрохімічна обробка поверхні металевого виробу (полірування);
- електрохімічне фарбування металів (наприклад, міді, латуні, цинку, хрому й ін.);
- очищення води – видалення з неї розчинних домішок. У результаті виходить так називана м'яка вода (по своїх властивостях наближена до дистильованої);
- електрохімічне заточення різальних інструмент (наприклад, хірургічних ножів, бритов і та ін.).
1.5. Закони Фарадея
Майкл Фарадей
(1791—1867)
Англійський учений. Його дослідження і відкриття стосуються фізики (електрика, магнетизм, зрідження газів), проте вони залишили глибокий слід і в хімії. М. Фарадей виявив хімічну дію електричного струму, відкрив закони електролізу (1833—1834), пізніше названі його ім'ям, і тим самим започаткував електрохімію, розробив для неї термінологію, яка збереглася до нині (електроліт, неелектроліт).
Перший Закон Фарадея:
“Маса речовини, що виділилась на електроді при проходженні по розчину
електроліту електричного струму, прямо пропорційна кількості електрики”.
∆m=k э Q
де ∆m - кількість прореагувавшої речовини; Q - кількість електрики; kэ
- коефіцієнт пропорційності, що показує, скільки речовини прореагувало
при проходженні одиниці кількості електрики.
Величина, k називається електрохімічним еквівалентом
k=M/(N A z│e│)
де z - валентність йона; M - молярна маса речовини, що виділилась на
електроді; NA-постійна Авогадро, │e│= 1,6• 10 -19 Кл.
Другий Закон Фарадея.
Відповідно до другого закону Фарадея, при певній кількості пройшовшої електрики відношення мас прореагувавших речовин дорівнює відношенню їхніх хімічних еквівалентів:
∆m 1 /A 1 =∆m 2 /A 2 =∆m 3 /A 3 =const
Хімічний еквівалент елемента, дорівнює відношенню частини маси елемента, що приєднує або заміщає в хімічних сполуках одну атомну масу водню або половину атомної маси кисню, до 1/12 маси атома С12. Поняття “хімічний еквівалент” може застосовуватися й до сполук. Так, хімічний еквівалент кислоти чисельно дорівнює її молярній масі, діленої на основність (число йонів водню), хімічний еквівалент основності - його молярній масі, діленій на кислотність (у неорганічної основності - на число гідроксильних груп), хімічний еквівалент солі - її молярній масі, діленії на суму зарядів катіонів або аніонів.
1.6. Висновки до розділу 1
Висновки зроблені на підставі проробленої роботи, полягають у наступному. По-перше, дослідження в області процесів електролізу дотепер не втратили своєї актуальності, і, більше того, завдяки їм постійно поповнюється теоретична база цього досить складного фізико-хімічного явища.
По-друге, ці дослідження дозволяють визначити перспективні напрямки практичного використання цього процесу.
Електроліз широко використовують у промисловості.
Важливою властивістю електролізу є здатність виділення й очищення металів, одержання лугів, хлору, водню.
Відмінною рисою електролізу розчинів або розплавів електролітів є можливість протікання на електродах сукупності конкуруючих хімічних реакцій окислювання й відновлення. Впливає на продукти електролізу й матеріал електродів.
Очищення міді, нікелю, свинцю проводять цілком електрохімічним методом. Виробництво фтору засноване на електролізі розплавленої суміші фториду калію й фтороводневої кислоти, хлору - на електролізі водяних розчинів.
Алюміній, магній, натрій, кадмій, кальцій, берилій, титан одержують тільки електролізом розплавів, тому що потенціал їхнього виділення з водяних розчинів більше негативний, ніж потенціал виділення водню. Водень і кисень високого ступеня чистоти одержують електролізом водяних розчинів лугів. Таким чином, за допомогою електролізу вдається здійснювати реакції окислювання й відновлення з більшим виходом і високою селективністю, які у звичайних хімічних процесах важко досяжні. Важливою галуззю застосування електролізу є захист металів від корозії: при цьому електрохімічним методом на поверхню металевих виробів наноситься тонкий шар іншого металу (хрому, срібла, міді, нікелю, золота) стійкого до корозії. При електролізі водяних розчинів електролітів окислювально-відновні процеси на катоді й аноді залежать від окисної здатності катіонів і характеру аніона електроліту. Процеси відновлення й окислювання на катоді й аноді визначаються значеннями електродних потенціалів часток, що приймають участь в електролітичних процесах. На катоді в першу чергу розряджаються ті частки, потенціал яких найбільш позитивний, тоді як на аноді - частки - потенціал яких найбільш електронегативний. Крім того, при протіканні електролізу необхідно враховувати фактор електродної перенапруги - поляризацію електрода, обумовлену вповільненим протіканням певної стадії сумарного електродного процесу. Залежно від природи вповільненої стадії можна говорити про різні види перенапруги (концентраційна, реакційна, дифузійна).
РОЗДІЛ 2. ПРАКТИЧНА ЧАСТИНА
2.1 Практичне застосування
Завдяки своїм фізичним властивостям, кадмій знайшов широке застосування в техніці та промисловості (особливо, починаючи з 50-х років XX століття).
Основні сфери застосування його використання: для антикорозійного покриття (так званого кадміювання) чорних металів, особливо в тих випадках, коли вони контактують з морською водою, а також для виробництва нікеле-кадмієвих електричних акамуляторів і батарей. Кадмій входить в склад багатьох сплавів, як лекгоплавких (наприклад, сплав Вуда (Wood's metal) - 50% Bi, 25% Pb, 12.5% Sn, 12.5% Cd), так і тугоплавких зносостійких (наприклад, з нікелем). Кадмій використовується в стержнях-сповільнювачах атомних реакторів (додаток Б), деякі сполуки кадмію мають напівпровідникові властивості тощо. Досить довго кадмій використовувався для виробництва барвників (пігментів) і в якості стабілізатора у виробництві сластмас (наприклад, поліхлорвінілу), однак нині, через токсичність, в цих цілях він практично не використовується.
2.2 Розрахунок маси речовини
Розглянемо умови добування чистого Cd:
- Електролізери (додаток А).
- В наших умовах – лабораторні кулонометри.
Для проведення експерименту було взято устаткування:
- терези механічні;
- різноважки;
- штатив;
- амперметр шкільний;
- годинник;
- джерело струму, u = 6В
- реостат лабораторний 6Ом, 2А
- вмикач;
- електроплитка;
- розчини CdSO4 i Cd(NO3)2
- органічні добавки для покращення поляризації і структури осаду.
CdSo4 + H2O + 2e- = Cd + H2SO4 + 5O
H2O ± 2e- = H2 + O
Склад електроліту:
50 г/л CdSo4, 5 крапель H2SO4
густина струму j = 30 – 200 А/м2
Тоді:
CdS04 -> Cd2+ + SO42-
H2SO4 -> 2H+ + SO4-
HOH -> H+ + OH-
На катоді К- На аноді А+
Cd2+ + 2e- -> Cd0 2SO42- -> SO82-
2H+ + 2e- -> H2 4HOH + 4e- -> O2 + 4H+ + 2H2O
Аналогічно відбувається електроліз розчину солей Cd(NO3)2.
У таблиці порівнюється маса виділення Cd при електролізі солей CdSO4 i Cd(NO3)2.
|
Сіль |
Cd(NO3)2 |
CdSО4 |
||
|
Склад електроліту |
Cd(NO3)2*4H2O 40г солі 60г води |
50 г/л CdSo4, 5 крапель H2SO4 |
||
|
Наявність органічних добавок для покращення якості покриття |
+ |
- |
+ |
- |
|
Умови експеременту |
J = 0,2 A/см2 S = 8,325см2 Mдо = 20,8г T = 40хв |
J = 0,2 A/см2 S = 8,325см2 Mдо = 20,8г T = 40хв |
J = 0,2 A/см2 S = 8,325см2 Mдо = 20,8г T = 40хв |
J = 0,2 A/см2 S = 8,325см2 Mдо = 20,8г T = 40хв |
|
Маса після реакції |
21,12г |
21,02г |
21,15г |
21,135г |
|
Вихід по струму |
0,320г |
0,302г |
0,350г |
0,335г |
2.3 Результати та обговорення
Під час експерименту ми виявили, що в лабораторних умовах більш привабливим є одержання Cd з солей CdSО4. Тому для відтворення цього процесу в технічних масштабах можна рекомендувати спосіб добування
Cd з солі CdSО4.
Оскільки в результаті будь-яких лабораторних досліджень виникають недоліки при обчисленні результатів як внаслідок існування інструментальних похибок приладів, так і в результаті недоліків вимірювання, доцільно обчислювання похибок одержаних результатів.
Для знаходження похибки при обчисленні маси кадмію скористаємось формулою:
M = kIt.
Тоді відносна похибка ∆m складатиметься з суми
E = ∆I/I + ∆t/t
Де ∆I і ∆t – абсолютні похибки приладів А-метра і секундоміра.
∆I дорівнює (∆І інструментальне + ∆І виміру) в обох випадках ∆І = 0,05 (половині ціни поділки). Ціна поділки амперметра – 0,1А. Отже, ∆І = 0,1А;
∆t дорівнює ціні поділки секундоміра ∆t = 1с.
Отже, відносна похибка Е = ( 0,1/1,665 + 1/2400) * 100% ≈ 6,04%
Тоді абсолютна похибка вимірювання маси складатиме
∆m = mдослідне*E
∆m = 21,135*0,0604 = 1,276 г
Отже, маса виділеної речовини m = 21,135± 1,276 г з точністю до 6,04%.
ВИСНОВКИ
Аналіз наукової та науково-популярної літератури свідчить про те, що процеси електролізу розчинів і розплавів цікавлять вчених і технологів в даний час, тобто дана тема не втратила своєї актуальності і практичної значущості.
Електроліз на даний момент широко використовується в промисловості для виділення і очищення металів, полірування, заточення металевих виробів, очищення води, захисту від корозії та ін. Деякі метали (алюміній, магній, натрій, кадмій, кальцій) одержують тільки електролізом розплавів.
Висновки
В експериментальній частині роботи було проведено електроліз розчинів солей CdSO4 i Cd(NO3)2. В результаті експеременту ми з’ясували, що більш раціональним є добування чистого кадмію з солі CdSО4. Отже, в технічних масштабах більш доцільним є спосіб добування кадмію з даної солі.
ВИКОРИСТАНА ЛІТЕРАТУРА
1. Глинка Н.Л. Загальна хімія. - Л.: Хімія, 1978. – 370с.
2. Н.В.Коровіна. Курс загальної хімії. - К.: НаУКМА, 1991.- 380с.
4. Т.Браун, Г.Ю.Лемей. Химия в центре наук – 2. – М.: НаУКМА, 1997. 480с.
5. И.П. Мухленов, А.Я. Авербух и др. Важнейшие химические производства. – М.: Высшая школа, 1990г. – 317с.
6. Н.В.Коровина. Курс общей химии. – М.: Высшая школа , 1991. 415с.
7. Н.Л. Глинка/ Общая химия. г. Москва, 1985г. 250-253; 257-261с.
8. Т.Браун, Г.Ю.Лемей / Химия в центре наук --2, Мир, 1997. г.Москва. 432-440с.
9. И.П. Мухленов, А.Я. Авербух и др./ Важнейшие химические производства.,“Высшая школа”, г. Москва. 1990г. 217-225с.
10. К.А.Третьяков / Методические указания к лабораторным работам по химии.
11. Електронна бібліотека http://uk.wikipedia.org/
Додаток A
Електролізер
Електролізер Катодна камера
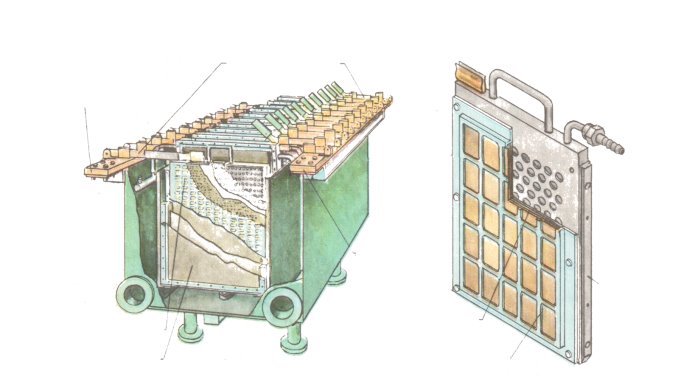
Струмопровідні ніжки
Катодна шина
Анодна шина
Корпус
Катодна камера Вуглеграфітовий матеріал
Анодна камера Прижимна сітка
Додаток Б
Ядерний реактор
Реактором називається установка, в якій здійснюється керована ланцюгова реакція ділення ядер. Існує багато різновидів реакторів, які відрізняються за робочими енергіями нейтронів, за матеріалом сповільнювача, за призначенням. Але незалежно від призначення і конструкції основними елементами кожного ядерного реактора є: ядерне пальне; пристрій для регулювання ходу ланцюгової реакції; запобіжні пристосування — пристрої, які забезпечують захист персоналу від випромінювань; теплоносій, який відводить надмір кількості теплоти; пристосування для заміни пального. Крім того, переважна більшість реакторів має так званий відбивач, який зменшує втрати нейтронів через поверхню активної зони. В реакторах на повільних нейтронах важливим елементом є сповільнювач.
Головною частиною реактора є активна вода, в якій відбувається ланцюгова реакція і виділяється енергія. В ативній зоні розміщені уранові стержні (1) і сповільнювач нейтронів (2). В якості сповільнювача використовують графіт, важку воду, а у випадку збагаченого урану — звичайну воду. Ядерне пальне і сповільнювач вміщають у металевий бак (3) і оточують відбивачем нейтронів (4), який повертає нейтрони, що вилітають з активної зони, назад. Для відбивача застосовують ті ж самі матеріали, що й для сповільнювача.
Відведення енергії з активної зони реактора здійснюється теплоносієм, який рухається трубками (5). В енергетичних реакторах теплоносій повинен не лише інтенсивно відводити енергію з активної зони, а й з мінімальними втратами передавати її в установку, яка виробляє електроенергію. В міру проходження через реактор теплоносій нагрівається, передає набуту кількість теплоти через теплообмінний пристрій робочому тілу і знову надходить в реактор. В якості теплоносія в реакторах на теплових нейтронах використовують воду, водяну пару, повітря, азот, вуглекислий газ тощо.
Керування перебігом ланцюгової реакції здійснюється регулюючими стержнями (6) з матеріалів, які сильно поглинають нейтрони. Ці стержні можна повністю або частково вводити в активну зону, параметри якої розраховані так, щоб при повністю введених тержнях реакція завідомо не йшла. При поступовому виведенні стержня коефіцієнт розмноження нейтронів k в активній зоні зростає і при певному положенні стержнів доходить до одиниці. В цей момент реактор починає працювати. В процесі роботи коефіцієнт k змінюється переважно в бік зменшення за рахунок забруднення активної зони осколками ділення. Ці зміни коефіцієнта розмноження компенсуються виведенням і, якщо потрібно, введенням стержнів. На випадок раптового збільшення інтенсивності реакції в реакторі є додаткові аварійні стержні, введення яких в активну зону негайно припиняє реакцію. Регулюючі стержні роблять із кадмію або бору, які ефективно поглинають повільні нейтрони. Керування стержнями автоматизоване.
З активної зони реактора виходить потужний потік нейтронів і гамма-променів. Оскільки гамма-промені і нейтрони досить сильно впливають на організм, необхідне влаштування потужного захисту (7) від цих випромінювань. До його складу входять матеріали, що добре поглинають гамма-промені (залізо і свинець), сповільнювачі і поглиначі нейтронів (вода, бор, бетон тощо).
Ланцюгова реакція, яка б сама себе підтримувала, можлива в реакторі з певними розмірами активної зони і завантаженою в неї масою ядерного палива. Частина нейтронів під час поділу ядер вилітає з активної зони. При малих розмірах активної зони реактора більша частина нейтронів покидатиме активну зону, не викликавши ділення ядер, і в такій системі не можна здійснити ланцюгову реакцію. Поділ ядер відбувається у всьому об'ємі урану, а втрата нейтронів йде лише з поверхневого шару, тому зі збільшенням розмірів активної зони кількість народжуваних нейтронів зростає швидше, ніж вилітаючих з поверхні. При певних розмірах активної зони кількість втрачених внаслідок вилітання і захоплення нейтронів зрівноважується числом нейтронів, які виникають у процесі ділення. Інакше кажучи, коефіцієнт розмноження нейтронів k = 1 і ланцюгова реакція в такій системі можлива.
Мінімальні розміри активної зони, для яких можлива ланцюгова реакція, називаються критичними розмірами, а мінімальна маса розщеплюваних речовин, які знаходяться в системі критичних розмірів, називається критичною масою. Зрозуміло, що критичні розміри і критична маса залежать не тільки від властивостей розщеплюваної речовини, а також, до того ж дуже сильно, від форми, яку має розщеплювана речовина, або, відповідно, від форми активної зони реактора. Критичні розміри і маса найменші для сферичної активної зони. Для шматка чистого урану-235 сферичної форми критична маса становить від 30 до 50 кг. Значення критичної маси можна дещо зменшити, оточивши активну зону добрим відбивачем нейтронів.
Дуже цікавим є питання про принципову можливість керування ходом ядерної реакції. Неважко здогадатися, що коли б у процесі ділення ядер випускалися лише миттєві нейтрони, то регулювання реакції було б неможливим і вона здійснювалася б лише у формі вибуху. Справді, від моменту виникнення нейтрона при діленні ядра до зменшення його швидкості і участі в новому акті ділення проходить близько 10-3с (час життя покоління нейтронів). За цей час опустити на потрібну глибину регулюючий стержень практично неможливо. Між тим, як би мало не перевищував коефіцієнт розмноження k одиницю, швидкість зростання потужності реактора була б дуже великою. Так, для k = 1,005 і часі життя покоління нейтронів 10-3с потужність реактора за секунду зросла б у 150 раз, і його регулювання виявилося б практично неможливим.
Проте, крім миттєвих нейтронів, осколками ядра випускаються з запізненням на 0,2 - 57,6 с після поділу ядра інші нейтрони. Враховуючи наявність нейтронів, які спізнюються, підбирають умови роботи реактора так, щоб коефіцієнт розмноження нейтронів, будучи трохи меншим за одиницю, за рахунок миттєвих нейтронів дещо перевищував одиницю (1,006) за рахунок нейтронів, які спізнюються. В цьому випадку час життя одного покоління нейтронів стає рівним 0,1 с, що цілком достатньо для автоматичного регулювання положення стержнів.
За своїм призначенням реактори діляться на енергетичні, експериментальні, дослідницькі, а також реактори для вироблення нових розщеплюваних елементів і радіоактивних ізотопів.

про публікацію авторської розробки
Додати розробку
