Міні-підручник з хімії для учнів 9 класу "Хімічні реакції"
ХІМІЯ





Відділ освіти Оржицької райдержадміністрації
Методичний кабінет Оржицької РДА

![]()
МІНІ-ПІДРУЧНИК
З ТЕМИ

Вакуленко Світлана Анатоліївна
учитель хімії Лазірківської ЗОШ І-ІІІ ступенів
імені В.О.Підпалого
Автор: Вакуленко С.А., учитель хімії Лазірківської ЗОШ І-ІІІ ступенів імені В.О.Підпалого
Розглянуто на засіданні методичної ради районного методичного кабінету Оржицької РДА
ЗМІСТ
ПЕРЕДМОВА……………………………………………………………………..5
УМОВНІ ПРЗНАЧКИ…………………………………………………………….7
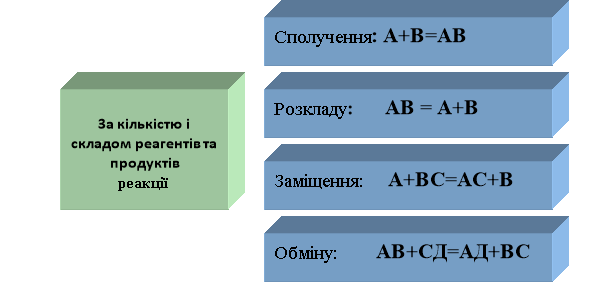
Урок 1. Класифікація хімічних реакцій за кількістю і складом реагентів та
продуктів реакцій: реакції сполучення, розкладу, заміщення,
обміну…………………………………………………………………….8
Урок 2. Окисно-відновні реакції. Процеси окиснення, відновлення, окисники,
відновники……………………………………………………………….13
Урок 3. Складання рівнянь окисно-відновних реакцій………………………..17
Урок 4. Значення окисно-відновних процесів у житті людини, природі й
Техніці…………………………………………………………………...21
Урок 5. Екзотермічні та ендотермічні реакції. Термохімічне
рівняння………........................................................................................26
Урок 6. Екзотермічні та ендотермічні реакції. Розв’язування розрахункових
задач за термохімічними рівняннями…………………………………32
Урок 7. Швидкість хімічної реакції, залежність швидкості реакції від різних
Чинників………………………………………………………………...36
Урок 8. Оборотні й необоротні реакції………………………………………...40
Урок 9. Швидкість хімічних реакцій. Оборотні і необоротні реакції.
Виконання вправ та розв’язування задач……………………………45
Урок 10. Захист навчальних проектів з теми «Екзотермічні та ендотермічні
реакції………………………………………………………………….50
Урок 11. Узагальнення знань з теми «Хімічні реакції»………………………50
Шановний дев’ятикласнику!
Перед тобою новий міні - підручник, який стане надійним помічником у вивченні теми «Хімічні реакції». Його зміст зосереджуватиме твою увагу на найголовнішому в кожній темі уроку, формуватиме уміння і навички виконувати вправи і розв’язувати задачі, самостійно долати шлях до вершини знань.
 Алгоритми та узагальнюючі схеми допоможуть краще збагнути і запам’ятати складні поняття, збагачуватимуть твою уяву, мислення, пожвавлять навчальний процес.
Алгоритми та узагальнюючі схеми допоможуть краще збагнути і запам’ятати складні поняття, збагачуватимуть твою уяву, мислення, пожвавлять навчальний процес.
А творчі завдання, розрахункові задачі, тести розвиватимуть кмітливість, робитимуть розум гнучкішим, що так необхідно для майбутнього дорослого життя. З даним підручником ти будеш працювати як у школі, так і вдома. На уроках він допоможе тобі опановувати тему і самостійно, і разом з товаришами, і при допомозі учителя.
Бажаю, щоб навчання було для тебе приємною і навіть захоплюючою справою.


 Ти будеш знати як класифікуються реакції за різними ознаками; що таке реакції сполучення, заміщення, обміну, розкладу; окисно-відновні та реакції без зміни ступеня окиснення; екзо- та ендотермічні; оборотні й необоротні реакції; що таке швидкість хімічної реакції та від яких чинників вона залежить
Ти будеш знати як класифікуються реакції за різними ознаками; що таке реакції сполучення, заміщення, обміну, розкладу; окисно-відновні та реакції без зміни ступеня окиснення; екзо- та ендотермічні; оборотні й необоротні реакції; що таке швидкість хімічної реакції та від яких чинників вона залежить
Навчишся
- наводити приклади основних типів хімічних реакцій; відновників і окисників;
- класифікувати реакції за різними ознаками;
- розрізняти реакції сполучення, заміщення, обміну, розкладу; окисно-відновні та реакції без зміни ступеня окиснення; екзо- та ендотермічні, оборотні й необоротні реакції; окисники і відновники;
- характеризувати процеси окиснення, відновлення, сполучення, розкладу, заміщення, обміну; роль окисно-відновних процесів у довкіллі; вплив різних чинників на швидкість хімічних реакцій; способи зміщення хімічної рівноваги.
- складати рівняння окисно-відновних реакцій на основі електронного балансу, термохімічні рівняння; рівняння оборотних і необоротних реакцій;
- розв’язувати задачі за термохімічними рівняннями , з використанням поняття «швидкість хімічної реакції»
Цінуватимеш :
- Свій час;
- Своє бажання бути творчою особистістю;
- Уміння здобувати знання самостійно
- Уміння вести дискусію та працювати в команді з товаришами
- Уміння об’єктивно оцінювати свої сили
Вперед до знань!
![]()

ВИКОНАЙ ЗАВДАННЯ

ЗАПАМЯТАЙ !

ДОМАШНЄ ЗАВДАННЯ

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ

ЗВЕРНИ УВАГУ!
 ПРИГАДАЙ!
ПРИГАДАЙ!

ЦЕ НЕ СКЛАДНО!

ВИКОНАЙ ПИСЬМОВО
УРОК 1: КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ ЗА РІЗНИМИ ОЗНАКАМИ.
Твої завдання:
Познайомитися із класифікацією хімічних реакцій за різними критеріями
Пригадати, як класифікуються реакції за кількістю і складом реагентів
та продуктів реакції;
Закріпити уміння писати рівняння хімічних реакцій та визначати їх тип;
 ПРИГАДАЙ!
ПРИГАДАЙ!
- Що таке хімічна реакція?
- Що відбувається з молекулами та атомами під
час хімічних реакцій;
- Які ознаки хімічної реакції?
- З якими типами хімічних реакцій ви зустрічалися, вивчаючи хімічні властивості оксидів, кислот, основ, солей?

ЗАПАМ’ЯТАЙ!

![]()






![]()



![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Сполучення Екзотермічні Оборотні Каталітичні окисно-
Сполучення Екзотермічні Оборотні Каталітичні окисно-
відновні
![]()
![]()
![]()
![]() Розкладу Ендотермічні Необоротні Некаталітичні
Розкладу Ендотермічні Необоротні Некаталітичні
![]() Без зміни
Без зміни
![]() Заміщення ступенів
Заміщення ступенів
окиснення
![]() Обміну
Обміну

ВИКОНАЙ ЗАВДАННЯ:
Допиши рівняння реакцій. Зазнач, до якого типу належить кожна з них:
А) СаСО3 →
Б) Zn + O 2 →
В) Zn + CuSO4 →
Г) KOH + FeSO4 →
Д) CaO + SiO2 →


ВИКОНАЙ ЗАВДАННЯ
 ПРОДОВЖ РЕЧЕННЯ:
ПРОДОВЖ РЕЧЕННЯ:
- Реакція, при якій із двох чи більше простих чи складних речовин утворюєтиься одна складна, називається …
- Реакція, при якій із однієї складної речовини утворюється дві чи більше нових речовин, називається …
- Реакція між простою та складною речовиною, при якій атоми простої речовини заміщують один з видів атомів у складній речовині, називається …
- Реакція, при якій дві складні речовини обмінюються своїми складовими частинами, це реакція …
- Хімічні реакції поділяють на оборотні та необоротні за …
- Хімічні реакції поділяють на окисно-відновні та реакції без зміни ступеня окиснення за …
- Хімічні реакції поділяють на екзотермічні та ендотермічні за …
- Хімічні реакції поділяють на каталітичні та некаталітичні за …

РОБОТА В ГРУПАХ (групи гетерогенного складу)
Завдання
Відгадати, про який тип реакції йде мова та написати 4 приклади рівнянь реакцій даного типу, в яких беруть участь як прості так і складні речовини)
Група № 1.
Я – одна з найлегших типів,
І проблем зовсім нема.
Речовин бери хоч три,
А в продуктах – лиш одна.
Група № 2.
Найщедріший тип – це я.
Результат тут фантастичний:
До реакції – одна ,
Після неї – вдвічі більше.
Група № 3.
А про вас ну що тут скажеш?
Були друзі хоч куди.
Та сильніший вижив з місця,
І тепер ось зайвий ти.
Група № 4.
Ми не знаємо обману,
Не втрачаєм доброти.
Обміняємося вмістом,
І не сваримося ми.
САМОСТІЙНА РОБОТА!

 Обери посильнее завдання самостійно на основі самооцінки і виконай його. Якщо щось не виходить, звернися за допомогою до товариша чи учителя.
Обери посильнее завдання самостійно на основі самооцінки і виконай його. Якщо щось не виходить, звернися за допомогою до товариша чи учителя.
Варіант А (Вищий рівень)
Скласти генетичний ряд добування натрій тетрагідроксоалюмінату із приведених речовин, зобразити рівняння реакцій, визначити їх тип: алюміній, алюміній гідроксид, алюміній хлорид, алюміній оксид.
Варіант В (Достатній рівень)
Із поданих речовин складіть генетичний ряд неметалу сірки, запишіть рівняння реакцій, визначте їх тип: сульфітна кислота; сірка; купрум(ІІ) сульфіт; сульфур(ІV) оксид.
Варіант С (Середній рівень)
Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення. Визначте тип кожної реакції: Mg → MgO → MgCl2 →Mg(OH)2

ПОПРАЦЮЙ ТВОРЧО в парі із товаришем!
- До складу антацидних (проти печії) лікарських препаратів «Маалокс» і «Алмагель» входять магній гідроксид і алюміній гідроксид. Складіть рівняння реакцій цих сполук із хлоридною кислотою – головною складовою шлункового соку. Класифікуйте реакції за кількістю та складом реагентів і продуктів. Запишіть їхні рівняння у повній і скороченій йонній формах. Визначте, які йони у складі шлункового соку є причиною печії.
- Пригадайте формули речовин, про які йдеться мова. Складіть генетичний ряд цих сполук. Напишіть рівняння реакцій згідно складеного генетичного ряду речовин та визначте тип кожної реакції.
« Пожежа палала кілька годин підряд. Печера перетворилась на справжню піч для випалювання вапняку. Нечуваної сили полум’я обпалило весь вапняковий шар, що являє собою кальцій карбонат. Під дією вогню вапняк розклався і утворилось саме те, що зветься негашеним вапном. Залишилося лише, щоб на нього потрапила певна кількість води. Так і сталося. Злива, що сталася після грози, залила всю цю величезну масу негашеного вапна. Воно розбухло, почало з невпинною силою розпирати вугілля, що стискувало її, і виштовхувало в напрямку прірви.
3. Встановіть повні електронні формули атомів хімічних елементів, що мають закінчення …3S2 і …2S22P5 . Напишіть рівняння реакції між простими речовинами цих елементів, визначте тип реакції за кількістю та складом реагентів і продуктів.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
ТЕСТОВІ ЗАВДАННЯ
-
 Реакції, урезультаті яких з однієї складної речовини утворюється декілька продуктів, називаються реакціями …
Реакції, урезультаті яких з однієї складної речовини утворюється декілька продуктів, називаються реакціями …
А) заміщення;
Б) розкдаду;
В) обміну;
Г) сполучення.
- До реакцій сполучення відноситься реакція:
А) горіння фосфору;
Б) взаємодія натрію з водою;
В) взаємодія магній оксиду з хлоридною кислотою;
Г) добування кисню із калій перманганату.
3. Вкажіть тип реакції, , схема якої: А + ВС = АС + В:
А) обміну;
Б) розкладу;
В) сполучення;
Г) заміщення.
4. Реакція CuO + 2HNO3 = Cu(NO3)2 +H2O відноситься до реакцій:
А) сполучення;
Б) заміщення;
В) обміну;
Г) розкладу.
5. Вкажіть суму всіх коефіцієнтів у реакції розкладу алюміній гідроксиду:
А) 2; Б) 4; В) 6; Г) 8.
6. Вкажіть схему реакції обміну:
А) MgO + CO2 →
Б) NaOH + CuCl2 →
В) Al + TiCl4 →
Г) Fe(OH)3 →
7. У реакціях заміщення продуктами є:
А) дві прості речовини;
Б) дві складні речовини;
В) одна проста і одна складна речовина;
Г) декілька складних і одна проста речовина.
8. Вкажіть серед поданих прикладів реакцію розкладу:
А) нагрівання вапняку до 10000;
Б) пропускання вуглекислого газу крізь воду;
В) нейтралізація хлоридної кислоти розчином лугу;
Г) взаємодія калію з водою.
9. Вкажіть суму всіх коефіцієнтів та тип реакції між цинк оксидом та ортофосфатною кислотою:
А) 9 1) сполучення
Б) 7 2) заміщення
В) 5 3) обміну;
Г) 4 4) розкладу.
10. Установіть відповідність між хімічною реакцією та її типом:
А) розкладу 1) CuO + H2 = Cu + H2O;
Б) заміщення 2) N2O5 + H2O = 2HNO3;
В) обміну 3) 2HgO → 2Hg + O2;
Г) сполучення 4) H2SO4 + 2KOH = K2SO4 + 2 H2O.

ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф підручника.
Виконай завдання: скласти молекулярні рівняння реакцій, за допомогою яких можна здійснити перетворення за схемою:
Мідь → купрум(ІІ) оксид → купрум(ІІ) сульфат → купрум(ІІ) гідроксид→ купрум(ІІ) оксид → купрум(ІІ) нітрат
Визнач тип кожної реакції за кількістю та складом реагентів та продуктів реакції.
УРОК 2. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ПРЦЕСИ ОКИСНЕННЯ, ВІДНОВЛЕННЯ. ОКИСНИКИ, ВІДНОВНИКИ.
Твої завдання:
- Навчитися класифікувати хімічні реакції за наявністю чи відсутністю зміни ступенів окиснення елементів;
- Познайомитися із процесами окиснення та відновлення;
- Дізнатися про метод електронного балансу;
- Навчитися використовувати метод електронного балансу при
розстановці коефіцієнтів у рівняннях реакцій.
 ПРИГАДАЙ
ПРИГАДАЙ
- Що таке ступінь окиснення?
- Які ти знаєш правила визначення ступенів окиснення?

ЗАПАМ’ЯТАЙ!
Ступінь окиснення – це умовно прийнятий електричний заряд, який мав би атом даного елемента у сполуці, якби всі зв’язки в ній були йонними.
Окисно-відновні – це реакції, під час перебігу яких відбувається зміна ступенів окиснення елементів.
КЛАСИФІКАЦІЯ РЕАКЦІЙ ЗА ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ
|
№ пп. |
Тип реакції |
Чим характеризується |
Приклад |
|
1 |
Реакції без зміни ступеня окиснення |
В ході реакції ступені окиснення хімічних елементів не змінюються |
+2 +4 -2 +2 -2 +4 -2 CaCO3 = CaO + CO2 |
|
2 |
Окисно-відновні реакції (ОВР) |
В ході реакції ступені окиснення хімічних елементів змінюються |
0 +1 -1 +2 -1 0 Zn+HCl = ZnCl2 + H2 |
Процес віддачі електронів – це процес окиснення (ступінь окиснення підвищується ) .
Процес приєднання електронів – це процес відновлення (ступінь окиснення знижується).
Атом чи йон, що віддає електрони, виступає відновником.
відновник – віддає
Атом чи йон, що приєднує електрони, виступає окисником.
окисник – отримує
Кількість відданих електронів дорівнює кількості прийнятих .
Отже, окиснення і відновлення – дві сторони одного окисно-відновного процесу.
 ЗВЕРНИ УВАГУ!
ЗВЕРНИ УВАГУ!
Якщо елемент перебуває у найвищому ступені окиснення, то даний атом може бути тільки окисником.
Якщо елемент перебуває у найнижчому ступені окиснення, то даний атом може бути тільки відновником.
Якщо елемент перебуває у проміжному ступені окиснення, то даний атом може бути і окисником і відновником.
S-2 ; S0; S+4; S+6
відновник окисник і відновник окисник
Алгоритм запису рівнянь окисно-відновних реакції
|
№ дії |
Алгоритм |
Приклад |
|
1. |
Записати схему реакції |
К +Н2О = КОН+ Н2 |
|
2. |
Проставити ступені окиснення елементів до і після реакції |
К 0 + Н2+1О-2= К+1О2-Н+1+Н20 |
|
3. |
Підкреслити елементи, що змінили ступінь окиснення |
К 0 + Н2+1О-2= К+1О2-Н+1+Н20 |
|
4. |
Виписати елементи, що змінили ступінь окиснення, скласти окремо схему процесу віддачі електронів (окиснення) та схему приєднання електронів (відновлення). При цьому врахувати, що схему, де є проста речовина (двохатомна молекула), слід обов̓язково урівняти (один йон гідрогену приєднає два електрони, а два йони гідрогену приєднають відповідно два електрони) |
2Н+1+ 2е = Н20 |
|
5. |
Скласти електронний баланс. Для цього кількість приєднаних та відданих електронів записати за вертикальною рискою праворуч. |
|
|
6. |
Щоб дотримати електронного балансу, знаходимо найменше спільне кратне відданих та приєднаних електронів і записуємо його за другою вертикальною рискою. |
2
|
|
7. |
Ділимо найменше спільне кратне на кількість відданих і приєднаних електронів і дістаємо множники, які і будуть коефіцієнтами перед відповідними формулами у рівнянні. Записуємо ці числа після третьої вертикальної риски |
2
|
|
8. |
Позначимо окисник і відновник, процеси окиснення та відновлення |
(відновник) 2
(окисник) |
|
9. |
Числа , які знаходяться за третьою вертикальною рискою, проставляємо у рівняння перед відповідними формулами. Перевіряємо кількість атомів інших елементів і розставляємо коефіцієнти перед формулами. |
2К +Н2О = 2КОН+ 2Н2 |

ВИКОНАЙ ЗАВДАННЯ (тренувальні вправи)
-
 Вкажіть формули сполук, в яких Хром проявляє максимальний ступінь окиснення: CrO3, CrO, Cr2(SO4)3, Cr(OH)2, K2Cr2O7.
Вкажіть формули сполук, в яких Хром проявляє максимальний ступінь окиснення: CrO3, CrO, Cr2(SO4)3, Cr(OH)2, K2Cr2O7.
- Вкажіть формули сполук, в яких Сульфур проявляє найнижчий ступінь окиснення : S, CuS, SO2, K2SO3, H2SO4, Na2S.
- Встановіть послідовність зростання ступеня окисненя Мангану у сполуках: а) Мn2О7; б) Мn2О; в) МnО2; г) МnО.
- Закінчіть схеми, визначте, який процес (окиснення чи відновлення) відображає схема, окисником чи відновником є даний атом чи йон.
К0 → К+1 S0 → S+6
Р0 → Р+5 S0 → S+4
Р0 → Р-3 S0 → S-2
Р-3 → Р0 S-2 → S+4
О0 → О-2 S+4 → S+6
- Вкажіть, у якому процесі відбувається окиснення Нітрогену:
а) NH3 → NO; в) HNO3 → N2;
б) NO2 → NO; г) KNO2 → NO;
6. Складіть рівняння реакцій за зазначеними схемами:
а) кальцій + хлорид на кислота →
б) кальцій оксид + нітратна кислота →
Яка з реакцій належить до окисно-відновних ? Відповідь мотивуйте складанням електронного балансу.
- Підберіть коефіцієнти методом електронного балансу. Зазначте окисники та відновники, процеси окиснення та відновлення:
а) KClO3 + P → KCl + P2O5;
б) NH3 + O2 → NO + H2O.

РОБОТА В ГРУПАХ
Користуючись алгоритмом, складіть рівняння окисно-відновних реакцій, використовуючи схему електронного балансу. Визначте процеси окиснення та відновлення, окисник та відновник. Визначте тип реакції за числом реагентів та продуктів реакції.
- Na + Cl2 →
б) Fe2O3 + H2 →
в) H2S + O2 →

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
-
 Встановіть відповідність між речовинами та ступенями окиснення Хрому в них:
Встановіть відповідність між речовинами та ступенями окиснення Хрому в них:
А. CrSO4 1. +3
Б. BaCrO4 2. +4
В. Cr2O3 3. +2
Г. Ba(CrO2)2 4. +6
5. +5
2. Закінчіть схеми, визначте, який процес (окиснення чи відновлення)
відображає схема, окисником чи відновником є даний атом чи йон:
а) S-2 → S+6
б) N+5 → N-3
в) Mn+4 → Mn+2
г) Cr+6 → Cr+3
3. Підберіть коефіцієнти методом електронного балансу, зазначте окисники і відновники, процеси окиснення і відновлення:
а) KClO3 → KCl + O2
б) HgO → Hg + O2
в) Ag + HNO3 → AgNO3 + NO2 + H2O
г) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O

ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф підручника.
Завдання: Розставте коефіцієнти в рівняннях реакцій методом електронного балансу, укажіть окисники й відновники:
Завдання середнього рівня: а) CH4+ О2 → СО2 + Н2
б) WO3 + Н2 → W + Н2О
Завдання достатнього рівня: а) KClO3 → KCl + O2
б) H2O + Na → NaOH + Н2
Завдання вищого рівня: а) S + HNO3 → H2SO4 + NO2 + H2O
б) KClО3 + HCl → KCl + Cl2 + H2O
Творче завдання: підготувати міні-проект «Окисно-відновні реакції на кухні»
УРОК 3. СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ.
Твої завдання:
- Повторити правила визначення ступенів окиснення та удосконалити навички визначати ступені окиснення;
- Розвивати уміння складати схеми електронного балансу; урівнювати рівняння реакцій, користуючись схемами електронного балансу; визначати окисник, відновник, процеси окиснення, відновлення.
![]()
ПРИГАДАЙ!
ВПРАВА «ВІРЮ-НЕ ВІРЮ»
Оціни правильність твердження, неправильні твердження поясни.
- В ході реакції розкладу утворюються тільки прості речовини. ;
- В результаті реакції сполучення утворюється обов̓язково одна складна речовина;
- Реакції обміну проходять без зміни ступенів окиснення атомів елементів;
- Поняття «валентність» і «ступінь окиснення» чисельно завжди ;
- В реакціях заміщення більш активний елемент завжди виступає в ролі відновника, а менш активний – в ролі окисника ;
- Процес віддачі електронів називається процесом окиснення ;
- Окисник завжди віддає електрони іншим ;
- В реакціях горіння кисень виступає в ролі окисника ;
- Кількість електронів, які приймає окисник, дорівнює кількості електронів, які віддає відновник ;
- Найнижчий ступінь окиснення елемента визначається номером групи, в якій знаходиться елемент ;
- Елемент у найвищому ступені окиснення може виступати і окисником, і відновником ;
- Елемент у найнижчому ступені окиснення може виступати тільки відновником .

ПОПРАЦЮЙТЕ У ГРУПІ (групи гомогенного складу)
 Варіант С (середній рівень)
Варіант С (середній рівень)
Закінчіть рівняння реакцій, складіть електронний баланс, визначте процеси окиснення та відновлення, окисник та відновник.
А) H2S + O2→ SO2 + H2O
Б) Ca + O2 → CaO
В)N2 + H2→NH3
Варіант В (достатній рівень)
Закінчіть рівняння реакцій, складіть електронний баланс, визначте процеси окиснення та відновлення, окисник та відновник.
А) S + KClO3→ SO2 + KCl
Б) Cu + HNO3(розб.) →Cu(NO3)2 + NO + H2O
В) Fe + HCl → FeCl2 + H2↑
Варіант А (вищий рівень)
Закінчіть рівняння реакцій, складіть електронний баланс, визначте процеси окиснення та відновлення, окисник та відновник.
А) Ni2O3 + H2SO4→ Ni SO4 + O2 + …
Б) H2SO4(конц.)+ Zn → ZnSO4 + H2S + H2O
В) K2Cr2O7 + KI + H2SO4→ Cr2(SO4)3 + I2 + K2SO4 + H2O
САМОСТІЙНА РОБОТА!
 Обери посильнее завдання самостійно на основі самооцінки
Обери посильнее завдання самостійно на основі самооцінки
і виконай його.
 Варіант С (середній рівень)
Варіант С (середній рівень)
(найвища оцінка – 6 балів)
- Вкажіть визначення окисно-відновної реакції:
а) реакція, в якій беруть участь тільки складні речовини;
б) реакція, при протіканні якої змінюються ступені окиснення елементів;
в) реакція, протікання якої обов̓язково супроводжується тепловим ефектом;
г) реакція, яка протікає тільки між простими речовинами.
2. Виберіть формулу речовини, в якій Нітроген має нижчий ступінь
окиснення:
а) HNO3;
б)HNO2;
в)NH3;
г)N2O.
3. Вкажіть перебіг електронів у процесі: Р0 → Р+5:
а) приєднання 5 елеуктронів;
б) приєднання 3 електронів;
в) віддача 3 електронів;
г) віддача 5 електронів.
4. Підберіть коефіцієнти в рівнянні реакції та підрахуйте їх суму:
MnO2 + Al→Al2O3 + Mn:
а) 12;
б) 10;
в) 9;
г) 4.
5. Закінчіть рівняння реакції, визначте процес окиснення та процес
відновлення, окисник та відновник:
Al + C→Al4C3
Варіант В (достатній рівень)
(найвища оцінка – 9 балів)
- Вкажіть визначення окисника:
а) речовина, яка віддає електрони і при цьому окиснюється;
б) речовина, яка віддає електрони і при цьому відновлюється;
в) речовина, яка приймає електрони і при цьому окиснюється;
г) речовина, яка приймає електрони і при цьому відновлюється.
- Виберіть рядок ступенів окиснення Сульфуру відповідно послідовності сполук: H2S,S, Na2SO3, SO3:
а) +2, 0, +4, +6;
б) -2, +1, +4, +5;
в) -2, 0, +4, +6;
г) +2, +3, +4, +6
3. Виберіть твердження щодо речовини, яка виявляє лише відновні
властивості:
а) приєднує електрони;
б) віддає електрони;
в) не змінює ступені окиснення елементів, якими утворена;
г) може як приєднувати, так і віддавати електрони.
4. Закінчіть рівняння реакції, виберіть правильне твердження щодо неї:
Cu + H2SO4(конц.)→ CuSO4 + SO2 + H2O
а) змінюється тільки ступінь окиснення Купруму;
б) відновником є Купрум;
в) Сульфур приймає 6 електронів;
г) відновником є Сульфур.
5. Підберіть коефіцієнти в рівнянні реакції та підрахуйте їх суму:
NH3+ O2→NO + H2O:
а) 19;
б) 23;
в) 9;
г) 12.
Варіант А (вищий рівень)
(найвища оцінка – 12 балів)
- Вкажіть визначення відновника:
а) речовина, яка віддає електрони і при цьому окиснюється;
б) речовина, яка віддає електрони і при цьому відновлюється;
в) речовина, яка приймає електрони і при цьому окиснюється;
г) речовина, яка приймає електрони і при цьому відновлюється.
- Виберіть рядок ступенів окиснення Нітрогену відповідно послідовності сполук: NH3,N2O, NO2, N2O5:
а) -3, +2, +4, +5;
б) -3, +1, +2, +5;
в) -3, +1, +4, +5;
г) +3, +1, +4, +5.
3. Виберіть пару реагентів, які взаємодіють за окисно-відновним
механізмом:
а) кислота та луг;
б) нерозчинний гідроксид та кислота;
в) основний оксид та кислота;
г) метал та кислота.
4. Закінчіть рівняння реакції, виберіть правильне твердження щодо неї:
Mg + H2SO4(конц.)→ MgSO4 + H2S + H2O
а) змінюється тільки ступінь окиснення Магнію;
б) відновником є магній;
в) Сульфур приймає 6 електронів;
г) відновником є Сульфур.
5. Підберіть коефіцієнти в рівнянні реакції та підрахуйте їх суму:
K2Cr2O7 + HCl→CrCl3 + KCl + Cl2 + H2O:
а) 19;
б) 23;
в) 29;
г) 32.

ДОМАШНЄ ЗАВДАННЯ
Повторити відповідний параграф.
Завдання вищого рівня: у схемах окисно-відновних реакцій підберіть коефіцієнти методом електронного балансу, визначте окисник та відновник, процеси окиснення та відновлення.:
H2S + SO2 = H2O + S;
Cu + HNO3 = Cu(NO3)2 + NO2 + H2O.
Творче випереджальне завдання на вибір учнів: підготуйте повідомлення про ОВР у житті людини.
УРОК 4. ЗНАЧЕННЯ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ.
Очікувані завдання:
- Розширити знання про окисно-відновні реакції;
- Дізнатися про їх значення у природі, техніці та житті людини.;
- Закріпити навички складання хімічних рівнянь окисно-відновних реакцій, розстановки коефіцієнтів на онові методу електронного балансу.;
- Розвивати вміння аналізувати, критично мислити, працювати в групах.

ПРИГАДАЙ!
Вправа «ПРОДОВЖ РЕЧЕННЯ»
- За числом реагентів та продуктів хімічні реакції поділяються на ….
- Реакції, при яких із однієї складної речовини утворюються дві чи більше простих чи складних речовин, це реакції …
- Реакції заміщення відбуваються між …
- Під час реакцій обміну дві …. обмінюються складовими частинами.
- При реакціях сполучення із …. утворюється ….
- Окисно-відновні реакції – це реакції, що відбуваються із …
- Процес окиснення – це процес …
- Процес віддачі електронів називається процесом …
- Що робить відновник (віддає чи приєднує електрони)?
- Окисник - …. електрони.
- У процесі окиснення ступінь окиснення елемента …
- У процесі відновлення ступінь окиснення елемента …
- Елементи можуть виступати тільки відновниками тоді, коли ступінь окиснення елемента …
- Елементи в найвищому ступені окиснення завжди виступають …
- Елементи можуть виявляти властивості і окисників і відновників тоді, коли вони мають …. ступені окиснення.

ВИКОНАЙ ТЕСТОВІ ЗАВДАННЯ
1. Вкажіть правильне твердження: «Окисник – це атом, молекула чи йон, який …»
А) окиснюється;
Б) віддає електрони;
В) приймає електрони;
2. Вкажіть електронне рівняння процесу відновлення Сульфуру:
![]()
![]() А) S0 – 4e =S+4 В) S0 + 2e = S-2
А) S0 – 4e =S+4 В) S0 + 2e = S-2
![]()
![]() Б) S-2 -2e = S0Г) S+4 – 2e = S+6
Б) S-2 -2e = S0Г) S+4 – 2e = S+6
3. Вкажіть ступінь окиснення Мангану у речовині К2МnО4:
А) +7 ; Б) +6; В) + 4; Г) +2.
4. Вкажіть речовину, яка виступає в окисно-відновних реакціях лише як
відновник:
А) SO2; Б) ZnS; В) K2SO3; Г) K2SO4;
5. Вкажіть перебіг електронів у процесі S+6 → S-2:
А) приєднання 4 електронів; Б) приєднання 8 електронів;
В) віддавання 8 електронів; Г) віддавання 4 електронів.
6. Вкажіть формулу речовини, у якої ступінь окиснення Фосфору дорівнює -3:
А) HPO3; Б) P2O3; В) AlP; Г)PCl3.
7. Вкажіть правильне твердження: «Процес окиснення – це процес …»:
А) приєднання електронів; Б) віддачі електронів;
В) взаємодії речовини з воднем; В) взаємодії речовини з повітрям.
8. Вкажіть перебіг електронів у процесі Mn+7 →Mn+2:
А) приєднаня 9 електронів; Б) віддавання 9 електронів;
В) приєднання 5 електронів; В) віддавання 5 електронів.
9. Встановіть послідовність зростання ступенів окиснення у Хлору сполуках:
А) HClO; Б) HClO4; В) HClO3; Г) KCl.
10. Вкажіть кількість електронів, відданих чи приєднаних атомами згідно
схеми: HNO3 → NO2:
А) віддано 5 електронів; Б) приєднано 5 електронів;
В) віддано 1 електрон; Г) приєднано 1 електрон.

РОБОТА В ГРУПАХ (Групи гетерогенного складу)
Завдання 1. Виконайте разом завдання на картках..
Група №1
Окисно-відновні процеси у природі.
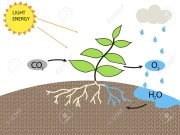 А) Усі ви знаєте, що зелені рослини виконують космічну роль: насичують атмосферу киснем в процесі фотосинтезу. Тільки завдяки цьому процесу можливе існування живих істот на планеті. Цей процес описується рівнянням:
А) Усі ви знаєте, що зелені рослини виконують космічну роль: насичують атмосферу киснем в процесі фотосинтезу. Тільки завдяки цьому процесу можливе існування живих істот на планеті. Цей процес описується рівнянням:
СО2 + Н2О = С6Н12О6 + О2.
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення. Увага! Врахуйте, що ступінь окиснення атома Карбону у глюкозі С6Н12О6 дорівнює нулю, тоді як валентність його у цій сполуці чотири.
Б) Трохи історії. У 79 р.н.е. відбулося виверження вулкану Везувію. До цього часу він був мальовничою горою, але ось над Везувієм здійнялася хмара незвичайної форми, посипався попіл, у повітрі відчувався запах сірки. Виверження вулкану повністю знищило Помпею. Місто зникло під шаром попелу, який досягнув 3 м. відбулися процеси:
 H2S + O2 = S + H2O
H2S + O2 = S + H2O
H2S + O2 = SO2 + H2O
H2S + SO2 = S + H2O
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
В) Під час грозових розрядів відбувається зв̓язування азоту за схемою:
 N2+ O2 =NO
N2+ O2 =NO
NO + O2 = NO2
NO2 + H2O = HNO3 + HNO2
Кислоти, які утворюються, потрапляють разом з опадами у грунт, перетворюючись на нітрати та нітрити. Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
Група №2
Окисно-відновні процеси у техніці
А) Бертолетову сіль використовують у піротехніці для виготовлення сигнальних ракет, бенгальських вогнів та інших легкозаймистих сумішей. Цю речовину вперше отримав Бертоле. Чому вона є вибухонебезпечною? Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
КClO3 → KCl + O2
 Б) Чи уявляєте ви сьогодні своє життя без металів та виробів з них? Мабуть, ні. А добувають метали із руд шляхом відновлення із оксидів. Відновниками виступають: кокс, водень, чадний газ . ось деякі схеми рівнянь реакцій цих процесів:
Б) Чи уявляєте ви сьогодні своє життя без металів та виробів з них? Мабуть, ні. А добувають метали із руд шляхом відновлення із оксидів. Відновниками виступають: кокс, водень, чадний газ . ось деякі схеми рівнянь реакцій цих процесів:
CuO + CO = Cu + CO2
MoO3 + H2 = Mo + H2O
PbO + C = Pb + CO2
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
 В) Кожен з вас спостерігав утворення іржі на поверхні стальних виробів. Цей процес руйнування металів та сплавів під впливом умов навколишнього середовища називається корозією. Його можна описати схемою:
В) Кожен з вас спостерігав утворення іржі на поверхні стальних виробів. Цей процес руйнування металів та сплавів під впливом умов навколишнього середовища називається корозією. Його можна описати схемою:
Fe + O2+ H2O → Fe(OH)3
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
Група № 3
Окисно-відновні процеси у житті людей
А) Чи зможете ви пояснити рядки поетеси А.Ахматової:
 На рукомойнике моем
На рукомойнике моем
Позеленела медь.
Но так играет луч на нем,
Что весело глядеть.
Це явище можуть пояснити хіміки. Мідь реагує відразу з трьома речовинами: киснем, водою і вуглекислим газом і утворюється речовина зеленого кольору – основна сіль.
Cu + O2 + H2O + CO2 = (CuOH)2CO3
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
 Б) Щодня ми зустрічаємося із дивом, яке титан Прометей приніс людям, за що його й покарали розгнівані боги. Нині ми це диво викликаємо звичайними сірниками. Що відбувається під час тертя сірником об шорстку поверхню сірникової коробки? А тут протягом секунди проноситься цілий ураган хімічних реакцій. До складу коричневої замазки на коробці сірників входить фосфор. Його частинки спалахують на коробці від енергії тертя, підпалюючи головку сірника. При температурі 2000сірка, яка перейшла у рідкий стан, взаємодіє з бертолетовою сіллю: KClO3 + S→ KCl + SO2↑
Б) Щодня ми зустрічаємося із дивом, яке титан Прометей приніс людям, за що його й покарали розгнівані боги. Нині ми це диво викликаємо звичайними сірниками. Що відбувається під час тертя сірником об шорстку поверхню сірникової коробки? А тут протягом секунди проноситься цілий ураган хімічних реакцій. До складу коричневої замазки на коробці сірників входить фосфор. Його частинки спалахують на коробці від енергії тертя, підпалюючи головку сірника. При температурі 2000сірка, яка перейшла у рідкий стан, взаємодіє з бертолетовою сіллю: KClO3 + S→ KCl + SO2↑
За температури 3700 розкладається бертолетова сіль:
КClO3 → KCl + O2↑
Кисень, що виліляється, вступає в реакцію з сіркою:
S + O2→ SO2↑
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.
 В) Чи уявляєте ви своє життя без природного газу, яким зараз користуються люди майже в кожній оселі? Завдяки йому у нас завжди тепло і затишно в будинках, на газових плитах ми готуємо їжу. Природний газ – сировина для виробництва безлічі речовин. Основна складова частина природного газу – метан. Він, згораючи, виділяє велику кількість теплоти, яку ми і використовуємо для своїх потреб:
В) Чи уявляєте ви своє життя без природного газу, яким зараз користуються люди майже в кожній оселі? Завдяки йому у нас завжди тепло і затишно в будинках, на газових плитах ми готуємо їжу. Природний газ – сировина для виробництва безлічі речовин. Основна складова частина природного газу – метан. Він, згораючи, виділяє велику кількість теплоти, яку ми і використовуємо для своїх потреб:
СН4 + О2 → СО2 + Н2О
Закінчіть рівняння реакцій, доберіть коефіцієнти методом електронного балансу, вкажіть процеси окиснення та відновлення.

Завдання 2: Обміняйтеся думками про те, що ви дізналися про роль окисно-відновних реакцій у природі, техніці та житті людей.

ЗАПАМ’ЯТАЙ!
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()



Інтерактивна
 ПОПРАЦЮЙ ТВОРЧО!
ПОПРАЦЮЙ ТВОРЧО!
ВПРАВА «МЕТОД ПРЕС»
Вирази свою точку зору щодо проблеми: «Окисно-відновні реакції – користь чи шкода?»
Я вважаю, що окисно-відновні реакції – це користь…
Тому що ….
Наприклад, …
Таким чином, …
А я вважаю, що окисно-відновні реакції – це шкода,
Тому що ….
Наприклад, …
Таким чином, …

ДОМАШНЄ ЗАВДАННЯ
Опрацювати параграф.
Завдання: Написати рівняння реакцій, за допомогою яких можна здійснити перетворення. До окисно-відновних реакцій скласти схеми електронного балансу, визначити процеси окиснення та відновлення, окисник та відновник:
Cu →CuO → CuCl2 → Cu
Тема 5. ЕКЗОТЕРМІЧНІ ТА ЕНДОТЕРМІЧНІ РЕАКЦІЇ. ТЕРМОХІМІЧНЕ РІВНЯННЯ.
Твої завдання:
- розширити уявлення про класифікацію хімічних реакцій на прикладі ендотермічних і екзотермічних реакцій;
- дізнатися, що таке «тепловий ефект хімічної реакції», «термохімічні рівняння»;
- навчитися складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
-
 Розвивати вміння аналізувати, критично мислити, працювати в групах.
Розвивати вміння аналізувати, критично мислити, працювати в групах.
ЗАПАМ’ЯТАЙ!
Хімічні реакції, які відбуваються з виділенням теплоти, називають екзотермічними (від грецького «екзо» – «назовні»).
Хімічні реакції, які відбуваються з поглинанням теплоти, називають ендотермічними (від грецького «ендо» – «всередину»).
Кількість теплоти, яка поглинається або виділяється під час хімічних реакцій, називають тепловим ефектом реакції (позначається: ΔH («дельта-аш»)).
Тепловий ефект позначається:
а) Q – показує скільки теплоти (в кДж) виділилося або поглинулося під час реакції;
б) ∆ Н – показує різницю між вмістом енергії у вихідних речовинах і кінцевих продуктах
∆ Н = - Q
Тепловий ефект вимірюється в Дж або в кДж
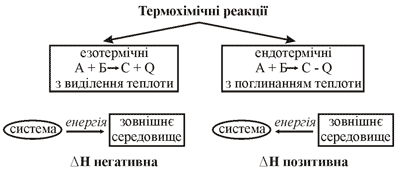
Якщо реакція екзотермічна (супроводжується виділенням теплоти), то вміст енергії у вихідних речовинах більший, ніж у продуктах реакції, теплота виділяється в навколишнє середовище й енергія реакційної системи зменшується, тоді тепловий ефект ΔH буде негативним.
Для ендотермічних реакцій вміст енергії у вихідних речовинах менший, ніж у добутих продуктах, теплота надходить іззовні у систему, енергія системи збільшується, тепловий ефект ΔH буде позитивний.
Величина H стосується того числа моль речовин, яке визначено рівнянням реакції.
Галузь хімії, яка досліджує теплові ефекти під час хімічних реакцій, називається термохімією.
Хімічні рівняння, в яких вказується тепловий ефект, називають термохімічними.
Наприклад, термохімічне рівняння: 2СО (г) + О2 (г) = 2СО2 (г), ΔН = – 566 кДж.
означає, що при взаємодії 2 моль карбон(ІІ) оксиду та 1 моль кисню утворюється 2 моль карбон(ІV)оксиду і при цьому виділяється 566 кДж тепла.

ВИКОНАЙ ЗАВДАННЯ:
Завдання 1.
Визнач тип хімічної реакції за тепловим ефектом хімічної реакції.
N2 + O 2 = 2NO ; ∆Н = −180 кДж
2HI + Cl2 = I2 + 2HCl ; ∆Н < 0
N2 + 3H2 = 2NH3 ; ∆Н = - 83 кДж
CO + H2 O = CO2 + H2 ; ∆Н < 0
2CO + O 2 = 2CO2 ; ∆Н < 0
MnO2 + 2C → Mn +2CO; ∆H = +293 кДж
2HBr → H2 +Br2 ; ∆Н >
Завдання 2.
б) SO2 + O 2 → 2SO3; ∆H < 0
в) N2 + O 2 → 2NO ; ∆H = +180,5 кДж

НАВЧИСЯ РОЗВ’ЯЗУВАТИ ЗАДАЧІ ЗА ТЕРМОХІМІЧНИМИ РІВНЯННЯМИ. ЦЕ НЕ СКЛАДНО!
 Алгоритм розв’язування задач на знаходження кількості теплоти, що виділиться чи вбереться під час взаємодії певної кількості речовини, маси чи об’єму речовини
Алгоритм розв’язування задач на знаходження кількості теплоти, що виділиться чи вбереться під час взаємодії певної кількості речовини, маси чи об’єму речовини
- Прочитай уважно умову задачі.
- Запиши скорочено умову задачі
- Склади термохімічне рівняння.
- Підкресли у рівнянні формули речовин, про які іде мова і підпиши під ними кількість моль за рівнянням.
5. Знайди кількість речовини за умовою задачі, постав над формулою
6. Склади й розв’яжи пропорцію.
7. Записати відповідь.
Наприклад:
Задача 1.
Дано термохімічне рівняння реакції горіння карбон(ІІ) оксиду:
2СО (г) + О2 (г) = 2СО2 (г), ΔН = – 566 кДж.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон(ІІ) оксиду.
Розв’язок
Дано: 4 моль Х кДж
![]() ν(СО) = 4 моль 2СО (г) + О2 (г) = 2СО2 (г) + 566 кДж.
ν(СО) = 4 моль 2СО (г) + О2 (г) = 2СО2 (г) + 566 кДж.
![]() 2моль
2моль
Q - ? Х = (566 ·4) : 2 = 1132 (кДж)
Відповідь: Q = 1132 кДж
Задача 2.
Обчисліть кількість теплоти, що виділиться при горінні сірки масою 64 г, якщо тепловий ефект реакції становить 310 кДж.
![]() Дано: Розв’язок:
Дано: Розв’язок:
m(S) = 64 г 2 моль Х кДж
ΔН = – 310 кДж. S + O2 = SO2; ΔН = – 310 кДж.
![]() 1 моль
1 моль
Знайти: 1) Знах. кількість речовини S.
Q - ?
![]()
M(S) =32 г/моль; ν(S) = 64 г : 32 г/моль = 2 моль
2) Знах. кількість теплоти, що виділиться.
Х =2 · 310 кДж = 620 кДж
Відповідь: Q = 620 кДж

Алгоритм розв’язування задач на знаходження теплового ефекту реакції та написання термохімічного рівняння.
- Прочитай уважно умову задачі.
- Запиши скорочено умову задачі
- Склади рівняння реакції.
4. Підкресли у рівнянні формули речовин, про які іде мова і підпиши під ними кількість моль за рівнянням.
5. Знайди кількість речовини за умовою задачі, постав над формулою
6. Постав у рівняння значення кількості теплоти
7. Склади й розв’яжи пропорцію.
8. Запиши термохімічне рівняння
Наприклад,
Задача
За певних умов вуглець масою 120 г окиснюють до карбон (ІІ) оксиду. При цьому виділяється 1105 кДж теплоти. Напишіть термохімічне рівняння реакції.
Розв’язок
![]() Дано: 10 моль 1105 кДж
Дано: 10 моль 1105 кДж
m(С) = 120 г 2С + О2 → 2СО +Х кДж
Q = 1105 кДж 2 моль
![]()
∆Н - ? 1. Знах. кількість речовини вуглецю.
![]()
M(С) =12 г/моль; ν(С) = 120 г : 12 г/моль = 10 моль
2. Знах. тепловий ефект реакції.
![]() =
= ![]() ; Х =
; Х = ![]() = 221 (кДж)
= 221 (кДж)
Відповідь: 2С + О2 → 2СО ; ∆ Н = - 221 кДж
 Алгоритм розв’язування задач на знаходження маси чи об’єму вихідних речовин чи продуктів реакції за відомими значеннями теплового ефекту та кількості теплоти, що виділиться чи вбереться під час взаємодії даної маси чи об’єму речовини
Алгоритм розв’язування задач на знаходження маси чи об’єму вихідних речовин чи продуктів реакції за відомими значеннями теплового ефекту та кількості теплоти, що виділиться чи вбереться під час взаємодії даної маси чи об’єму речовини
- Прочитай уважно умову задачі.
- Запиши скорочено умову задачі
- Запиши термохімічне рівняння реакції.
- Підкресли у рівнянні формули речовин, про які іде мова і підпиши під ними кількість моль за рівнянням. Над значенням теплового ефекту надпиши кількість теплоти (Q).
- Надпиши Х над формулою речовини, масу чи об’єм якої знаходимо.
- Склади й розв’яжи пропорцію, знайди кількість речовини, масу чи об’єм якої треба знайти.
- Визначи масу чи об’єм речовини, користуючись формулами:
V = Vm ∙ ν; m = M ∙ ν
8. Запиши відповідь.
Наприклад,
Задача
Дано термохімічне рівняння горіння вуглецю:
С (т) + О2 (г) = СО2 (г), ΔН = – 394 кДж.
Обчисліть об’єм вуглекислого газу (н.у.), що утворився під час реакції, якщо виділилося 985 кДж теплоти.
Дано: Розв’язок
![]() ΔН = – 394 кДж. Х моль 985 кДж
ΔН = – 394 кДж. Х моль 985 кДж
Q = 985кДж С (т) + О2 (г) = СО2 (г) ; ΔН = – 394 кДж
у.н. 1 моль
V(СО2) -? 1. Знаход.кількість моль карбон(ІV) оксиду за
![]() рівнянням реакції.
рівнянням реакції.
Х = ![]() = 2,5 моль
= 2,5 моль
- Знах. об’єм карбон(ІV) оксиду.
V = Vm ∙ ν; V(СО2) = 22,4 л/моль ∙ 2,5 моль =56 л
Відповідь: V(СО2) = 56 л
 ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗУВАННЯ
ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗУВАННЯ
 1. Скільки теплоти виділиться при взаємодії водню з 2 л хлору (у.н.), якщо термохімічне рівняння реакції має вигляд: H2 + Cl2 = 2HCl ; ∆Н = - 184 кДж
1. Скільки теплоти виділиться при взаємодії водню з 2 л хлору (у.н.), якщо термохімічне рівняння реакції має вигляд: H2 + Cl2 = 2HCl ; ∆Н = - 184 кДж
2. Складіть термохімічне рівняння реакції розкладу арґентум(І) оксиду, якщо при утворенні срібла кількістю речовини 0,1 моль поглинається 1,55 кДж теплоти.
3. Обчисліть, яка маса цинку окиснилася, якщо в результаті реакції виділилось 174,5 кДж тепла. Термохімічне рівняння:
2Zn + O 2 → 2ZnO; ∆H = - 34,9 кДж
4. За рівнянням реакції СаСО3 → СаО + СО2 ; ∆ Н = 170 кДж
обчислити кількість теплоти, яка поглинається при розкладанні 500 г вапняку.
5. За термохімічним рівнянням
2Н2 + О2 =2Н2О; ∆ Н= +571,6 кДЖ
Обчисліть об’єм витраченого водню (н.у.), коли відомо, що виділилося 142,9 кДЖ теплоти.
6. За термохімічним рівнянням
C + О2 =CО2; ∆ Н= +410 кДЖ
Обчисліть кількість речовини вуглекислого газу, якщо виділилося 20,5кДЖ теплоти.
7. При взаємодії 7,8 г калію з хлором виділилось 87,18 кДж теплоти. Скласти термохімічне рівняння.
8. Обчисліть, скільки теплоти поглинається під час взаємодії 0,25 моль водню з йодом, якщо тепловий ефект реакції становить +50,8 кДж.
9. Визначити тепловий ефект реакції горіння магнію, якщо в результаті згоряння 14,4 г. магнію виділилось 361,5 кДж теплоти.
10. Обчисліть тепловий ефект утворення води, якщо при спалюванні 8 г водню виділилось 1143,3 кДж теплоти.

ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф .
Розвязати задачу:
Яка маса металу утвориться, якщо для розкладу меркурій (ІІ) оксиду витратилося 33,4 кДж теплоти? 2HgO →2Hg + O2 ; ∆H = 167кДж.
Творче завдання:
підготувати навчальні проекти на теми: «Ендотермічні реакції на службі людини» та «Екзотермічні реакції в життєдіяльності живих організмів» (НА ВИБІР).
УРОК 6. ЕКЗОТЕРМІЧНІ ТА ЕНДОТЕРМІЧНІ РЕАКЦІЇ. РОЗВ’ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ ЗА ТЕРМОХІМІЧНИМИ РІВНЯННЯМИ.
Твої завдання:
- розширити уявлення про класифікацію хімічних реакцій за різними критеріями,
- удосконалити навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
 ПРИГАДАЙ!
ПРИГАДАЙ!
- Які реакції називаються екзотермічними?
- Наведи приклади екзотермічних реакцій, які відбуваються в побуті, природі;
- Які реакції називаються ендотермічними?
- Наведи приклади ендотермічних реакцій, які відбуваються в побуті, промисловості;
- Що таке тепловий ефект реакції?
- Як за значенням теплового ефекту визначити приналежність хімічної реакції до екзотермічної чи ендотермічної.
- Що називається термохімічним рівнянням?

ВИКОНАЙ ВПРАВУ
 «Спіймай помилку»
«Спіймай помилку»
(Виправ невірні твердження, відповідь поясни)
- За числом реагентів та продуктів реакції усі хімічні реакції поділяються на реакції заміщення, обміну, сполучення, нейтралізації;
- Окисник - речовина, яка віддає електрони і при цьому окиснюється;
- Ступінь окиснення Сульфуру у сульфатній кислоті +4)
- Відновник завжди приєднує електрони;
- Послідовність ступенів окиснення Сульфуру відповідно послідовності сполук H2 S, S, SO2 , SO3 : -2, +1, +4, +6 ;
- У реакції Zn + 2HCl →ZnCl2 + H2 цинк відновлюється ;
- Тепловий ефект хімічної реакції не залежить від природи речовин, що реагуютьЮ а залежить від їх кількості ;
- Реакції, що перебігають з виділенням теплоти, називаються ендотермічними ;
- В будь-якій хімічній реакції теплота має тільки поглинатися ;
- При протіканні екзотермічних реакцій температура реакційного середовища збільшується .

ПОПРАЦЮЙ В ГРУПІ (групи гомогенного складу)
 Оберіть собі завдання по силі. Варіант А - завдання вищого рівня, варіант В – достатнього рівня, варіант С – середнього рівня.
Оберіть собі завдання по силі. Варіант А - завдання вищого рівня, варіант В – достатнього рівня, варіант С – середнього рівня.
Варіант С
Користуючись алгоритмом , розв’яжіть задачі.
1. При згорянні сірки кількістю речовини 1 моль в кисні виділяється 297 кДж теплоти. Складіть термохімічне рівняння реакції.
2. При розкладанні меркурій (ІІ) оксиду кількістю речовини 2 моль поглинається 176 кДж теплоти. Запишіть термохімічні рівняння реакції.
3. Позначте екзотермічні та ендотермічні рівняння:
а) H2 + I2 = 2HI; ∆H = +52 кДж
б) 2Zn + O2 = 2ZnO; ∆H = - 6960 кДж
в) CO + 2H2 = CH3OH; ∆H = -109 кДж
г) 2KNO3 → 2KNO2 + O2; ∆H = + 510кДж
Варіант В
- Обчисліть кількість речовини кальцій гідроксиду, яка утворилася за рівнянням реакції СаО + Н2О = Са(ОН)2; ∆H = -65 кДж, якщо виділилось 260 кДж теплоти.
- При окисненні магнію одержали 20,27 г магній оксиду. При цьому виділилося 305 кДж теплоти. Напишіть термохімічне рівняння.
- Вкажіть правильне твердження: «Термохімічне рівняння окиснення нітроген(ІІ) оксиду 2 NO + O2 = 2 NO2; ∆H = - 112,9 кДж показує, що під час» …» :
а) Окиснення 1 моль нітроген(ІІ) оксиду поглинається 112,9 кДж теплоти;
б) Окиснення 2 моль нітроген(ІІ) оксиду виділяється 112,9 кДж теплоти;
в) Утворення 2 моль нітроген(ІV) оксиду поглинається 112,9 кДж теплоти;
г) Утворення 1 моль нітроген(ІV) оксиду виділяється 112,9 кДж теплоти;
Варіант А.
1. Термохімічне рівняння реакції горіння етилену:
С2Н4 + 3О2 = 2СО2 + Н2О; H = –1400 кДж.
Скільки теплоти виділиться, якщо прореагувало кисню: а) кількістю
речовини 1 моль; б) масою 16 г; в) об’ємом 336 л?
2. Термохімічне рівняння реакції:
S(тв.) + H2(газ.) = H2S(газ.); H = –20,9 кДж.
Розрахуйте об’єм сірководню, який утворився при взаємодії сірки та
водню, якщо при цьому виділилось 108 кДж теплоти.
3. Термохімічне рівняння реакції горіння вуглецю:
С(т)+ О2(г) = СО2(г), ΔН° = –402 кДж. Обчисліть
а) кількість теплоти, яка виділиться при спалюванні 800 г вугілля, масова частка Карбону в якому становить 98 %;
б) масу вугілля, при спалюванні якого виділилось 2800 кДж теплоти.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
 Обери самостійно, на основі самооцінки, варіант певного рівня складності.
Обери самостійно, на основі самооцінки, варіант певного рівня складності.
Варіант А (вищий рівень)
1. Вкажіть характеристику хімічної реакції, схема якої
А + ВС = АС + В; ∆Н < 0:
а) обміну, ендотермічна; б) заміщення, екзотермічна;
в) сполучення, екзотермічна; г) заміщення, ендотермічна.
2. Вставте пропущені слова, щоб утворилося правильне твердження: «Енергетичний ефект реакції дорівнює ……реагентів і продуктів реакції»:
а) різниці між внутрішньою енергією;
б) добутку внутрішньої енергії;
в) сумі внутрішніх енергій;
г) відношенню внутрішніх енергій;
3. Вкажіть правильне твердження: «Термохімічне рівняння горіння етану
2С2Н6 +7О2 = 4СО2 + 6Н2О; ∆Н = - 3120 кДж показує, що під час згорання …» а) 2 моль етану поглинається 3120 кДж теплоти;
б) 1 моль етану поглинається 3120 кДж теплоти;
в) 1 моль етану виділяється 3120 кДж теплоти;
г) 2 моль етану виділяється 3120 кДж теплоти;
4. Обчисліть і вкажіть кількість теплоти, що поглинається під час утворення нітроген(ІІ) оксиду (тепловий ефект реакції ∆Н = + 181 кДж), якщо прореагував азот масою 280 г:
а) 18,1 кДж; б) 36,2 кДж; в) 362 кДж; г) 1810 кДж.
5. Творча задача : Обчисліть об’єм метану, потрібного на обігрівання 100-квартирного будинку протягом доби, якщо затрати теплоти на одну квартиру
становлять 1000 кДж, а термохімічне рівняння реакції:
СН4 + 2О2 = СО2 + 2Н2О, ΔН = –803 кДж.
Варіант В (достатній рівень)
1. Позначте правильні твердження щодо перебігу хімічних реакцій:
а) тепловий ефект залежить від природи речовини;
б) реакції з поглинанням тепла називаються ендотермічними;
в) реакції з поглинанням тепла називаються екзотермічними;
г) тепловий ефект позначається К.
2. Вкажіть, до якого типу належить реакція з тепловим ефектом ∆Н > 0:
а) ендотермічних; б) каталітичних;
в) екзотермічних; г) гетерогенних.
3. Вкажіть рівняння екзотермічних реакцій:
а) СН4 + Н2О = СО + 3Н2; ΔН >0
б) Н+ + ОН- = Н2О; ΔН < 0
в) 2Н2 + О2 = 2Н2О; ΔН =- 571,6 кДж.
- Термохімічне рівняння горіння ацетилену
2С2Н2 + 5О2 = 4СО2 + 2Н2О, ΔН = –2610 кДж. З рівняння реакції випливає, що під час згорання:
а) 2 моль ацетилену поглинається 2610 кДж теплоти;
б) 2 моль ацетилену виділяється 2610 кДж теплоти;
в) 1 моль ацетилену поглинається 2610 кДж теплоти;
г) 1 моль ацетилену виділяється 2610 кДж теплоти.
- Напишіть термохімічне рівняння взаємодії алюмінію з киснем , якщо при окисненні алюмінію масою 9 г виділяється 274, 44 кДж теплоти.
Варіант С (середній рівень)
1. Вкажіть, як позначається тепловий ефект реакції:
а)Q ; б) q ; в) ΔН; г) ΔЕ.
- Реакції, які супроводжуються виділенням теплоти, називаються :
а) ендотермічними; б) каталітичними;
в) екзотермічними; г) гомогенними.
3. Вкажіть одиниці вимірювання теплового ефекту хімічної реакції:
а) г/моль; б) t0С;
в) кВт; г) кДж.
4. Доберіть класифікаційну характеристику, за якою хімічні реакції поділяють на екзотермічні та ендотермічні:
а) кількість та склад реагентів та продуктів реакції;
б) зміна ступенів окиснення атомів елементів у сполуках;
в) напрям реакції за одних і тих же умов;
г) тепловий ефект реакції.
5. Обчисліть і вкажіть кількість теплоти, яка виділиться чи поглинеться при спалюванні сірки кількістю речовини 0,1 моль за термохімічним рівнянням:
S + О2 = SО2; ΔН = –297 кДж:
а) виділиться 29,7 кДж теплоти;
б) поглинеться 29,7 кДж теплоти;
в) поглинеться 2970 кДж теплоти;
г) виділиться 2970 кДж теплоти;

ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф.
Розв’язати задачу: Для одержання цинк оксиду, що входить до складу цинкового білила, спалюють цинковий пил у струмені кисню. Обчисліть тепловий ефект (кДж) хімічної реакції,якщо відомо, що під час згоряння цинку масою 6,5г виділяється 34,9 кДж теплоти.
Підготувати цікаві сповіщення про значення екзотермічних та ендотермічних реакцій у промисловості, природі, житті людини.
Підготувати сповіщення на тему: «Калорійність харчових продуктів»
УРОК 7. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
Твої завдання:
- Дізнатися, що таке швидкість хімічної реакції;
- розглянути , які впливають на швидкість хімічної реакції природа реагуючих речовин, температура, концентрація, поверхня зіткнення реагуючих речовин, каталізатори та інгібітори.
- вчитися самостійно працювати з новою інформацією, новим матеріалом, аналізувати та виділяти головне, основне у вивченому матеріалі.
- навчитися розв’язувати задачі з використанням поняття «швидкість хімічної реакції».
 ПРИГАДАЙ!
ПРИГАДАЙ!
- Що таке концентрація речовин?
- Які ви знаєте ознаки хімічних реакцій?
- Що таке каталізатор?

ЗАПАМ’ЯТАЙ!
Швидкість реакції – це зміна кількості речовини реагенту (чи продукту) в одиниці об’ємі за одиницю часу.
Величина що показує вміст кількості речовини в одиниці об’єму називається концентрацією.
![]() ,
,
де c – концентрація ![]() , ν – кількість речовини [моль], V – об’єм [л].
, ν – кількість речовини [моль], V – об’єм [л].
Швидкість хімічної реакції - це зміна концентрації одного з реагуючих речовин або продуктів реакції в одиницю часу.
![]()
Швидкість реакції вимірюється в моль / (л • сек).
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика.

ЗВЕРНИ УВАГУ!
Залежність швидкості хімічної реакції від різних факторів:
|
Фактор |
Приклад реакції |
Висновок |
|
Природа реагентів |
HCl + Zn = ZnCl2 + H2↑- швидкість менша HCl+ Mg = MgCl2 + H2↑- швидкість більша, бо Mg активніший |
Чим активніший реагент, тим швидкість реакції більша |
|
Поверхня зіткнення реагентів |
Zn (пор.) + HCl – швидк. більша Zn (гран.) + HCl – швидк. менша |
Чим більша площа зіткнення реагентів, тим більша швидкість реакції |
|
Концентрація реагентів |
HCl (10%) + Zn - швидкість менша HCl (20%) + Zn – швидкість більша |
Чим вища концентрація реагентів, тим більша швидкість реакції Закон діючих мас: Швидкість гомогенної реакції пропорційна добутку концентрацій реагуючих речовин. aA(г)+bB(г)=cC(г)+dD(г)
|
|
Температура |
HCl + Zn = ZnCl2 + H2↑- швидкість менша HCl+ Zn = ZnCl2 + H2↑- швидкість більша при підвищ. t0 |
При підвищенні температури на кожні 100 швидкість реакції зростає у 2-4 рази (правило Вант-Гоффа) |
|
Присутність каталізатора |
|
Каталізатори прискорюють швидкість реакції, інгібітори сповільнюють |
Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.
Явище прискорення швидкості реакції за допомогою каталізатора називається каталізом.
Позитивні каталізатори збільшують швидкість реакції, а негативні зменшують. Речовини, які сповільнюють швидкість реакції, називаються інгібіторами.
Ферменти - каталізатори білкової природи.

ЦЕ НЕ СКЛАДНО (творчі запитання)
- Що згоряє швидше дерев’яна: дошка чи дерев`яні ошурки?
- Чому не можна під час пожежі відкривати вікна?
- Чому влітку зростає небезпека харчових отруєнь?
- Чому харчові продукти довше зберігаються у вакуумних упаковках?
5) Чому, аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують ?
6) В разі отруєння лікарі призначають активоване вугілля. Порадьте, як необхідно прийняти цей засіб, щоб ефект дії пігулок був максимально швидким .
7) Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. Чому?
8) Для чого в давнину наші пращури пристосовували на самовар чобіт?

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
-
 Швидкість хімічної реакції позначається:
Швидкість хімічної реакції позначається:
А.W ; Б.V; В.m; Г.t.
2.Швидкість хімічної реакції вимірюється в таких одиницях:
А) моль/л ; Б) г/моль; В) моль/л·с; Г) л/моль.
3. За якою формулою обчислюється швидкість хімічної реакції:
∆С m V n
-



 V = ± ; Б. M= ; B. Vm = ; Г. α = .
V = ± ; Б. M= ; B. Vm = ; Г. α = .
∆t υ υ N
4.Швидкість хімічної реакції при підвищенні концентрації вихідних речовин:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.
5. Швидкість хімічної реакції при підвищенні температури:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.
6. Із збільшенням поверхні стикання реагуючих речовин швидкість реакції:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично
7. Каталізатори, це речовини, що:
А. сповільнюють хімічну реакцію; Б. прискорюють хімічну реакцію;
В. не впливають на швидкість хімічної реакції.
8. Інгібітори, це речовини, що:
А. сповільнюють хімічну реакцію; Б. прискорюють хімічну реакцію;
В. не впливають на швидкість хімічної реакції.
9. Зазвичай каталізатори указують:
А. у реагентах; Б.у продуктах реакції; В. над знаком рівності.
10.Чому продукти харчування зберігають у холодильниках:
А. Зі зменшенням концентрації реагентів швидкість реакції спадає;
Б .Інгібітори сповільнюють хімічні реакції;
В. Зі спаданням температури швидкість реакції спадає.
- Вкажіть причину, чому швидкість хімічної реакції між магнієм і хлоридною кислотою більша, ніж між залізом і тією самою кислотою:
А) різний агрегатний стан реагентів;
Б) різна активність металів;
В) реакція є екзотермічною;
Г) реакція є каталітичною
12. Вкажіть швидкість реакції горіння дерев’яного поліна, якщо його розщепити на тріски:
А) збільшиться, тому що збільшиться площа поверхні контакту реагентів;
Б) збільшиться, тому що збільшується концентрація реагентів;
В) зменшиться, тому що зменшиться температура реакційної суміші;
Г) зменшиться, тому що знижується активність реагентів.
 ДОМАШНЄ ЗАВДАННЯ
ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф,
повторити тему «Хімічні реакції»,
підготуватися до захисту проектів з теми «Екзотермічні та ендотермічні реакції».
УРОК 8. ОБОРОТНІ І НЕОБОРОТНІ РЕАКЦІЇ
Твої завдання:
- Дізнатися, що таке оборотні реакції; які реакції відносяться до оборотних;
- вивчити , що таке хімічна рівновага;
- які фактори впливають на зміщення хімічної рівноваги;
- розглянути питання, чи можна керувати хімічною рівновагою, навчитися виконувати завдання та вправи на зміщення хімічної рівноваги.

ПРИГАДАЙ!
- Що називається йонними реакціями?
- Коли йонні реакції доходять до кінця, тобто приводять до утворення продукту реакції?

ВИКОНАЙ ЗАВДАННЯ
Написати молекулярні та йонні рівняння реакцій між:
А) магній хлоридом та натрій гідроксидом,
Б) калій карбонатом та хлоридною кислотою,
В) калій оксидом та сульфатною кислотою.
Чи будуть реакції приводити до утворення продукту, тобто доходити до кінця ? За якою ознакою ви можете зробити висновок про те, що реакція проходить в одному напрямку?

ЗАПАМ’ЯТАЙ!
Реакції, які відбуваються в одному напрямку до повного перетворення вихідних речовин у продукти реакції, називаються необоротними.
Необоротними будуть реакції, в результаті яких утворюється осад, газ або малодисоційована речовина.
Якщо реакція відбувається у двох протилежних напрямках ( нові речовини утворюються і знову розкладаються на вихідні речовини) і не доходить до кінця, тобто не приводить до утворення нового продукту, називаються оборотними.
Оборотні реакції записують одним хімічним рівнянням, у якому позначають дві стрілки у двох протилежних напрямах. Утворення карбонатної кислоти можна назвати прямою реакцією, а її розклад – зворотною реакцією: H2O + CO2 ![]() H2CO3.
H2CO3.
У загальному вигляді оборотні реакції можна зобразити так:
A + В ![]() С. Або A + В ↔С
С. Або A + В ↔С
Реакцію, що протікає зліва направо, називають прямою реакцією. Реакцію, що відбувається справа наліво – зворотною реакцією.
Коли швидкість прямої реакції дорівнює швидкості зворотної реакції, настає хімічна рівновага.
υпрямої = υзворотної.
Стан хімічної рівноваги: скільки частинок вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції, тобто концентрації речовин залишаються незмінними.
Характер зміщення рівноваги залежно від дії зовнішніх чинників вивчав французький вчений Ле-Шательє , який створив принцип зміщення хімічної рівноваги.
Якщо на систему, що перебуває у стані хімічної рівноваги, подіяти зовнішнім чинником, то рівновага зміщується у напрямі процесу, який послаблює цю дію.
 ЗВЕРНИ УВАГУ!
ЗВЕРНИ УВАГУ!
Умови зміщення хімічної рівноваги
|
Чинники |
Зміщення рівноваги |
Приклад |
|
Температура (t°) |
А + Б
А + Б Під час підвищення температури рівноважної системи рівновага зміщується на бік ендотермічної реакції, а під час зниження – на бік екзотермічної. У реакції, яка протікає без теплового ефекту, зміна температури не впливає на зміщення рівноваги. |
N2 + 3H2 |
|
Концентрація (C) |
Cбільша → Cменша При підвищенні концентрації вихідних речовин рівновага зміститься на бік зменшення концентрації, тобто в напрямку утворення продукту реакції. |
|
|
Тиск (для газів, ρ) |
Vбільший → Vменший Підвищення тиску зміщує рівновагу системи на бік утворення менших об’ємів, а зменшення його – на бік утворення більших об’ємів. Якщо в процесі оборотної реакції об’єми газуватих речовин не змінюються, то зміна тиску не впливає на стан рівноважної системи. |
|
|
Каталізатор |
Не зміщує хімічну рівновагу, бо однаково впливає на швидкість прямої та зворотної реакцій. |
|

ПОПРАЦЮЙ В ГРУПІ (групи гетерогенного складу)
- У системі А + В ↔ С; ∆Н < 0, де А, В, С – гази, встановилася рівновага. Як зміниться стан хімічної рівноваги, якщо:
а) підвищити тиск?
б) збільшити кількість речовини А в системі?
в) підвищити температуру?
2) Як треба змінити тиск, температуру та концентрацію речовин, щоб змістити рівновагу в бік прямої реакції: 2SO2(г) + О2 (г) ↔ 2SO3 (г) ∆Н = - 284,2 кДж. Визначити, до яких типів відноситься реакція за відомими вам критеріями класифікації.
3) Установіть відповідність між рівняннями реакцій та умовами зміщення рівноваги в бік продуктів реакції:
Рівняння: Умови зміщення рівноваги:
а) N2(г) + 3H2(г)↔2NH3(г); ∆Н < 0 1) підвищення t0 і зниження тиску
б) 2SO2(г)+O2(г)↔2SO3 (г); ∆Н > 0 2) зниження t0 і підвищення тиску
в) CO2(г)+C(к)↔2CO (г); ∆Н < 0 3) підвищення t0 і підвищення тиску
г) 2NH3(г)↔N2(г) + 3H2(г);∆Н > 0 4) зниження t0 і зниження тиску

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
-
 Доберіть твердження, що відповідає поняттю оборотної реакції: «Оборотні реакції, це …»
Доберіть твердження, що відповідає поняттю оборотної реакції: «Оборотні реакції, це …»
а) реакції, що відбуваються з виділенням теплоти;
б) реакції, що супроводжуються поглинанням теплоти;
в) реакції, що за однакових умов характеризуються взаємодією реагентів з утворенням продуктів реакції та взаємодією продуктів реакції з утворенням вихідних речовин;
г) реакції, що за однакових умов характеризуються лише взаємодією реагентів з утворенням продуктів реакції.
- Доберіть твердження, що відповідає поняттю необоротної реакції: «Необоротні реакції, це …»
а) реакції, що відбуваються з виділенням теплоти;
б) реакції, що супроводжуються поглинанням теплоти;
в) реакції, що за однакових умов характеризуються взаємодією реагентів з утворенням продуктів реакції та взаємодією продуктів реакції з утворенням вихідних речовин;
г) реакції, що за однакових умов характеризуються лише взаємодією реагентів з утворенням продуктів реакції.
- Доберіть класифікаційну характеристику, за якою хімічні реакції поділяються на оборотні та необоротні:
а) кількість та склад реагентів і продуктів реакції;
б) зміна ступенів окисненя атомів елементів у сполуках;
в) напрям реакції за одних і тих самих умов;
г) тепловий ефект реакції.
4. Укажіть, який фактор не може вплинути на рівновагу в оборотній реакції:
а) зміна температури;
б) зміна тиску;
в) зміна концентрації вихідних речовин;
г) внесення каталізатора.
5. У реагуючій системі, рівняння якої 2NO(г) + Cl2 (г)↔2NOCl(г); ΔН >0 рівновага зміститься вправо :
а) внаслідок підвищення тиску;
б) внаслідок використання каталізатора;
в) внаслідок зниження температури;
г) розведення кислоти.
6. У рівноважній системі, рівняння якої СН4 (г)+ 4S(тв.) ↔ СS2(г)+ 2Н2S(г) );ΔН<0
рівновага зміститься вліво :
а) внаслідок зниження тиску;
б) внаслідок зниження температури;
в) внаслідок додаткового введення сірки;
г) внаслідок підвищення концентрації Н2S.
7. Визначте, як треба змінити параметри стану системи (температуру, тиск, концентрації вихідних речовин та продуктів реакції), щоб змістити хімічну рівновагу в бік продуктів реакції:
а) Рb(кр) + Н2S(г) ↔ Рb S(кр) + Н2(г) ; Н < 0
б) С4Н8(г) + Н2(г) ↔ С4Н10(г) ; Н < 0
8. Які з реакцій, рівняння яких наведено, будуть необоротними:
а) 3NaOH + H3PO4 = Na3PO4 + 3H2O;
б) 2Na + 2H2O = 2NaOH + H2;
в) 3NaOH + К3PO4 = Na3PO4 + 3КOН;
г) ВаCl2 + H2SO4 = ВаSO4↓+ 2HCl;
9. Напишіть рівняння реакцій йонного обміну між купрум(ІІ) сульфатом та натрій гідроксидом. Вкажіть кількість катіонів у повному йонному рівнянні цієї реакції:
а) 3: б) 5; в) 6; г) 9.
10. До скороченого йонного рівняння Ва2+ + SO42- = ВаSO4↓ наведіть приклад молекулярного та повного йонного рівняння.

ДОМАШНЄ ЗАВДАННЯ
Опрацювати відповідний параграф.
Завдання «Хімік-технолог»
Охарактеризуйте хімічну реакцію за усіма відомими вам критеріями класифікації. Для окисно-відновної реакції скласти схему електронного балансу, розставити коефіцієнти). Як треба змінити параметри стану системи (температуру, тиск, концентрації вихідних речовин та продуктів реакції), щоб змістити хімічну рівновагу в бік продукту реакції:
СО2(г) + С(тв.) ↔ СО(г); ΔН<0;
УРОК 9. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. ОБОРОТНІ ТА НЕОБОРОТНІ РЕАКЦІЇ. ВИКОНАННЯ ВПРАВ ТА РОЗВ’ЯЗУВАННЯ ЗАДАЧ.
Твої завдання:
- Закріпити знання про швидкість хімічної реакції, вплив різних чинників на швидкість реакції,
- Поповнити знання про оборотні та необоротні реакції, хімічну рівновагу та способи зміщення хімічної рівноваги.
- удосконалити уміння розв’язувати задачі на швидкість хімічної реакції;
- виконувати вправи на зміщення хімічної рівноваги.
 ПРИГАДАЙ!
ПРИГАДАЙ!
- Що таке швидкість хімічної реакції?
- Які чинники впливають на швидкість хімічної реакції?
- Як впливає температура на швидкість реакції? Сформулюй правило Вант-Гоффа.
- Як впливає концентрація на швидкість реакції? Сформулюй закон діючих мас.
- Що таке каталізатори, інгібітори?
- Що таке каталіз та які є види каталізу?
- Які реакції називаються необоротними?
- Які реакції називаються оборотними?
- Що таке хімічна рівновага?

ВИКОНАЙ ЗАВДАННЯ САМОСТІЙНО
-
 Швидкість хімічної реакції обчислюється за формулою:
Швидкість хімічної реакції обчислюється за формулою:
а) ύ = c1- c2; б) ύ = c – τ
в) ![]() г)
г) ![]()
- Одиницею вимірювання швидкості хімічної реакції є:
а) моль/л·с; б) моль/год;
в) г/моль·с; г) м/моль·с.
3. В якому рядку хімічні символи розташовані за порядком зменшення швидкості хімічної реакції цих речовин з хлоридною кислотою:
а Na, Mg, Zn, Fe, Cu;
б)Mg, Na, Fe, Zn, Cu;
в)Mg, Fe, Cu, Zn;
г) Mg, Na, Zn, Cu, Fe.
4. Які дві речовини будуть реагувати між собою з більшою швидкістю за однакових умов:
а) Zn і Н2 SO4 ;
б) Mg і Н2 SO4;
в) Fe і Н2 SO4;
г) Рb і Н2 SO4
5. Вкажіть, як змінюється швидкість хімічної реакції у разі підвищення температури:
а) збільшується; б) зменшується;
в) зменшується, якщо реакція ендотермічна,
г) збільшується, якщо реакція екзотермічна.
6. Вкажіть чинник, який впливає на швидкість реакції між цинковим пилом і хлоридною кислотою:
а) природа реагентів;
б) концентрація реагентів;
в) агрегатний стан реагентів;
г) площа поверхні контакту реагентів.
7. Вкажіть правильнее твердження щодо впливу інгібіторів на швидкість хімічної реакції:
а) збільшують вихід продуктів реакції;
б) прискорюють хімічну реакцію;
в) сповільнюють хімічну реакцію;
г) не впливають на швидкість реакції.
8. Вкажіть назву реакцій, які за одних і тих же умов відбуваються одночасно у протилежних напрямках:
а) каталітичні; б) необоротні;
в) гетерогенні; г) оборотні.
9. Вкажіть чинник, який не впливає на зміщення хімічної рівноваги:
а) тиск; б) температура;
в) каталізатор; в) концентрація реагуючих речовин.
10. Вкажіть назву біологічних каталізаторів, які забезпечують стабільний перебіг біохімічних процесів:
а) інгібітори; б) ферменти;
в) індикатори; г) гормони.
11. Закінчіть речення: «Хімічна рівновага – це …»:
а) стан реагуючої суміші, при якому реакція відбувається з утворенням осаду;
б) стан реагуючої суміші, при якому скільки молекул нової речовини утворюється, стільки й знову розкладається на вихідні речовини;
г) стан реагуючої суміші, при якому швидкість прямої реакції більша, ніж зворотної;
д) стан реагуючої суміші, при якому реакція відбувається в одному напрямку.
12. При збільшенні концентрації реагуючих речовин хімічна рівновага:
а) зміщується в бік зворотної реакції;
б) не зміщується взагалі;
в) зміщується в бік прямої реакції;
г) зміщується в бік реагуючих речовин.

ПОПРАЦЮЙ В ГРУПІ (групи гетерогенного складу)
 Розв’язування задач з використанням поняття «швидкість хімічної реакції»
Розв’язування задач з використанням поняття «швидкість хімічної реакції»
Задача.
Концентрація одного з реагентів на початку реакції становила 1 моль/л, а через 4 сек. Від початку реакції – 0,6 моль/л. Обчислити середню швидкість цієї реакції.
Задача.
Як зміниться швидкість реакції, температурний коефіцієнт якої 2, при підвищенні температури з 10 до 40 °С?
Задача
Визначте температурний коефіцієнт реакції, якщо при підвищенні температури з 20 до 60 °С її швидкість збільшилась у 256 разів.

ВИКОНАЙ САМОСТІЙНО
Задача 1.
У скільки разів зросте швидкість хімічної реакції , якщо збільшити температуру з 60 до 100 °C? Температурний коефіцієнт реакції прийняти рівним 3 .
Задача 2.
Обчисліть температурний коефіцієнт реакції, швидкість якої зростає у 40 разів при підвищенні температури від 40 до 80 °C .

ПРИГАДАЙ!
Вправа «Незакінчене речення»
 - Принципи зміщення хімічної рівноваги установив ….. вчений ……
- Принципи зміщення хімічної рівноваги установив ….. вчений ……
- При підвищенні температури рівновага екзотермічної реакції зміщується в бік …
- При зниженні температури рівновага екзотермічної реакції зміщується в бік …
- При підвищенні температури рівновага ендотермічної реакції зміщується в бік …
- При зниженні температури рівновага ендотермічної реакції зміщується в бік …
- При підвищенні тиску рівновага зміщується в бік ….
- При збільшенні концентрації реагуючих речовин рівновага зміщується в бік …
- При збільшенні концентрації продукту реакції рівновага зміщується в бік …

ПОПРАЦЮЙ В ПАРІ ІЗ ТОВАРИШЕМ!
Виконання вправ на зміщення хімічної рівноваги
Завдання.
- Як збільшення концентрації вуглекислого газу вплине на зміщення рівноваги у системі: 2СО ↔ СО2 + С ?
- Як підвищення тиску вплине на зміщення рівноваги у системі: СО + Н2О (г) ↔ СО2 + Н2 ?
- Як підвищення тиску вплине на зміщення рівноваги у системі: N2(г) + 3H2(г)↔2NH3(г); ∆Н < 0
- Як збільшення тиску може позначиться на рівновазі в системі: N2 + O 2 = 2NO; ∆Н = 180 кДж
- Для якої з хімічних реакцій підвищення тиску не вплине на рівновагу: а) 2NО(г) + О2(г) ↔ 2NО2 (г)
б) 2 Н2О(г) ↔ 2 Н2(г) + О2(г)
в) N2(г) + O 2(г) = 2NO(г);
6) Як зміститься рівновага хімічної реакції 2СО + О2 ↔ 2СО2 ; ∆Н< 0 при підвищенні температури?
7) Як зміститься рівновага хімічної реакції 2SО2 + О2 ↔ 2SО3 ; ∆Н< 0 при зниженні температури?
8) Як за допомогою температури змістити рівновагу в системі:
Fe3O4 + 4CO ↔ 3Fe + 4 СО2 ; ∆Н = 43, кДж

ДОМАШНЄ ЗАВДАННЯ
Повторити відповідні параграфі підручника.
Розв’язати задачі:
1) У скільки разів зросте швидкість реакції при підвищенні температури від 300С до 700С , якщо температурний коефіцієнт швидкості цієї реакції дорівнює 3?
2) Позначте вірне твердження щодо системи, в якій встановилася рівновага: N2(г) + 3H2(г)↔2NH3(г); ∆Н < 0 :
а) При збільшенні тиску рівновага зміститься в бік продуктів реакції;
б) При збільшенні температури рівновага зміститься в бік продуктів реакції;
в) При збільшенні концентрації азоту рівновага зміститься в бік реагентів;
г) При зменшенні концентрації амоніаку рівновага зміститься в реагентів.
УРОК 10. ЗАХИСТ НАВЧАЛЬНИХ ПРОЕКТІВ
УРОК 11. УЗАГАЛЬНЕННЯ ЗНАНЬ З ТЕМИ « ХІМІЧНІ РЕАКЦІЇ»
Твої завдання:
- Упорядкувати знання, повторити теоретичні відомості з даної теми;
- удосконалити навички написання рівнянь реакцій, визначення їх типів ;
- удосконалювати навички складати окисно-відновні реакції, розставляти коефіцієнти за схемами електронного балансу;
- розвивати уміння розв’язувати задачі.

ПРИГАДАЙ!
 ВПРАВА «ОБГАНЯЛКИ»
ВПРАВА «ОБГАНЯЛКИ»
Клас ділиться на дві команди. За 1 хвилину командам треба дати якнайбільше відповідей на запитання. За кожну правильну відповідь учню зараховується 1 бал.
Запитання першій команді.
- Реакції, при яких із однієї складної речовини утворюється декілька простих чи складних речовин називаються реакціями …
- Реакція між двома складними речовинами, при яких вони обмінюються своїми складовими частинами, називається реакцією …
- Умовно прийнятий електричний заряд, який мав би атом даного елемента у сполуці, якби всі зв’язки в ній були йонними, називається ….
- Процес віддачі атомом, молекулою чи йоном електронів називається процесом …
- Атом чи йон, що віддає електрони, виступає …
- Якщо елемент перебуває у найвищому ступені окиснення, то даний атом може бути тільки …
- Якщо елемент перебуває у проміжному ступені окиснення, то даний атом може бути …
- Реакції, які супроводжуються виділенням енергії, називаються …
- Кількість теплоти, яка виділяється чи вбирається під час хімічної реакції, називається …
- Для ендотермічних реакцій значення теплового ефекту …
- Рівняння, в яких зазначається тепловий ефект, називаються …
- Величина що показує вміст кількості речовини в одиниці об’єму називається …
- При підвищенні температури швидкість хімічної реакції …
- При збільшенні концентрації реагуючих речовин швидкість реакції …
- Чим менша площа поверхні стикання реагуючих речовин, тим швидкість реакції …
- Речовина, яка прискорює швидкість реакції, але сама при цьому не витрачається, називається …
- Явище прискорення швидкості реакції за допомогою каталізатора, називається …
- Стан реагуючої суміші, при якому швидкості прямої і зворотної реакції однакові, називається …
- Принцип зміщення хімічної рівноваги установив …
- При збільшенні температури екзотермічної реакції хімічна рівновага зміститься в бік …
Запитання другій команді.
- Реакції, при яких із двох чи більше простих чи складних речовин утворюється одна складна речовина називаються реакціями …
- Реакція між простою і складною речовиною, при якій атоми простої речовини заміщують один з видів атомів у складній речовині, називається реакцією …
- Реакції, під час перебігу яких відбувається зміна ступенів окиснення елементів, називаються …
- Процес приєднання атомом, молекулою чи йоном електронів називається процесом…
- Атом чи йон, що приєднує електрони, виступає …
- Якщо елемент перебуває у найнижчому ступені окиснення, то даний атом може бути тільки …
- Алгебраїчна сума ступенів окиснення у сполуці завжди …
- Реакції, які супроводжуються вбиранням енергії, називаються …
- Тепловий ефект позначається …
- Для екзотермічних реакцій значення теплового ефекту …
- Галузь хімії, яка досліджує теплові ефекти під час хімічних реакцій, називається …
- зміна концентрації одного з реагуючих речовин або продуктів реакції в одиницю часу, це …
- При зниженні температури швидкість хімічної реакції …
- При зменшенні концентрації реагуючих речовин швидкість реакції …
- Чим більша площа поверхні стикання реагуючих речовин, тим швидкість реакції …
- Речовина, яка сповільнює швидкість реакції, називається …
- Правило Вант-Гоффа говорить, шо із збільшенням температури на кожні 10 ˚C швидкість реакції збільшується в середньому у …
- Щоб змістити хімічну рівновагу, треба змінити …
- Підвищення тиску приведе до зміщення рівноваги в бік …
- Збільшення концентрації реагуючих речовин приведе до зміщення хімічної рівноваги в бік …
 ВИКОНАЙ ЗАВДАННЯ САМОСТІЙНО!
ВИКОНАЙ ЗАВДАННЯ САМОСТІЙНО!
 ВПРАВА «МІРКУВАЛКИ»
ВПРАВА «МІРКУВАЛКИ»
Обери завдання собі по силі. Виконай завдання і перевір сам себе.
Після виконання вправи на екрані проектуються правильні відповіді
Варіант С (завдання середнього рівня)
Закінчіть рівняння реакцій (розставте коефіцієнти). Дайте характеристику реакціям за різними критеріями:
Сполучення;
Розкладу;
Обміну;
Заміщення;
Окисно-відновні;
Проходять без зміни ступенів окиснення;
Екзотермічні;
Ендотермічні;
Оборотні;
Необоротні;
S + O2 → SO2 ; ∆H = - 297 кДж
HgO ↔ Hg + O2 ; ∆H = 180 кДж
N2+O2↔ NO; ∆H= 182 кДж
СаСО3 → СаО + СО2 ; ∆ Н = 170 кДж
СаСО3 + НСl = СаСl2 + Н2О + СО2 ;
Мg + НСl = МgСl2 + Н2↑; ∆H < 0;
SO2 + О2 = SO3 ; ∆H < 0;
Варіант В (завдання достатнього рівня)
1. Визначте ступінь окиснення елементів у сполуках :
А) Cl2, Mn2O7, H2O2, H2S, LiH, OF2, Al2S3, SO3
Б) NaClO, HNO3, KNO2 , Ba3(PO4)2
2. Допишіть електронні рівняння.
Fe0 - 3e → Fe
2I-1 - → I20
Cr+6 +3e → Cr
О20 + 4е →2О
S-2 - 8e → S
Сu+2 . →Cu0
- Закінчіть рівняння реакцій (розставте коефіцієнти). Дайте характеристику реакціям за різними критеріями:
Н2О(г) + Сl2(г) ↔ НСl(г) + О2; ∆H > 0;
СН4 (г) + Н2О(г) ↔ СО2(г) + Н2(г) ; ∆H < 0;
КСlО3 → КСlО4 + КСl; ∆H < 0.
Варіант А (завдання вищого рівня)
- Перетворіть схеми на рівняння. Встановіть відповідність між рівнянням та окисно-відновними процесами, що відбуваються з атомами хімічного елемента Оксигену. Дайте характеристику реакціям за різними критеріями:
А) NaNO3 NaNO2 + O2; ∆H > 0. 1. Атоми Оксигену відновлюються
Б) НСl + SO3 = H2SO4 ; ∆H < 0. 2. Атоми оксисену окиснюються
В) Al + O2 = Al2O3; 3. Атоми Оксигену не змінюють
ступеня окиснення
- Визначте, у якому випадку відбувається процес окиснення, а в якому – відновлення. Складіть відповідну схему переходу електронів:
А) SO2 → H2SO4
Б) Вr2 → НВr;
В) НСlО3 → НСl;
Г) Р → Н3РО4;
- У схемі окисно-відновної реакції підберіть коефіцієнти методом електронного балансу, вкажіть процес окиснення та відновлення, окисник та відновник:
К2Сr2О7 + НСl → СrСl3 + Сl2↑ + КСl + Н2О

ТВОРЧЕ ЗАВДАННЯ! Це не складно!
 ВПРАВА «ЗАГАДАЛКИ»
ВПРАВА «ЗАГАДАЛКИ»
Ви – технолог заводу по виробництву сульфатної кислоти. Запропонуйте способи підвищення процесу виробництва (збільшення швидкості хімічних реакцій та зміщення рівноваги в бік утворення сульфатної кислоти)
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 ↔ 2SO3; ∆H < 0.
SO3 + Н2О = H2SO4 ; ∆H < 0.
- Ви – технолог заводу по виробництву нітратної кислоти. Запропонуйте способи підвищення процесу виробництва (збільшення швидкості хімічних реакцій та зміщення рівноваги в бік утворення нітратної кислоти)
2NО + О2 = 2NО2; ∆H < 0
4NО2 + 2Н2О + O2 = 4Н NО3; ∆H < 0
3. Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов висновку:
а) швидкість реакцій зростає з підвищенням температури;
б) швидкість реакцій прямо пропорційна концентрації реагентів;
в) із часом швидкість реакцій збільшується;
г) швидкість реакцій можна змінити, використовуючи каталізатор.
Поясніть, у якому з пунктів учень припустився помилки.

ПОПРАЦЮЙ В ГРУПІ!
 ВПРАВА «РАХУВАЛКИ»
ВПРАВА «РАХУВАЛКИ»
Робота в групах гетерогенного складу. Кожній групі потрібно розв’язати по дві задачі. Перша група - № 1 і № 2.
Друга група - № 3 і № 4.
Третя група - № 5 і № 6.
Задачу № 7 розв’язує учень чи група, яка першою справилася і з завданням. Отримавши відповіді, представники груп визначають, якій літері в таблиці відповідає отримана відповідь. Таким чином, визначивши усі літери, учні отримують прізвище вченого, який відкрив процес алюмінотермії.
- При взаємодії 7,8 г калію з хлором виділилось 87,18 кДж теплоти. Скласти термохімічне рівняння.
- Обчисліть, скільки теплоти поглинається під час взаємодії 0,25 моль водню з йодом, якщо тепловий ефект реакції становить +50,8 кДж.
- Яка кількість теплоти виділиться при згорянні вуглецю масою 2,4 г, якщо термохімічне рівняння : С + O2 →СО2 ; ∆Н = -393 кДж .
- Яка маса фосфору згоріла, якщо теплота, що виділяється в результаті реакції, становила : - 30,10 кДж . Термохімічне рівняння: 4Р + 5О2 → 2Р2О5 ; ∆Н = - 3010 кДж.
- Скласти термохімічне рівняння окиснення цинку, якщо відомо, що під час окиснення 13 г його виділилось 70,16 кДж теплоти.
- При відновленні вуглецем купрум(ІІ) оксиду масою 7,95 г поглинаються 5,15 кДж теплоти. Обчисліть кількість теплоти, необхідної для добування таким чином 100 г металічної міді.
- При розкладанні кальцій карбонату масою 24,4 г поглинулося 43,9 кДж теплоти. Напишіть термохімічне рівняння реакції розкладу кальцій карбонату.
|
№ задачі |
В і д п о в і д і |
||||||
|
1,24 |
12,7 |
701,6 |
871,8 |
78,6 |
81 |
180 |
|
|
№1 |
а |
н |
ю |
Б |
р |
с |
з |
|
№2 |
ж |
Е |
є |
в |
у |
ф |
ч |
|
№3 |
с |
р |
ц |
й |
К |
п |
л |
|
№4 |
Е |
я |
г |
ш |
з |
щ |
ю |
|
№5 |
в |
ч |
Т |
у |
г |
н |
ь |
|
№6 |
й |
ц |
в |
ф |
и |
О |
л |
|
№7 |
в |
ю |
т |
п |
н |
р |
В |
Інформація: Це вчений, який відкрив процес добування металів з їх оксидів шляхом відновлення за допомогою алюмінію:
Fe2O3 + 2Al = 2Fe + Al2O3; ∆H < 0.

ДОМАШНЄ ЗАВДАННЯ
Підготуватися до письмової роботи.
Завдання. Визначити фактори, завдяки яким можна змістити рівновагу в бік утворення заліза за рівнянням: Fe2O3 + 2Al = 2Fe + Al2O3; ∆H < 0. Яким чином можна збільшити швидкість даної реакції?
УРОК 12. КОНТРОЛЬ ЗНАНЬ З ТЕМИ «ХІМІЧНІ РЕАКЦІЇ»
1


про публікацію авторської розробки
Додати розробку
