Молярна маса. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою
Поки не має таких приладів, які б дали змогу відрахувати певне число частинок речовини і відміряти число молів. Зручніше користуватися масою речовини – це величини, які залежать одна від одної. Нам необхідно вияснити цю закономірність та навчитися користуватися в практичній діяльності.
8 клас хімія Урок 33-34
Тема. Молярна маса. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою
Мета:
- Ввести поняття «молярна маса»; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв'язок між кількістю речовини, масою, молярною
- розвивати пізнавальний інтерес, логічне мислення, пам’ять, формувати науковий світогляд.
- виховувати творчу , допитливу особистість, почуття гідності, бережливості, вміння працювати в колективі, взаємодопомогу.
Обладнання та реактиви: періодична система хімічних елементів Д. І.
Девіз уроку: Просто знати – це не все. Знання потрібно використовувати. Й. Гете
Хід уроку
І-ий міні-модуль
Контрольно-рефлексивний
І. Організаційний момент
ІІ. Актуалізація опорних знань учнів. Вчитель
Ми, з вами вивчили цікаву величину – кількість речовини, знаємо одиницю її вимірювання, навчилися визначати число атомів і молекул в певній кількості речовини. То ж давайте перевіримо як ви вмієте оперувати цими поняттями. Для цього ми проведемо гру «Хто швидше».
Умови цієї гри:
Вчитель ставить запитання. Хто знає відповідь, плеще в долоні та дає відповідь. Отож, розпочинаємо.
– Як позначається кількість речовини?
– Що таке кількість речовини?
– В яких одиницях вимірюється кількість речовини?
– Що таке моль?
– Чому дорівнює число Авогадро?
– Як позначається відносна молекулярна маса речовини?
– В яких одиницях вимірюється відносна молекулярна маса речовини
– На що вказує хімічна формула речовини?
– Чому дорівнює відносна молекулярна маса кисню?
Хімічний диктант
1) Скільки атомів Феруму міститься в 2 моль заліза? (12,04 · 1023 атомів)
2) Молярна маса молекули кисню О2 дорівнює... (32 г/моль)
3) Формула розрахунку кількості речовини за відомою масою речовини. (n = m/М)
4) Стала Авогадро NА дорівнює... (6,02 · 1023 частинок/моль)
5) Одиниці вимірювання молярної маси. (кг/моль або г/моль)
У цей час два учні на дошці наводять розв'язання домашніх задач.
ІІ-ий міні-модуль
Адаптивно-перетворвальний
ІІІ. Мотивація навчальної діяльності.
Поки не має таких приладів, які б дали змогу відрахувати певне число частинок речовини і відміряти число молів. Зручніше користуватися масою речовини – це величини, які залежать одна від одної. Нам необхідно вияснити цю закономірність та навчитися користуватися в практичній діяльності. Повідомлення теми та мети уроку
IV. Вивчення нового матеріалу
Бесіда вчителя про молярну масу, одиниці її вимірювання. Проводиться аналогія між молярною масою речовини та відносною молекулярною масою речовини. Встановлюється зв’язок між масою речовини, молярною масою та кількістю. Отже, молярна маса — це маса 1 моль речовини, а отже, сумарна маса всіх частинок, що входять в 1 моль цієї речовини. Молярна маса пропорційна масі однієї молекули певної речовини. Тому числове значення молярної маси дорівнює відносній молекулярній масі для будь-якої речовини.
Молярна маса — це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини.
M = m/n; де n-кількість речовини, m-маса речовини. Позначається молярна маса- M. Одиниці вимірювання: кг/моль або г/моль. Отже, знаючи молярну масу речовини та її кількість, можна обчислити масу речовини. І навпаки, знаючи кількість речовини – можна обчислити її масу.
M = m/n, m=n*M, n=m/M



 Для учнів, які відчувають труднощі з математики, корисно буде подати формули у вигляді «магічних трикутників»:
Для учнів, які відчувають труднощі з математики, корисно буде подати формули у вигляді «магічних трикутників»:
N
![]()
![]()
![]()
![]() m
m
n M n A
![]()
![]()
Користуватися «магічними трикутниками» просто. Достатньо лише закрити символ тієї величини, яку потрібно знайти. Давайте повернемося до девізу нашого уроку. Про що він говорить? Правильно, ми повинні навчитися використовувати все на практиці.
Проводиться робота в парах. Кожна пара вибирає посилене завдання.
– Яка маса заліза кількістю речовини 2 моль?
![]()
![]() Дано: Розв’язання
Дано: Розв’язання
![]() n (Fe)=2моль m=n*M Mr(Fe)=56; M(Fe)=56г/моль
n (Fe)=2моль m=n*M Mr(Fe)=56; M(Fe)=56г/моль
m(Fe)- ? m(Fe)=2*56=112 г
Відповідь: 112 г
–Яка маса алюмінію кількістю речовини 5 моль?
![]()
![]() Дано: Розв’язання
Дано: Розв’язання
n (Al)=5моль m=n*M Mr(Al)=27;
![]() M(Al)=27г/моль,
M(Al)=27г/моль,
m(Al)- ? m(Al)=5*27=135 г
Відповідь: 135 г
–Яка маса кальцій оксиду кількістю речовини 0,6 моль?
![]()
![]() Дано: Розв’язання
Дано: Розв’язання
![]() n(CaO)=0,5моль m=n*M Mr(CaO)=40+16=56
n(CaO)=0,5моль m=n*M Mr(CaO)=40+16=56
m(CaO)- ? M(CaO)=56 г/моль
m(CaO)=0,5*56=28 г
Відповідь:28 г
ІІІ-ій міні-модуль
Адаптивно-перетворвальний
Формування навичок і вмінь
Учитель. Сьогодні ви навчитеся здійснювати обчислення за хімічними формулами з використанням фізичних величин «кількість речовини» й «молярна маса».
На аркуші наведені задачі, які ми розв'яжемо з використанням вивчених на попередньому уроці формул, а також формули, що знадобляться для розрахунків у процесі розв'язання задач.
Записуємо на дошці формули:
n= N/NA, M = m/n, m=n*M, n=m/M , N=n*NA
Розв’язування задач. Практика на прикладах
Задача Розрахуйте кількість речовини натрій хлориду (NaCl) масою 125 г.
![]() Дано: Розв’язання
Дано: Розв’язання
![]() m(NaCl)=125 г 1) Обчислюємо молярну масу
m(NaCl)=125 г 1) Обчислюємо молярну масу
n(NaCl)-? М(NaCl)=23+35,5=58,5 г/моль
2) За формулою n = m/М:
n=125/58,5=2,1 моль
Відповідь: 2,1 моль.
Задачі для самостійного розв’язання
Задача 2
Обчисліть масу 4 моль нітратної кислоти HNО3.
![]() Дано: Розв’язання
Дано: Розв’язання
![]() n(HNО3)=4моль 1) Обчислюємо молярну масу
n(HNО3)=4моль 1) Обчислюємо молярну масу
m(HNО3)-? М(HNО3)=1+14+16*3=63 г/моль
2) З формули n = m/М випливає:
m = n *М, тоді m(HNО3) = 4 моль · 63 г/моль = 252 г.
Відповідь: 252 г.
Задача 3
Обчисліть масу кальцій карбонату (СаСО3) кількістю речовини 3 моль.
Керована практика
Задача 4
Обчисліть кількість атомів Феруму у ферум(ІІ) сульфіді масою 352 г.
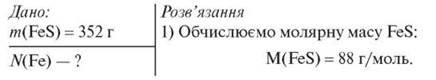
2) За формулою n = m/М обчислюємо кількість речовини FeS:
n(FeS)=352/88=4 моль
3) 3 формули n = N/NA випливає: N = n · NA.
Обчислюємо число молекул FeS:
N(FeS) = 4 моль * 6,02 * 1023 молекул/моль = 24,08 * 1023 молекул.
4) Оскільки молекула FeS складається з одного атома Феруму й одного атома Сульфуру, то
N(Fe) = N(S) = 24,08*1023(атомів).
Відповідь: 24,08 * 1023 атомів.
Задача 5
Обчисліть кількість атомів Оксигену в молекулярному кисні масою 64 г.
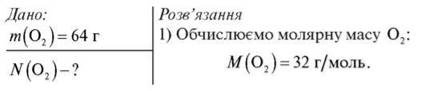
2) За формулою n = m/М обчислюємо кількість речовини O2:
n(O2)=64/32=2 моль
3) 3 формули n = N/NA випливає: N = n* NA.
Обчислюємо число молекул O2:
N(O2) = 2 моль*6,02*1023 молекул/моль=12,04 * 1023 молекул.
4) Оскільки молекула O2 складається з двох атомів Оксигену, то
N(O2) =2* N(O)=2*12,04*1023= 24,08*1023 (атомів).
Відповідь: 24,08*1023 атомів.
V. Узагальнення та систематизація знань Самостійна робота з взаємоперевіркою Обчисліть масу 5 моль: варіант І: натрій хлориду NaCl; варіант II: кальцій оксиду СаО. Після виконання завдання учні обмінюються роботами й перевірять один одного.
VI. Підсумок уроку Рефлексія Матеріал уроку: – засвоїв на достатньому рівні; – нічого не засвоїв; – потрібно ще попрацювати.
VII. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання, виконати вправи. 1. Скільки моль становлять: 5г Кальцію, 0,5 моль води, 10 моль міді?
2.Для реакції потрібно взяти 0,5 моль кремнезему. Яку масу оксиду треба відважити? 3.Дано порцію C6H12O6 масою 30 г. Скільки це буде моль? Скільки там міститься молекул глюкози?


про публікацію авторської розробки
Додати розробку
