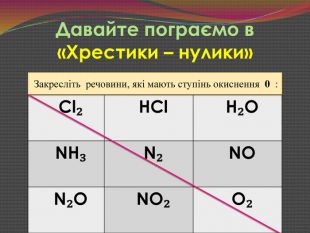
Мультимедійна презентація "Окисно-відновні реакції"
Про матеріал
Мультимедійна презентація на тему "Окисно-відновні реакції" є гарним доповненням для проведення уроку . Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
До підручника
Хімія 9 клас (Березан О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку