Опорні конспекти з теми "Розчини"
Тема: Значення розчинів у природі та житті людини.
Поняття про дисперсні системи, колоїдні та істинні розчини.
![]()
![]()
![]()
![]() Розчини
Розчини
Побут Промисловість Медицина Сільське господарство
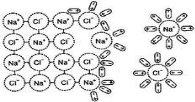
Дисперсні системи - системи, в яких одна речовина у вигляді часточок різних розмірів розподілена в іншій речовині.
Класифікація за агрегатним станом та розміром частинок:
![]()
![]() Дисперсні системи
Дисперсні системи
Гомогенні Гетерогенні
![]()
![]()
![]()
Істинні розчини Колоїдні розчини
(розмір частинок <1нм) (розмір частинок 1-100нм)
- молекулярні - золі
- йонні - гелі
Грубодисперсні (зависі)
(розмір частинок 100-150нм)
- суспензії (глина/вода)
- емульсії (масло/вода)
- аерозолі (рідина/газ)
- піни (газ/рідина)
- пил (тв.речов./газ)
- туман
Істинні розчини – гомогенні (однорідні) системи, що складаються з
молекул розчиненої речовини й розчинника.
В них неможливо розглянути їх окремі компоненти, системи стійкі та зберігаються протягом тривалого часу.
Розчини поділяють на рідкі, тверді, газуваті. Найбільш поширені в природі –рідкі,водні розчини.
Гетерогенні дисперсні системи – нестійкі та з часом розпадаються на
компоненти.
Колоїдні розчини – дисперсні системи, у яких розміри часток досить малі та помітні тільки з допомогою спеціальних приладів. Вони досить стійкі, частки речовини тривалий час не осідають.
Тема: Розчин і його компоненти: розчинник, розчинена речовина.
Вода як розчинник. Будова молекули води, поняття про водневий
зв’язок.
Розчини — однорідні системи, що складаються з двох і більше компонентів і продуктів їх взаємодії. Так, водні розчини складаються з розчинника (води), розчиненої речовини та гідратованих йонів (продуктів взаємодії розчиненої речовини з молекулами води).
- Зазвичай розчинником вважають той компонент, який існує у тому самому агрегатному стані, що й розчин.
- Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник – компонент, маса якого у розчині найбільша.
- Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини.
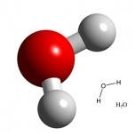
Вода – полярний розчинник.
Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені хімічним складом і будовою молекули.
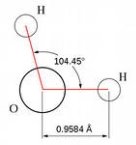
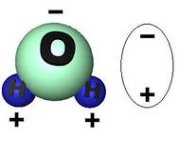
Зв’язки О – Н у молекулі води ковалентні полярні (електронна густина зміщена в бік Оксисену, як більш електронегативного елемента). Вони розміщені під кутом 104,5°; це спричиняє асиметричність структури і виникнення диполя.
Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною.
Асиметричність розподілу електричних зарядів є причиною утворення між ними водневих зв’язків.
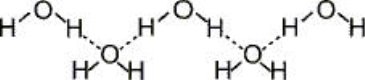
Водневий зв'язок – різновид хімічного зв’язку. Це електростатична взаємодія між молекулами за участю атомів Гідрогену. (Н···О)
Тема: Розчинність, її залежність від різних чинників.
Насичені й ненасичені розчини.
Розчинність — здатність речовини розчинятися у воді або іншому розчиннику.
Кількісно розчинність виражають як відношення маси розчиненої речовини в насиченому розчині до 100 г (або 1 л) води (за даної температури). Ця величина називається коефіцієнтом розчинності, або розчинністю.
Розчинність речовин залежить:
1) від природи розчиненої речовини і розчинника;
2) температури (від збільшення температури розчинність твердих речовин і рідин збільшується, газів — зменшується);
3) тиску (тільки для газів).
Утворення розчину – фізико-хімічний процес.
Розчини класифікують як насичені й ненасичені, концентровані та розбавлені.
Насичений – розчин, в якому за даної температури речовина більше не розчиняється.
Ненасичений – розчин, в якому речовина ще може розчинятись.

![]()
 За розчинністю у воді всі речовини можна поділити на:
За розчинністю у воді всі речовини можна поділити на:
Р М Н
Р - добре розчинні — в 100 г води за кімнатної температури розчиняється больше 10 г речовини;
М - малорозчинні — в 100 г води за кімнатної температури розчиняється меньше 1 г речовини;
Н - практично нерозчинні — в 100 г води за кімнатної температури розчиняється меньше 0,1 г речовини.
(Абсолютно нерозчинних речовин не існує).


про публікацію авторської розробки
Додати розробку
