органічна хімія. Урок
Тема уроку: Білки як високомолекулярні сполуки. Рівні структурної організації білків. Властивості білків: гідроліз, денатурація, кольорові реакції.
Мета уроку: вивчити рівні структурної організації білків, їх властивості; значення білків для живих організмів; формувати в учнів поняття про сучасний рівень вивчення білків як природних полімерів;
розвивати критичне мислення, навички навчально-дослідної діяльності, вміння слухати і вступати в діалог, брати участь в колективному обговоренні проблем, аналізувати, порівнювати, узагальнювати, робити висновки, оволодіння навичками співпраці, що вимагає спільної роботи в групах, формувати комунікативну компетенцію учнів;
виховувати бережне ставлення до живого, усвідомлене, шанобливе і доброзичливе ставлення до іншої людини та його думки.
Унаочнення: кроссенси, картки-завдання, ,штатив, пробірки, реактиви: розчиниCuSO4,NaOH,HNO3, білок курячий, спиртівка, пальне, сірники, пробіркотримач.
Очікувані результати: учні знають склад білків, методи їх визначення , функції; вміють співвідносити їх з будовою; розуміють рівні організації білків, типи зв’язків, що забезпечують їх структуру, аналізують причини денатурації
Методи навчання : інформаційно – рецептивний, бесіда, пояснення, розповідь, кроссенс.
Тип уроку: урок вивчення нового матеріалу
Хід уроку
I.Організаційний етап. Доброго дня шановні учні та гості. «Шлях до розвитку й, урешті решт, до щастя людини пролягає через її працю» - це слова Д.І.Менделеєва. Працею вчений називав не будь яку роботу, а роботу усвідомлену, потрібну людям. Я бажаю вам лише успішної роботи і пропоную іі розпочати
ІІ. Актуалізація опорних знань
Евристична бесіда:
1. До якого типу сполук належать амінокислоти?
Нітрогеновмісні органічні сполуки
2. Що таке амінокислота?
Це складна органічна сполука до складу молекули якої входить аміногрупа та карбоксильна група.
3. Які властивості проявляють амінокислоти? Чому? До якого класу сполук їх відносять? Амінокислоти проявляють амфотерні властивості, тому їх відносять до амфотерних сполук. Аміногрупа - основні властивості
Карбоксильна - кислотні властивості.
Амінокислоти проявляють такі самі властивості як і карбонові кислоти, а також взаємодіють з кислотами, лугами, та між собою.
4. Яка амінокислота є найпростішим представником амінокислот?
Амінооцтова кислота або її інша назва гліцин. (Учні роблять запис на дошці молекулярної, структурної та електронної формули сполуки)
5. Як називається зв'язок, який утворюється в результаті реакції амінокислот між собою?
Пептидний або амідний. (Учень записує на дошці взаємодію амінооцтової кислоти з амінооцтовою кислотою і коментує принципи утворення пептидного зв'язку.
Отож, можна констатувати, що ви маєте добрі знання про амінокислоти, що є добрим підґрунтям для вивчення теми сьогоднішнього уроку.
Проте, як говорив великий учений-астроном П’єр Симон Лаплас: «Те, що ми знаємо – обмежене, а те, чого ми не знаємо – нескінченне». Тому наші знання про нітрогеновмісні органічні сполуки ми будемо доповнювати, вивчаючи білки.
ІІІ. Мотивація навчальної діяльності
Що таке життя ? Звідки воно взялася на Землі? Ці питання хвилюють людей завжди . Жодне природне явище не викликало такої гострої боротьби світоглядів , як проблема виникнення живих організмів . А причина цієї боротьби - в самому об'єкті пізнання , його унікальності, неповторності та складності . Поступово було накопичено достатньо експериментального матеріалу , щоб дати таке визначення життя:
" Життя є спосіб існування білкових тіл , істотним моментом якого є постійний обмін речовин з навколишнім їх зовнішньою природою , причому з припиненням цього обміну речовин припиняється і саме життя , що призводить до розкладання білка " . ( Ф.Енгельс ) .
Як ви думаєте: «Яйце живе?
Символом початку життя завжди було яйце. Якщо помістити його у відповідні умови, то через певний проміжок часу яйце перетвориться на курчатко, яке буде мати всі ознаки живого організму: воно буде рухатися, розвиватися, харчуватися... Отже, десь у серединці яйця заховане життя. Білки – це основа життя. З усіх органічних речовин білки займають особливе місце – входять до складу живих організмів: рослин, тварин, людей. Наше волосся, шкіра, нігті, кров, м’язи, кожна клітинка нашого організму складається з білків. Ми з вами – це розумний білок, який вміє думати, ходити, сумувати і радіти, співчувати і допомагати. З участю білків у людському організмі відбуваються тисячі хімічних реакцій. Білки регулюють всі найважливіші життєво необхідні функції нашого організму.
Але чи завжди на планеті існували органічні речовини. Звичайно , ні. Існує теорія абіогенного синтезу органічних речовин , згідно з якою органічні речовини синтезувалися з неорганічних . Давайте здійснимо перетворення речовин , починаючи від неорганічних і закінчуючи амінокислотами , тими цеглинками життя , з яких будуються білки. Учням пропонується здійснити ряд перетворень за схемою:
Кальцію карбонат → кальцію карбід → етин → етаналь → етанова кислота→ амінооцтова кислота ( аланін ) →дипептид .
Білки —це органічні сполуки. Визначена різними методами молекулярна маса може коливатися від кількох тисяч до 10 і більше мільйонів (наприклад, у вірусів сказу, віспи).
ІІІ. Вивчення нового матеріалу.
Білки —це органічні сполуки. Визначена різними методами молекулярна маса може коливатися від кількох тисяч до 10 і більше мільйонів (наприклад, у вірусів сказу, віспи).
Тож тема нашого уроку «Білки як високомолекулярні сполуки. ».
Чотири елементи
Зливаються в одне,
Дають життя і творять світ.
Хімічний склад
Елементарний склад: Амінокислоти
Грен, 1809 р. Браконно, 1820 р
- C – 55 -60%
- глікокол(гідроліз желатину) 19-24%
- N – 15- 18%
- H – 6-8%
- S – 0.4-2%
- Деякі метали
Білки складаються з 20 амінокислот. З них 10-незамінних; тих, що не синтезуються в організмі, а повинні надходити з їжею. Думку про те, що АК є цеглинками, з яких побудовані білки , вперше висловив український біохімік Іван Якович Горбачевський. Автором поліпептидної теорії будови білків є німецький хімік Еміль Фішер, лауреат Нобелівської премії 1902 року. Заміна хоча б однієї АК в полімерному ланцюзі білка має серйозні наслідки для його функціонування в організмі. На відміну від природних полімерів крохмалю або целюлози, в білку не можна виділити мономерну ланку, оскільки послідовність АК у кожного білка своя.
За складом білки поділяють на
• протеїни – складаються тільки з білків
• протеїди – білок + небілкова частина:
а. глікопротеїди – амінокислоти + вуглеводи
б. ліпопротеїди – амінокислоти + жири
в. нуклеопротеиды – амінокислоти + нуклеїнова кислота
г. металлопротеиды – амінокислоти + метали (гемоглобін)
4. За формою молекул розрізняють білки
фібрилярні (нитчасті) і глобулярні (кулясті). До першої групи належать білки волосся, вовни, мускульної тканини, до другої — більшість білків рослинних і тваринних організмів.
Білкові молекули можуть бути короткими і довгими, наприклад:
• Інсулін - гормон підшлункової залози, складається з двох ланцюгів: в одній 21, а в іншій 30 амінокислотних залишків.
• Колаген - складається з трьох поліпептидних ланцюгів, кожен з яких містить близько 1000 амінокислотних залишків.
Допоможіть мені сформулювати визначення поняття «білок».
Білки – це
- низькомолекулярні з'єднання або високомолекулярні? (високомолекулярні)
- чи можемо ми назвати білок біополімером? (так)
- аргументуйте свою думку (біополімери – це великі органічні молекули, що складаються з мономерів)
- що є мономером білкової молекули? (амінокислоти)
- скільки видів амінокислот може входити до складу білкової молекули? (20)
- білок належить до гомополімерів чи гетерополімерів? Аргументуйте свою думку. (до гетерополімерів, бо до складу білків в якості мономерів входять 20 амінокислот).
Білок це високомолекулярний нерегулярний біополімер, мономерами якого є амінокислоти.
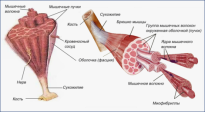
Молекули білків мають складну просторову структуру.
Лінійна послідовність амінокислот у складі поліпептидного ланцюга представляє первинну структуру білка. Вона унікальна для будь-якого білка і визначає його форму, властивості і функції.
Вторинна структура білків являє собою альфа -спіраль або бета-складку. Витки спіралі або ребра гармошки утримуються водневими зв'язками між групами —СООН і —NН2— . Хоча водневі зв'язки малостійкі, але завдяки їх значної кількості у комплексі вони забезпечують досить міцну структуру.
Третинна структура являє собою конфігурацію, що має вигляд глобули або нитки (глобулярні та фібриллярні білки). Фібриллярні білки-кератин, міофібрин, фібриноген, що входять до складу волосся, нігтів, м’язів, крові. Казеїн, гемоглобін-глобулярні білки. Міцність третинної структури забезпечується йонними, водневими і дисульфідними (—S—S—) зв'язками між залишками цистеїну, а також гідрофобною взаємодією.
Четвертинна структура характерна не для всіх білків. Вона виникає в результаті з'єднання декількох глобул у складний комплекс. Наприклад, гемоглобін крові людини є комплекс із чотирьох таких субодиниць, інсулін – з двох, бета-кератин(волосся)-схожий на кількажильний кабель.
Властивості білків.
1.Денатурація-втрата структури та функцій
Інтерактивна вправа.
( Учні будують структуру з однакової кількості намистин ) .
Чи однакова послідовність намистин у всіх ваших моделях ? Про що це говорить? Про різноманіття білкових молекул. В організмі зустрічається 20 амінокислот, з них може бути утворено 2 432 902 008 176 640 000 комбінацій, тому на планеті немає двох організмів з однаковим набором білка.
Побудуйте вторинну і третинну структуру білка.
Що необхідно зробити для побудови четвертинної структури? Необхідно об'єднати кілька глобул.
(Учитель тримає в руках шматочок пластиліну , а діти прикріплюють до нього побудовані ними глобули )
А зараз візьміть кожен свої глобули і сідайте на свої місця. Що сталося з нашою білкової молекулою? Вона розпалася. Як називається процесс руйнування вторинної і третинної структури білка? ( Денатурація ) . Змоделюйте процес подальшої денатурації білка. Чи зустрічалися ви з процесом денатурації у своєму житті?
Вчитель показує розчин яєчного білка і варений яєчний білок. Порівняйте ці стани білка. Чому з'явилися ці відмінності? Під дією високої температури сталася денатурація . Чи можна повернути білок в початковий стан ? Які ще чинники можуть викликати денатурацію білка ?
Солі важких металів. Якщо вони потрапляють в організм людини , то вони можуть викликати важке отруєння . Чому на хімічних виробництвах , особливо пов'язаних з важкими металами , людям дають молоко?
Причинами денатурації можуть бути висока температура, ультрафіолетове випромінювання, дія сильних кислот і лугів, важких металів і органічних розчинників.
Денатурація може бути оборотною і необоротною. Іноді, якщо вплив денатуруючих факторів виявився не надто сильним і руйнування первинної структури молекули не сталося, при настанні сприятливих умов денатурований білок може знову відновити свою тривимірну форму. Цей процес називається ренатурацією
Фізкультпауза.
Намалюйте носом цифру, що відповідає кількості атомів С в складі глюкози. Скільки атомів в молекулі води, стільки рухів головою вправо- вліво.
Витягніть руки вперед. Скільки атомів карбону в молекулі целюлози, стільки раз зігніть та розігніть пальці рук.
Руки на пояс. Скільки атомів С в молекулі крохмалю, стільки раз нахиліться вправо-вліво.
Лабораторний дослід Кольорові реакції білків
Біуретова реакція – отримати Cu(OH)2 з CuSO4 та NaOH. Додати курячий білок. Наявність синьо-фіолетового забарвлення вказує на наявність пептидних зв’язків.
Ксантопротеїнова реакція - додавання до розчину білка концентрованої нітратної кислоти при нагріванні дає жовте забарвлення при наявності ароматичних кілець в молекулах амінокислот.
Функції білків
Використовуючи знання з біології, назвіть функції білків.
|
Функція |
Сутність |
|
Будівельна, харчова |
Кератин |
|
Регуляторна |
Гормони беруть участь у регуляції всіх систем організму і є білками (інсулін, соматотропін, пролактин, паратгормон, АКТГ) |
|
Захисна |
1. При попаданні в організм чужорідних білків і мікроорганізмів в лейкоцитах утворюються захисні білки антитіла. 2. Захист від втрати крові при пораненні в результаті згортання- фібриноген, протромбін. |
|
Транспортна |
Гемоглобін |
|
Рухова |
Здійснення всіх типів руху ( актин, міозин(міоглобін)) |
|
Запасна |
Резерв для організма, плода(альбумін,міоглобін) |
|
Токсическая |
Отрути |
|
Енергетична |
1г. білка 17,6 кДж. Не основне, але джерело енергії в клітині |
|
Каталітична (ферментативна)
|
Каталітичне прискорення біохімічних реакцій в клітині (пепсин, каталаза) |
Первинне застосування знань.
-Чому при тепловій обробці м΄яса і риби відбувається зменшення маси готового продукту?
( Під дією температури відбувається зміна вторинної, третинної і четвертинної структури білкової молекули ( денатурація). Первинна структура , а отже, і хімічний склад білка не змінюється. При денатурації білки втрачають вологу (руйнуються водневі зв’язки), що призводить до зменшення маси готового продукту.)
-Що є причиною утворення піни на поверхні м΄ясних бульйонів, смажених м΄ясних і рибних виробів?
(Це пояснюється зсіданням розчинених у воді білків -альбуміну, глобуліну)
-Навіщо маринують м'ясо до шашлику?
(Під впливом етанової або лимонної кислоти відбувається частковий гідроліз білків. Білки розпадаються на поліпептиди та дипептиди. У шлунку під впливом ферментів цей процес продовжується і в результаті утворюються амінокислоти. Таким чином, маринування полегшує переварювання білка)
-Чим відрізняється сире молоко від пастеризованого? Чому при кип΄ятінні молоко збігає?
( Сире молоко містить ферменти фосфатазу і пероксидазу, а пастеризоване – ні. При нагріванні ферменти руйнуються. Нагрівання молока призводить до коагуляції білка лактоальбуміну, який при випаровуванні води утворює на поверхні молока плівку, що зазвичай називають пінкою. Під пінкою молока може створюватися невеликий надлишковий тиск, якого цілком достатньо для того, щоб при закипанні молоко «збігло».)
На чому базується використання спирту як дезинфікуючого засобу?( викликає денатурацію білків бактерій).
Розвязання кроссенсів по групах. Слово «кроссенс» означає «перетин смислів». Даний метод вперше був опублікований в 2002 році в журналі «Наука і життя». -якому випадку це відмінна вправа для розвитку логічного та творчого мислення.
Читати кроссенс потрібно зверху вниз і зліва направо , далі рухатися тільки вперед і закінчувати на центральному 5 квадраті. Почати можна як першої, так і з будь-якої картинки. Центральним є квадрат з номером 5. За бажанням автора, він може бути пов'язаний за змістом з усіма зображеннями в кроссенсі. Звичайно ж потрібно встановити зв'язки по периметру між квадратами 1-2, 2-3, 3-6, 6-9, 9-8, 8-7, 7-4, 4-1, а також по центральному хресту між квадратами 2-5, 6-5, 8-5 і 4-5.
|
|
|
|
|
|
|
|
|
|
|
|
Обговорення:
|
При нестачі білка в їжі спостерігається захворювання анорексія. |
До складу м’язів входять білки актин та міозин |
Скорочення актину та міозину забезпечує рух(рухова функція білків) |
|
За допомогою методів біотехнології можна вирощувати штучні органи або отримувати синтетичні полімери, з яких виготовляють, наприклад, серцевий клапан. |
на малюнку зображені продукти, що містять білок. |
Білки можуть виконувати й каталітичну функцію. Біодобавки до прального порошку-це добавки білкового походження. |
|
первинна структура білка-це ланцюг з залишків амінокислот. Це біополімер. |
При денатурації відбувається розрив зв’язків і руйнується четвертинна, третинна та вторинна структури білка. А первинна залишається. |
При нагріванні відбувається денатурація білка. Тому порошками з біодобавками не можна прати в горячій воді. |
Виконання самостійної роботи
Технологічна карта учня
Тема уроку:_____________________________
I варіант.
1. Вкажіть назву білка, що виконує захисну функцію: а) гемоглобін, б) оксидаза, в) антитіла.
2. Білки – це...: а) полісахариди, б) поліпептиди, в) полінуклеотиди.
3. Первинна структура білка підтримується за рахунок зв'язків: а) йонних, б) пептидних, в) водневих.
4. Гідроліз білка використовується для: а) отримання амінокислот, б) якісного виявлення білка, в) зруйнування третинної структури.
5. Амінокислоти, необхідні для побудови білків, потрапляють в організм: а) з водою, б) з їжею, в) з повітрям.
6. Спираючись на знання властивостей білків, поясніть, чому посуд з-під молочних виробів слід мити спершу холодною водою, а потім гарячою, а не навпаки?
II варіант.
1. Вкажіть назву білка, що виконує ферментативну функцію: а) гемоглобін, б) оксидаза, в) антитіла.
2. Біологічні властивості білка визначає структура: а) третинна, б) вторинна; в) первинна.
3. Вторинна структура білка підтримується за рахунок зв'язків: а) йонних, б) пептидних, в) водневих.
4. Білки піддаються реакціям: а) денатурації, б) полімеризації, в) поліконденсації.
5. Який з процесів найбільш складний: а) мікробіологічний синтез, б) органічний синтез, в) переробка рослинного білка.
6. Чому білкову їжу не можна на тривалий час замінити їжею, що містить лише жири й вуглеводи?
Робота з текстом «Білки»
Вставити в текст пропущені терміни і слова.
1). До складу білка входять наступні елементи___,___,____,___,____. 2).Білки–____________ полімери, мономерами яких є ______________. 3).До складу природних білків входять ______ амінокислот, ___ з них незамінні, тобто не синтезуються в організмі і їх надходження в організм обов'язково разом з їжею. 4). Денатурація – процес зміни структури білка під впливом навколишнього середовища, при цьому білок ________ свої функції. 5. Денатурація може бути оборотною, якщо зберігається ____________ структура білка (зворотний процес називається _____) і незворотною, якщо ___________ структура __________.
При залишку часу-взаємоперевірка.
Підсумки уроку.
Підбиваючи підсумок уроку, ще раз повторюємо, що поняття «життя» і «білок» нерозривно пов'язані. Щоб відповісти на питання «Що таке життя?», потрібно знати, що таке білки. Наскільки різноманітні білки, настільки складне, загадкове і багатолике саме життя. Слова Гете – тому підтвердження: «Я завжди говорив і не втомлююся повторювати, що світ не міг би існувати, якщо б був так просто влаштований».
Домашнє завдання. Вивчити конспект, підготувати кроссенс.
Тема уроку : Білки як високомолекулярні сполуки
Підготувала викладач хімії:
Гал О.В.

про публікацію авторської розробки
Додати розробку