Основи. Склад та назви
Про матеріал
Тема. ОСНОВИ.
Мета:
1. вивчити поняння основи ,як клас неорганічних сполук, вміти давати назви, розрізняти за складом
2. вміти порівнювати луги і нерозчинні основи за фізичними властивостями.
3. ознайомити учнів з використанням основ у побуті
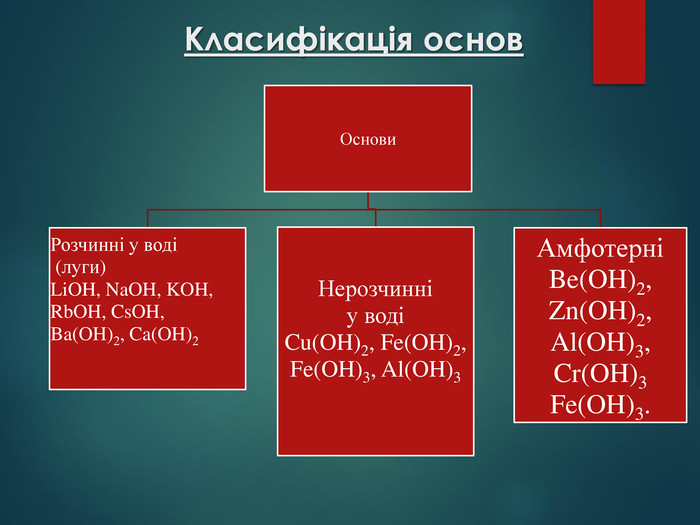
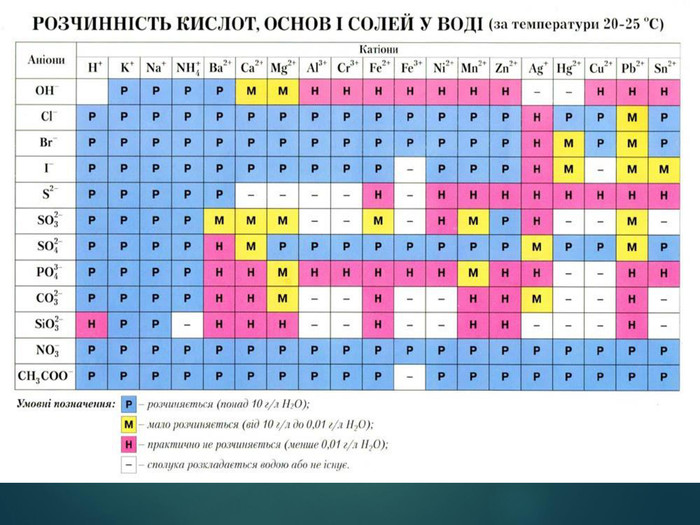
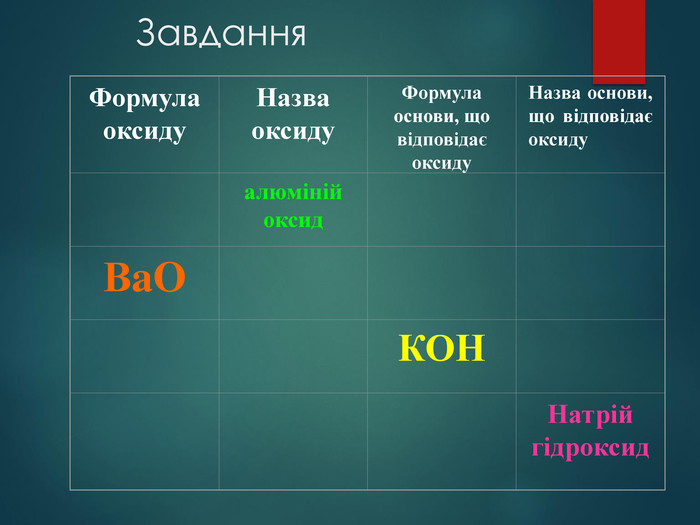
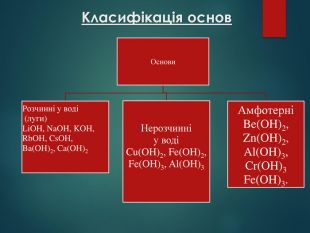
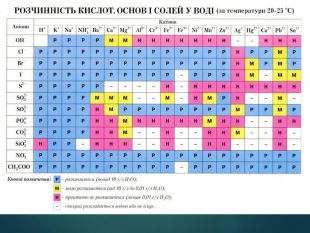
Основи — складні речовини, що складаються з атомів металів, з’єднаних з однією або кількома гідроксильними групами. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку