Презентація Характеристика хімічних елементів за положенням у періодичній системі
Про матеріал
Даний матеріал відповідає програмі для загальноосвітніх закладів та підручнику Хімія 8 клас, автор: О.В. Григорович, 2021.
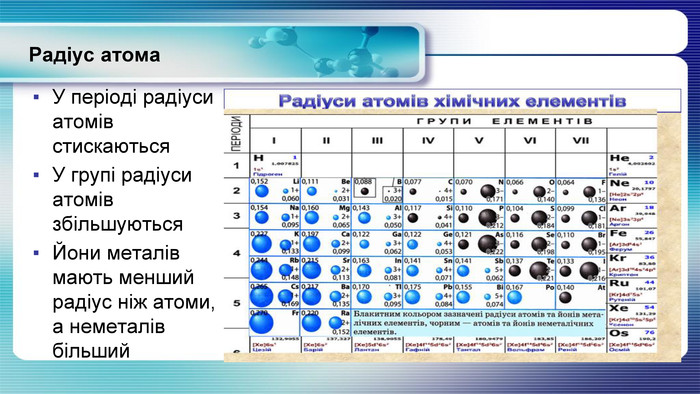
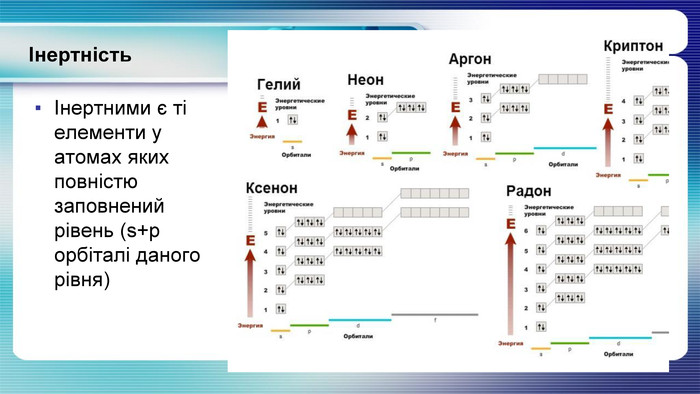
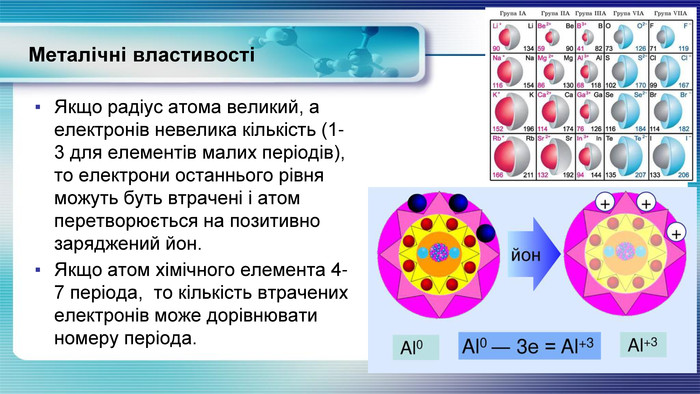
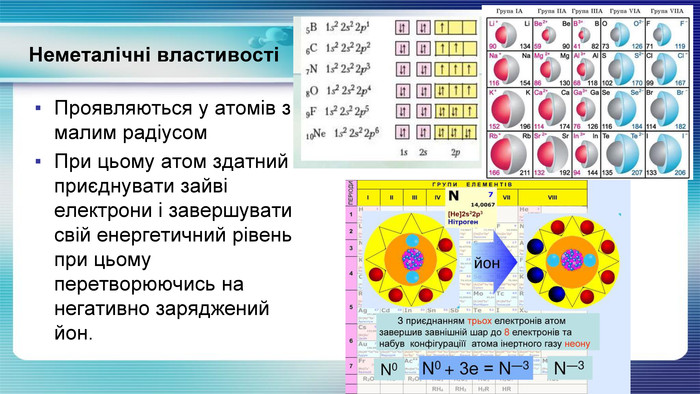
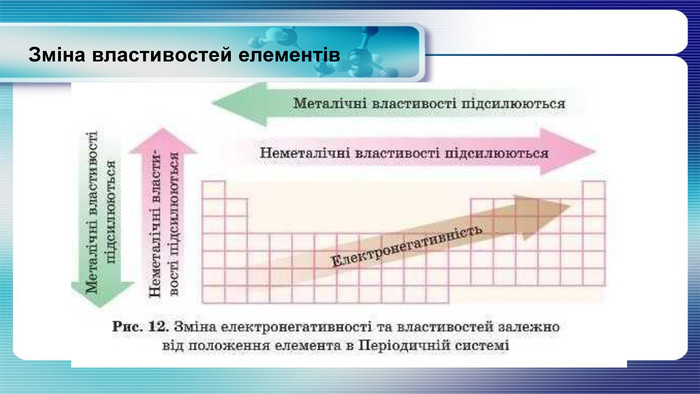
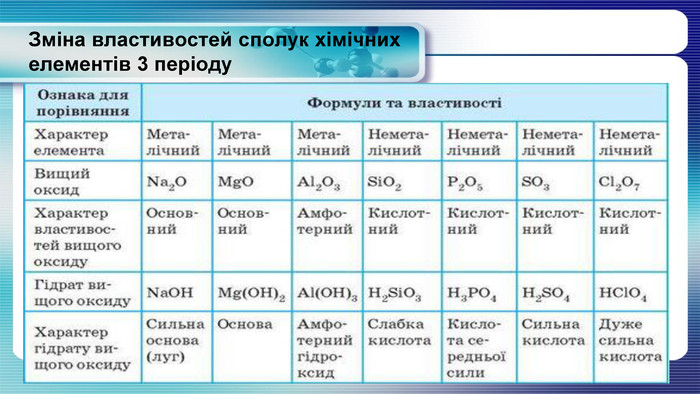
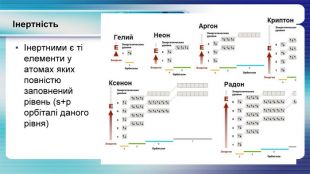
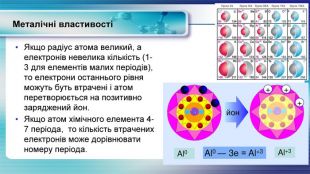
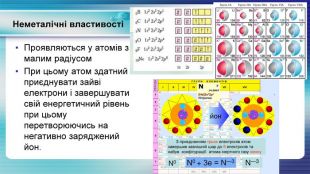
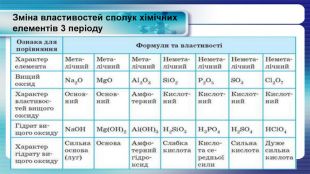
У презентації показана залежність властивостей атомів хімічних елементів та утворених ними сполук від положення у періодичній системі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку