Основні класів неорганічних сполук. 8 клас Урок № 1Тема.. Оксиди: поняття, склад і назви. Фізичні властивості. Класифікація оксидів.
Тема.. Оксиди: поняття, склад і назви. Фізичні властивості. Класифікація оксидів.
Мета уроку:
-сформувати уявлення про загальну класифікацію неорганічних речовин;
-уточнити відомості про склад оксидів та їх класифікацію;
-ознайомити із сучасною науковою українською номенклатурою оксидів;
-формувати навички використання номенклатури на прикладі назв оксидів;
-закріпити навички складання формул оксидів;
- розглянути поширення оксидів у природі, навести приклади використання оксидів.
Основні класів неорганічних сполук. 8 клас
Урок № 1
Тема.. Оксиди: поняття, склад і назви. Фізичні властивості. Класифікація оксидів.
Мета уроку:
- сформувати уявлення про загальну класифікацію неорганічних речовин;
- уточнити відомості про склад оксидів та їх класифікацію;
- ознайомити із сучасною науковою українською номенклатурою оксидів;
- формувати навички використання номенклатури на прикладі назв оксидів;
- закріпити навички складання формул оксидів;
- розглянути поширення оксидів у природі, навести приклади використання оксидів.
Базові поняття та терміни: складні та прості речовини, оксиди, бінарні сполуки, валентність,фізичні властивості.
Тип уроку: вивчення нового матеріалу.
Методи навчання: пояснювально-ілюстративні – бесіда, розповідь; наочні – демонстрації; практичні – виконання вправ; інтерактивні – репродуктивні; частково-пошукові, творчі.
Матеріали: зразки оксидів як демонстраційний матеріал, ілюстрації.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва
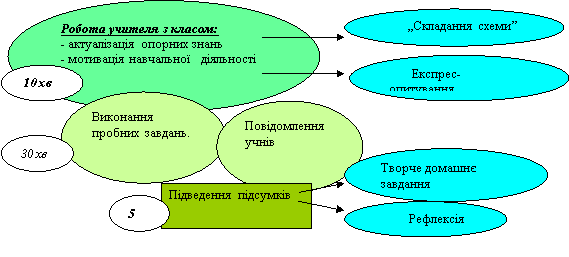
Хід уроку
І. Організаційний етап
ІІ. Актуалізація опорних знань
Проводиться бесіда щодо класифікації речовин, формуються поняття «прості речовини», «складні речовини», складається схема.
![]()
![]()
![]()
![]()
![]()
![]()




![]()

- Експрес-опитування..
Учні заповнюють таблицю за ланцюжком, склавши формули сполук поданих елементів з Оксигеном. ( Завдання виконується швидко, учні записують по одній формулі. Назви сполук не вказуються).
|
Валентність |
Хімічний символ елемента |
Назва елемента |
Формула сполуки з Оксигеном |
Назва сполуки |
|
ІІ |
Ca |
|
|
|
|
І |
H |
|
|
|
|
ІІІ |
Al |
|
|
|
|
ІІ |
Cu |
|
|
|
|
V |
P |
|
|
|
|
ІІІ |
Cr |
|
|
|
|
І |
H |
|
|
|
|
І |
Na |
|
|
|
|
ІІ |
Fe |
|
|
|
|
І |
K |
|
|
|
|
ІІ |
Mg |
|
|
|
|
ІV |
S |
|
|
|
|
ІV |
C |
|
|
|
Учитель. Діти, скажіть, будь ласка, у чому особливість усіх формул, записаних вами?
Так, усі вони містять Оксиген. Сьогодні ми будемо вивчати сполуки з Оксигеном, назва яких – Оксиди.
Девіз уроку:
Оксиди – це такі чарівні речовини,
Потрібні в хімії, і для людини,
Вони з Оксигеном дружать завжди,
Без нього вони нікуди!
У цьому ми переконаємось протягом уроку.
ІІІ. Вивчення нового матеріалу.
- Склад та назви оксидів.
Оксиди відносяться до бінарних сполук.
Оксиди – це складні речовини, до складу яких входять два елементи, один з яких Оксиген.
Загальна формула оксидів ЕхОу, де Е – елемент, х та у – індекси.
В залежності від валентності хімічного елемента, що утворює оксид, склад оксидів може бути різноманітним. Існують оксиди з формулами: Е2О, ЕО, Е2О3, ЕО2, Е2О5, ЕО3, Е2О7, ЕО4,де літерою Е позначено будь-який хімічний елемент. Символ елемента Оксигену завжди записується на другому місці.
Кожна хімічна сполука має мати свою власну назву. Для того, щоб хіміки з різних міст і країн розуміли одне одного, назви речовин складаються за певними правилами (правила хімічної номенклатури). Назви оксидам також дають за цими правилами. Назви оксидів складаються з двох слів: перше – назва хімічного елемента, що утворює оксид, у називному відмінку, а друге – слово «оксид».
Якщо елемент виявляє постійну валентність, то в назві оксиду його валентність не вказується:
Na2O – натрій оксид;
MgO – магній оксид;
Al2O3 – алюміній оксид.
Якщо елемент може виявляти різні валентності, а отже і утворювати декілька
оксидів, то в назві оксиду після назви елемента вказують значення його валентності римською цифрою в дужках:
CO – карбон (ІІ) оксид;
CO2 – карбон (ІV) оксид;
SO2 – сульфур (ІV) оксид;
SO3 – сульфур (VІ) оксид.
Назви оксидів неметалічних елементів іноді складають без вказівки валентності, а тільки вказуючи число атомів Оксигену в молекулі грецькими числівниками (моно, ди, три тощо). Наприклад, NO – нітроген монооксид, CO2 - карбон диоксид, SO3 – сульфур триоксид. Іноді співвідношення атомів не є цілими числами, в цьому випадку ще використовують приставку «гемі», що означає «половина». Так, N2O – нітроген геміоксид (у даному випадку мається на увазі, що на один атом Нітрогену припадає половина атома Оксигену), N2O5 – нітроген геміпентаоксид (на один атом Нітрогену припадає «половина від п`яти», тобто два з половиною атоми Оксигену).
Виконання пробних завдань.
Записати назви оксидів в таблиці.
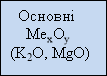
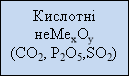
Розподіл оксидів ми розглянемо з допомогою опорної схеми:
![]()
![]()

![]()
![]()
![]()
![]()
![]()

Основні оксиди утворені металами з валентністю І та ІІ. Кислотні оксиди утворені неметалами та деякими металами з валентністю > ІV. Амфотерні оксиди утворені металами, які знаходяться в періодичній системі хімічних елементів поблизу діагоналі
«В – Аt».
- Фізичні властивості оксидів.
- Робота з підручником.
Учні знайомляться з фізичними властивостями деяких оксидів, після читання організується обговорення матеріалу. Звертається увага учнів на відмінність у фізичних властивостях оксидів молекулярної та немолекулярної будови.
- Демонстрація. Зразки оксидів.
Учитель демонструє зразки оксидів.
- Поширеність оксидів у природі та їх використання.
Заслуховуються повідомлення учнів.
Учень 1. Оксиди є досить поширеними у природі сполуками. В природі існує близько трьохсот оксидів. Вони зустрічаються у всіх трьох оболонках нашої планети: атмосфері, літосфері та гідросфері.
У повітрі поряд з киснем та азотом містяться суттєві кількості оксидів. Гідроген оксид – вода – завжди присутня у повітрі в газуватому стані, з`являється завдяки випаровуванню води з різноманітних водоймищ та після дощів. Вода в повітрі обумовлює
вологість повітря, і коли її кількість велика для даної температури, газувата вода
перетворюється на рідку і випадає у вигляді роси або дощу. Карбон диоксид – вуглекислий газ – виділяється в атмосферу в результаті дихання тварин і рослин, вулканічної діяльності та діяльності людини, зокрема при згорянні різних видів палива. Його частка в повітрі приблизно становить 0,04 %. Карбон диоксид рослини використовують для фотосинтезу. Вода та вуглекислий газ – основні парникові гази, що обумовлюють парниковий ефект, завдяки якому наша Земля не охолоджується до критично низьких температур. Ще в меншій кількості в повітрі містяться нітроген диоксид і сульфур диоксид. Вони виділяються завдяки виверженням вулканів і технологічній діяльності людини. Нітроген диоксид N2O – газ бурого кольору, отруйний. Його ще називають «лисячий хвіст» завдяки забарвленню. Часто він додає кольору диму, що виділяється з труб на металургійному виробництві. Ці оксиди обумовлюють кислотні дощі.
Переважна частка нашої гідросфери – це рідка вода, тобто також оксид. З інших оксидів в ній містяться невеликі кількості розчинених оксидів, що є в повітрі.
Учень 2. Найбільше число оксидів перебуває в літосфері – верхньому твердому шарі Землі. Різні типи грунтів, порід та мінералів складаються з різних оксидів. Найбільш поширеними є Al2O3, SiO2, ферум (ІІІ) оксид Fe2O3.
Силіцій диоксид SiO2 – безбарвні нерозчинні у воді кристали. Його ще називають кремнеземом завдяки тому, що він є основною складовою піску і багатьох різновидів ґрунтів. Пісок разом з багатьма іншими оксидами є цінним будівельним матеріалом. Силіцій диоксид є основою багатьох мінералів, зокрема, кварцу, гірського кришталю, хризоліту, аметисту, сердоліку тощо. Кварц і кварцовий пісок є сировиною для виробництва скла.
Алюміній оксид Al2O3 – безбарвні нерозчинні у воді кристали. Алюміній оксид складає основу багатьох мінералів, зокрема сапфіру, рубіну, хризоберилу. Колір цих мінералів обумовлюють невеликі домішки інших речовин. Алюміній оксид утворює дуже твердий мінерал корунд, що використовується як абразивний матеріал для обробки металевих керамічних та інших поверхонь. Крім того, алюміній оксид разом із силіцій оксидом є складовою багатьох ґрунтів і порід, зокрема бокситу, з якого добувають алюміній.
Ферум (ІІІ) оксид Fe2O3 – нерозчинна у воді речовина рудого кольору. Він надає характерний колір іржі, піску і деяким ґрунтам. На його основі виготовляють фарби: натуральну охру (жовтого кольору), красну охру та сиєну (коричневого кольору). Також на основі цього оксиду виготовляють різні магнітні матеріали – феромагнітні покриття аудіо- та відеоплівок і пластин жорстких магнітних дисків (вінчестерів). Ферум (ІІІ) оксид утворює багато мінералів, зокрема гематит, лімоніт, магнетит тощо, з яких добувають залізо, а також використовують як виробний камінь. З оксидів металів добувають метали.
Фізкультхвилинка
Мы уроки изучали и немножечко устали
Нужно пальчики размять, нужно руки вверх поднять.
Повернуться и друг – другу улыбнуться.
Хлопнуть, топнуть, потянуться,
Развернуться, сделать вдох
Сесть и снова за урок.
ІV. Закріплення та узагальнення знань
Завдання.
- Складіть формули оксидів за назвами та підкресліть оксиди неметалів: калій оксид, кальцій оксид, фосфор (ІV) оксид, ферум (ІІІ) оксид, сульфур (ІV) оксид, хлор (VІІ) оксид.
- Складіть рівняння реакцій сполучення між простими речовинами, під час яких утворюються оксиди СО2, Р2О5, Al2O3, Na2O, , MgO.
- У якому з оксидів Феруму – ферум (ІІІ) оксиді чи ферум (ІІ) оксиді масова частка оксисену більше?
V. Домашнє завдання
Опрацювати § 5. Виконати вправи: дост. рівень - №45-46 ст. 33, вис. рівень № 51ст. 33.
Творче завдання. Скласти формули оксидів елементів 3 періоду з вищою валентністю, дати назви, зазначити тип.
Рефлексія. Чи знадобляться вам у житті знання, які ви отримали сьогодні на уроці.


про публікацію авторської розробки
Додати розробку
