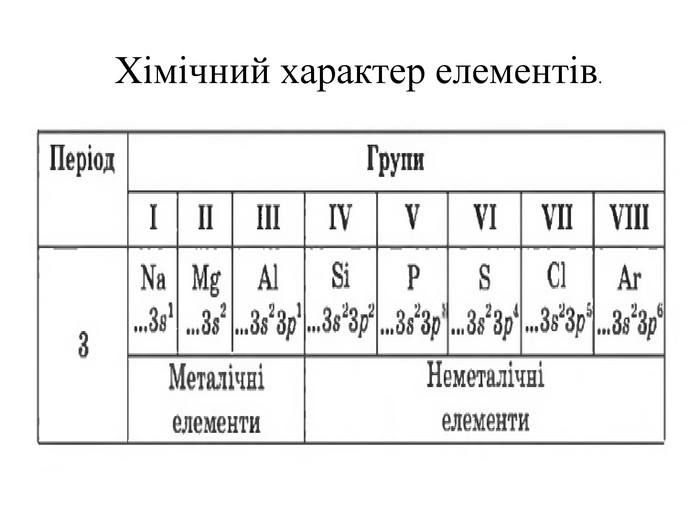
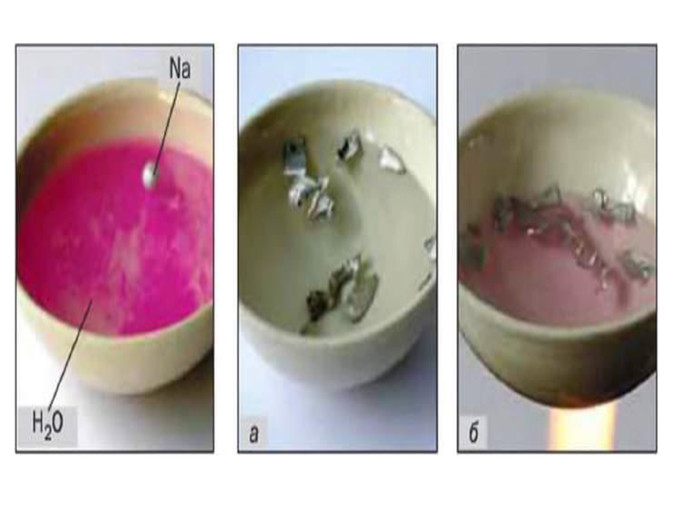
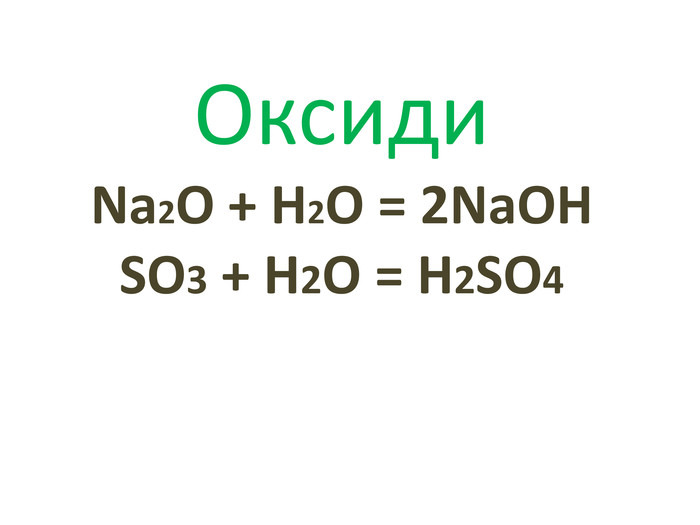
Періодична система, хімічний характер елементів і властивості простих речовин.
Про матеріал
Періодична система,
хімічний характер елементів
і властивості простих
речовин.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку