8 клас Підготовка та варіанти завдань до написання підсумкової контрольної роботи. Дистанційна допомога.
Дана презентація охоплює важливі теми неорганічної хімії за курс 8 класу. Зокрема, генетичний зв'язок між класами неорганічних сполук та розв'язування розрахункових задач за рівняннями хімічних реакцій. Завдання різної складності полегшують підготовку до підсумкової контрольної роботи ( є зразки оформлення завдань , так і варіанти для кожного учня.
Презентація стане в нагоді вчителю та учням для самоперевірки набутих знань.






![Завдання 1 (продовження )75) Cr. Cl3 76) NH4 NO3 77) Na2 Si. O3 78) K[Al(OH)4] 79) Н2 О 80) H3 PO4 81) Ca(H2 PO4)2 82) SO2 83) Cu(NO3)2 84) Mg(HS)2 85)K2 SO3 86) H2 SO4 87) КСІО3 88) Al(OН)3 89)Na. НSO4 90) КСІО4 91)KCl 92) KНSO3 93) Na[Al(OH)4] 94) Ag2 O 95) KMn. O4 96) SO3 97) Mg(OН)2 98) HІO3 99) N2 O 100) Ag. OН 101) Mg. S 102) CO 103) Ва(HS)2 104) КH2 PO4 Завдання 1 (продовження )75) Cr. Cl3 76) NH4 NO3 77) Na2 Si. O3 78) K[Al(OH)4] 79) Н2 О 80) H3 PO4 81) Ca(H2 PO4)2 82) SO2 83) Cu(NO3)2 84) Mg(HS)2 85)K2 SO3 86) H2 SO4 87) КСІО3 88) Al(OН)3 89)Na. НSO4 90) КСІО4 91)KCl 92) KНSO3 93) Na[Al(OH)4] 94) Ag2 O 95) KMn. O4 96) SO3 97) Mg(OН)2 98) HІO3 99) N2 O 100) Ag. OН 101) Mg. S 102) CO 103) Ва(HS)2 104) КH2 PO4](/uploads/files/332957/184432/199901_images/7.jpg)

















![Завдання 3 Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Тренувальна вправа Є. Zn. SO4 → Zn(OH)2 → Zn. O → K2 Zn. O2 → Zn. Cl2 → Zn(OH)2 → → K2 [Zn(OH)4] Завдання 3 Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Тренувальна вправа Є. Zn. SO4 → Zn(OH)2 → Zn. O → K2 Zn. O2 → Zn. Cl2 → Zn(OH)2 → → K2 [Zn(OH)4]](/uploads/files/332957/184432/199901_images/25.jpg)
![Завдання 3. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Розв’язок тренувальної вправи Є. Zn. SO4 + 2 Na. ОН → Zn(OH)2↓ + Na2 SO4 Zn(OH)2 → Zn. O + Н2 О Zn. O + К2 О ( спікання при високій Т) → K2 Zn. O2 K2 Zn. O2 +4 НCl→ Zn. Cl2 + 2 КCl + 2 Н2 О Zn. Cl2 +2 КОН → Zn(OH)2↓ + 2 КCl. Zn(OH)2 + 2 КОН (розчин)→ K2 [Zn(OH)4] Завдання 3. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Розв’язок тренувальної вправи Є. Zn. SO4 + 2 Na. ОН → Zn(OH)2↓ + Na2 SO4 Zn(OH)2 → Zn. O + Н2 О Zn. O + К2 О ( спікання при високій Т) → K2 Zn. O2 K2 Zn. O2 +4 НCl→ Zn. Cl2 + 2 КCl + 2 Н2 О Zn. Cl2 +2 КОН → Zn(OH)2↓ + 2 КCl. Zn(OH)2 + 2 КОН (розчин)→ K2 [Zn(OH)4]](/uploads/files/332957/184432/199901_images/26.jpg)

![Завдання 3 (продовження)Аl → Аl2 O3 → Аl. Сl3 → Аl(ОН)3 12. Cd. S → Cd. O → Cd(NO3)2 → Cd(OH)213. Fe → Fe2 O3 → Fe. Cl3 → Fe (OH)314. Вa(OH)2→ Вa. CO3 → CO2→ Cu. CO315. Br2 → HBr → Mg. Br2 → Ag. Br16. Мg → Мg. O → Мg(OH)2 → Мg(NO3)217. Cu. SO4→ Cu(OH)2 → Cu. O → Cu. Cl218. P → P2 O5 → H3 PO4 → Na3 PO4 → 19. Na2 O → Na2 SO4 → Na. OH → Na. Al. O220. Zn. S →Zn. Cl2 →K2[Zn(OH)4] → Zn(OH)2 21. Zn(OH)2 →Zn(NO3)2 →Zn. CO3→ Zn. O22. Cu. Cl2 → Cu(NO3)2 → Cu. S → Cu(ОН)223. SO3→ H2 SO4 → К2 SO4 → Ba. SO424. Zn. O → Zn. Cl2 → Zn(ОН)2→ ZnІ2 Завдання 3 (продовження)Аl → Аl2 O3 → Аl. Сl3 → Аl(ОН)3 12. Cd. S → Cd. O → Cd(NO3)2 → Cd(OH)213. Fe → Fe2 O3 → Fe. Cl3 → Fe (OH)314. Вa(OH)2→ Вa. CO3 → CO2→ Cu. CO315. Br2 → HBr → Mg. Br2 → Ag. Br16. Мg → Мg. O → Мg(OH)2 → Мg(NO3)217. Cu. SO4→ Cu(OH)2 → Cu. O → Cu. Cl218. P → P2 O5 → H3 PO4 → Na3 PO4 → 19. Na2 O → Na2 SO4 → Na. OH → Na. Al. O220. Zn. S →Zn. Cl2 →K2[Zn(OH)4] → Zn(OH)2 21. Zn(OH)2 →Zn(NO3)2 →Zn. CO3→ Zn. O22. Cu. Cl2 → Cu(NO3)2 → Cu. S → Cu(ОН)223. SO3→ H2 SO4 → К2 SO4 → Ba. SO424. Zn. O → Zn. Cl2 → Zn(ОН)2→ ZnІ2](/uploads/files/332957/184432/199901_images/28.jpg)




















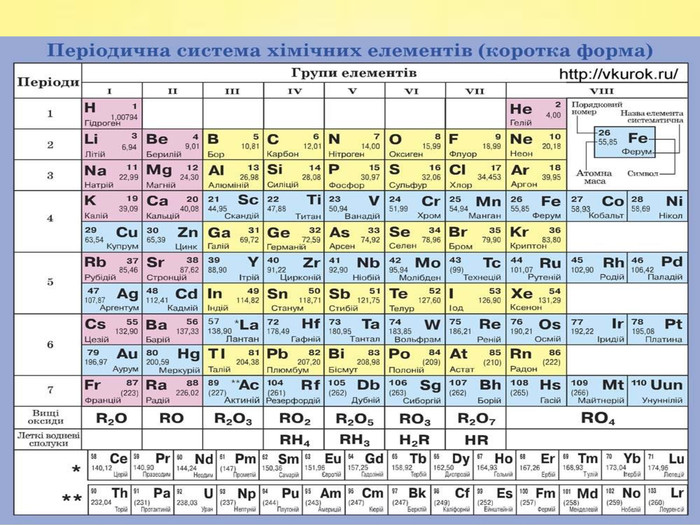
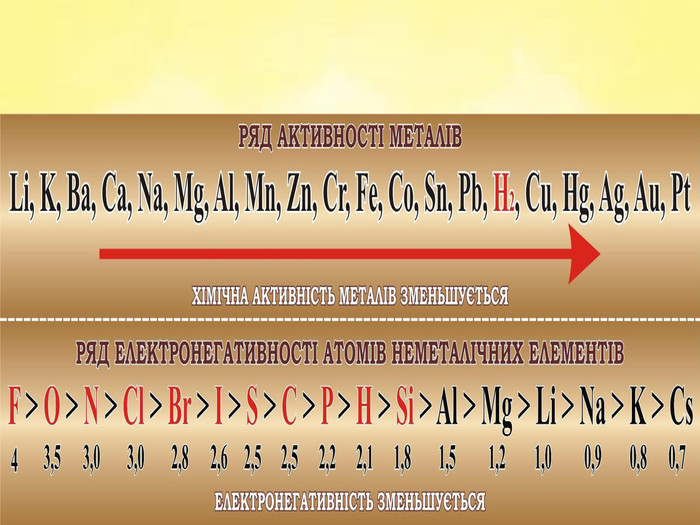
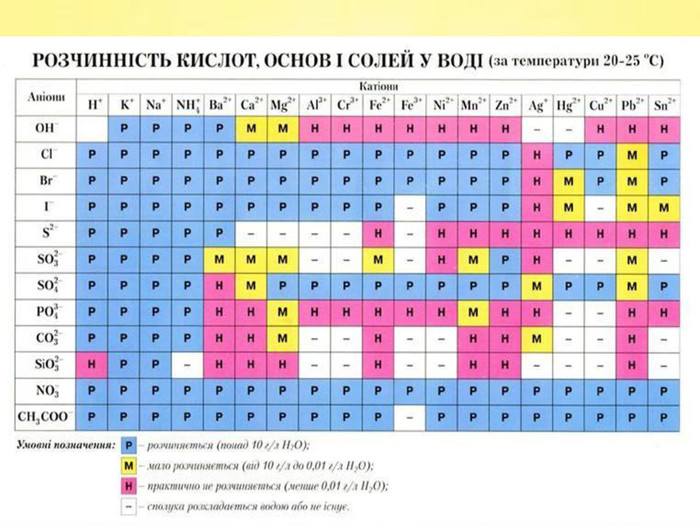
Завдання 1. Виберіть Ваш варіант. Номер Вашого варіанта відповідає порядковому номеру вашого прізвища у списку учнів Вашого класу. Поділ завдань на варіанти вказано нижче. Умови завдання 1 . Дайте назви поданим хімічним сполукам, вкажіть клас до якого належать ці хімічні сполуки. У одній із сполук, на Ваш вибір, обчисліть масову частку неметалу. Для кожної сполуки вкажіть кількісний та якісний склад, тип хімічного зв’язку, галузь застосування сполуки. Слайди №5 -№8.
Варіанти Варіант 1- завдання 1-5 Варіант 2- завдання 6-10 Варіант 3- завдання 11-15 Варіант 4- завдання 16-20 Варіант 5- завдання 21-25 Варіант 6- завдання 26-30 Варіант 7- завдання 31-35 Варіант 8- завдання 36-40 Варіант 9- завдання 41-45 Варіант 10- завдання 46-50 Варіант 11- завдання 51-55 Варіант 12- завдання 56-60 Варіант 13- завдання 61-65 Варіант 14- завдання 66-70 Варіант 15- завдання 71-75 Варіант 16- завдання 76-80 Варіант 17- завдання 81-85 Варіант 18- завдання 86-90 Варіант 19- завдання 91-95 Варіант 20- завдання 96-100 Варіант 21- завдання 101-105 Варіант 22- завдання 106-110 Варіант 23- завдання 111-115 Варіант 24- завдання 116-120
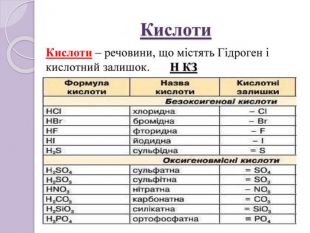
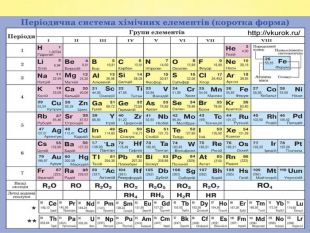
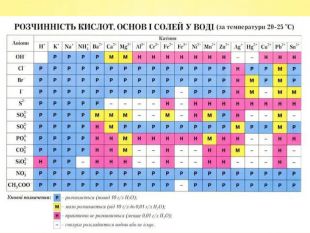
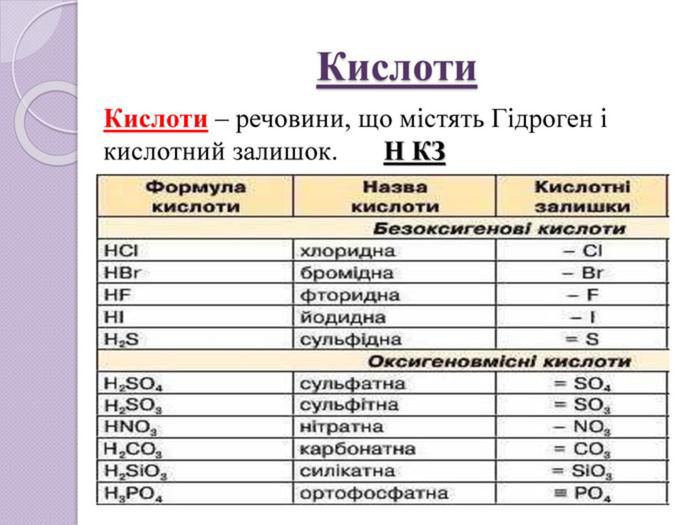
Завдання 11) Al. Cl3 2) Cа. F2 3) SO2 4) Na. ОH 5) HNO2 6) H2 Se 7) H3 As. O4 8)N2 O5 9) Li. OH 10) HCl. O4 11) Ca(OH)2 12) HF 13)Zn(OH)2 14) P2 O5 15) КOH 16)Zn. S 17) Fe(OH)2 18) CO2 19)Mg. O 20) Li. NO3 21) Br2 O5 22) Nа. Cl 23) Na2 CO3 24) НNО2 25) Na2 Zn. O2 26)Si. O2 27) H2 S 28) Na. OH 29) Mo. O3 30) HCl. O4 31) HBr 32) H2 Te. O3 33) HF 34) Cа(ОH)2 35) Cu2 O 36) Li. F 37) Са. S 38) Cl2 O7 39) Ba(NO3)2 40) Si. O2 41) Fe(OH)2
Завдання 1 ( продовження)42) H2 Zn. O2 43) Na. NO3 44) Al2(SO4)3 45) HNO3 46) K4 P2 O7 47) Fe. O 48) Cr(OH)2 49) Mg3 N2 50) KOH 51) Н2 SO4 52) Н3 PO4 53) H2 Si. O3 54) Ca. CO3 55) Na. NO2 56) P2 O5 57) Mg(NO3)2 58) Pb. O 59) Cl2 O7 60) Na2 O 61) (NH4)2 SO4 62) Cr2 O3 63) NH4 NO3 64)Na2 Be. O2 65) Li. I 66) Mn(OH)2 67) Li. OH 68) Se. O3 69) HCl. O 70) Ba. O2 71)NH4 OH 72) KF 73) Pb. CO3 74) Ba3(PO4)2
Завдання 1 (продовження )75) Cr. Cl3 76) NH4 NO3 77) Na2 Si. O3 78) K[Al(OH)4] 79) Н2 О 80) H3 PO4 81) Ca(H2 PO4)2 82) SO2 83) Cu(NO3)2 84) Mg(HS)2 85)K2 SO3 86) H2 SO4 87) КСІО3 88) Al(OН)3 89)Na. НSO4 90) КСІО4 91)KCl 92) KНSO3 93) Na[Al(OH)4] 94) Ag2 O 95) KMn. O4 96) SO3 97) Mg(OН)2 98) HІO3 99) N2 O 100) Ag. OН 101) Mg. S 102) CO 103) Ва(HS)2 104) КH2 PO4
Завдання 2. Поділ на варіанти залишається таким самим, як і у першому завданні. Умова завдання 2. Розв’яжіть задачу. Обчисліть масу хімічної сполуки ( завдання Вашого варіанта ), яка відповідає кількості речовини 2,5 моль. Хімічну сполуку взяти одну на вибір, з тих п’яти сполук з якими працювали у завданні 1 ( сполуку, масу якої будете обчислювати, вказати самостійно, обчислення записувати у повному обсязі). Підказка до розв’язку цієї задачі є на с. 107 у підручнику «Хімія» для 8 класу за авторством П. П. Попеля та Л. С. Криклі видавництва «Академія» 2016
Зразок характеристики рівняння реакції:4 Li + О2 → 2 Li2 O - це рівняння сполучення ( горіння) двох простих речовин: лужного металу літію ( зв’язок металічний) та кисню ( зв’язок ковалентний неполярний). Реагенти – літій і кисень, їхній сумарний коефіцієнт -5; продукт - Літій оксид (зв’язок йонний), коефіцієнт продуктів – 2, коефіцієнт реакції – 7 ; Mr (Li2 O) = 7∙ 2+ 16 = 30 Li2 O + Н2 О → 2 Li. OH – це рівняння сполучення двох складних речовин Літій оксиду та Гідроген оксиду ( води) з утворенням літій гідроксиду ( основа (забарвлення лакмусу - синє)). У молекулі води є два ковалентні полярні зв'язки між атомом Оксигену і двома атомами Гідрогену. Між молекулами води є водневі зв’язки. Mr (Li. OH)= 7 + 16 +1 =24 ( зв’язок йонний), кофіцієнт реагентів – 2, коефіцієнт продуктів – 2, коефіцієнт реакції – 4.
Завдання 3. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Розв’язок тренувальної вправи Ґ.2 Al +3 Cl2 → 2 Al. Cl3 Al. Cl3 + 3 Na. OH → Al(OH)3↓ + 3 Na. Cl. Al(OH)3 +3 Na. OH (сплавляння при високій Т)→ Na3 Al. O3 + 3 Н2 О 2 Na3 Al. O3 + 6 H2 SO4 → Al2(SO4)3 + 3 Na2 SO4 + 6 Н2 О
Завдання 3. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: Розв’язок тренувальної вправи Є. Zn. SO4 + 2 Na. ОН → Zn(OH)2↓ + Na2 SO4 Zn(OH)2 → Zn. O + Н2 О Zn. O + К2 О ( спікання при високій Т) → K2 Zn. O2 K2 Zn. O2 +4 НCl→ Zn. Cl2 + 2 КCl + 2 Н2 О Zn. Cl2 +2 КОН → Zn(OH)2↓ + 2 КCl. Zn(OH)2 + 2 КОН (розчин)→ K2 [Zn(OH)4]
Завдання для самостійного опрацювання. Номер перетворення відповідає Вашому варіанту – слайд №4 Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:1. Сu → Сu. О → Cu(NO3)2 → Cu. CO3 2. Ва. О → Ва. Сl2 → Ba. SO4 → Вa. O 3. SO3 → H2 SO4 → Fe2(SO4)3 → SO34. Li2 O → Li. OH → Li2 SO4 → Li2 O 5. S → SO2 → Na2 SO3 → Na2 О6. Mg → Mg. O → Mg(NO3)2 → Mg. CO3 7. С → СО2 → Ba. CO3 → СO2 8. Ca(OH)2 → Ca. O → Ca. Br2→ Са(OН)2 9. Мg. О→ Мg→ Мg(ОН)2→ Мg. СO3 10. Сa→ Сa(ОН)2→ Сa. CO3 → Сa. O
Завдання 3 (продовження)Аl → Аl2 O3 → Аl. Сl3 → Аl(ОН)3 12. Cd. S → Cd. O → Cd(NO3)2 → Cd(OH)213. Fe → Fe2 O3 → Fe. Cl3 → Fe (OH)314. Вa(OH)2→ Вa. CO3 → CO2→ Cu. CO315. Br2 → HBr → Mg. Br2 → Ag. Br16. Мg → Мg. O → Мg(OH)2 → Мg(NO3)217. Cu. SO4→ Cu(OH)2 → Cu. O → Cu. Cl218. P → P2 O5 → H3 PO4 → Na3 PO4 → 19. Na2 O → Na2 SO4 → Na. OH → Na. Al. O220. Zn. S →Zn. Cl2 →K2[Zn(OH)4] → Zn(OH)2 21. Zn(OH)2 →Zn(NO3)2 →Zn. CO3→ Zn. O22. Cu. Cl2 → Cu(NO3)2 → Cu. S → Cu(ОН)223. SO3→ H2 SO4 → К2 SO4 → Ba. SO424. Zn. O → Zn. Cl2 → Zn(ОН)2→ ZnІ2
Завдання 3 Підвищена складність. Додатково ( для тих учнів, що претендують на вищий бал). Запишіть хімічні формули сполук у таких схемах перетворень:а) оксид → основа → сіль (сполуки Барію);б) оксид → кислота → сіль (сполуки Фосфору);в) оксид ← гідроксид → сіль (сполуки Алюмінію). Складіть рівняння відповідних реакцій.
Завдання 4. Зразок розв’язку задачі 1. Дано:m(Zn)= 2,6 г Аr(Zn) = 65 Знайти : Vm = 22,4 л. V(H2 ) -?Записуємо рівняння хімічної реакції Zn + 2 HCl→ Zn. Cl2 + Н2 Записуємо відомі величини та ті, що треба знайти 2,6 г х л Zn + 2 HCl → Zn. Cl2 + Н2 65 г 22,4 л. Х=2,6 ∙ 22,465 Х=260 ∙ 0,22465=0,896л. Відповідь: V (Н2) = 0,896л
Завдання 4 Зразок розв’язку задачі 2. Дано: n (Na. ОН) = 0,5моль Мr (Na2 О ) = 23∙2 +16 = 46+16=62 Знайти: m (Na2 О ) -? Записуємо рівняння хімічної реакції: Na2 O + Н2 О → 2 Na. OHЗаписуємо відомі величини та ті, що треба знайти Х г 0,5 моль Na2 O + Н2 О → 2 Na. OH 62 г 2 моль Х=62∙ 0, 52 =15, 5г. Відповідь: m (Na2 О ) = 15,5 г
Завдання 4 Зразок розв’язку задачі 3. Дано:m (Fe ) = 336г Мr ( Fe3 O4 ) = 56∙3+16∙4= 168+64= 232 Знайти: m ( Fe. O ∙Fe2 O3 ) - ? V(О2 ) -?Записуємо рівняння окиснення заліза до залізної окалини, пам’ятаючи, що залізна окалина – це сполука двох оксидів феруму - Fe. O ∙Fe2 O3 , тому її можна записати як Fe3 O4 3 Fe + 2 O2 → Fe3 O4 Записуємо величини, що дані в задачі та ті, що треба знайти: 336 г V л m г 3 Fe + 2 O2 → Fe3 O4 3∙56 г 2∙22,4 л 232 гm=336∙2323∙56=6∙56∙2323∙56=464г V=336∙2∙22,43∙56=6∙56∙2∙22,43∙56=89,6 л. Відповідь : m ( Fe. O ∙Fe2 O3 )= 464г; V(О2 ) = 89,6 л
Завдання 4 Зразок розв’язку задачі 4. Дано:m (Na) =9,2 г. Знайти:m (Н2 О) - ? V(Н2 ) -?Записуємо рівняння реакції взаємодії натрію з водою, пам’ятаючи властивість лужних металів.2 Na + 2 Н2 О → 2 Na. ОН + Н2 ↑Записуємо величини, що дані в задачі та ті, що треба знайти: 9,2 г m г V л 2 Na + 2 Н2 О → 2 Na. ОН + Н2 ↑ 2∙23 г 2∙18 г 22,4 л m=9,2∙2∙182∙23=0,4∙23∙2∙182∙23=7,2г V=9,2∙22,42∙23=0,4∙23∙22,42∙23=4,48 л. Відповідь : m (Н2 О)= 7,2 г; V(Н2 ) = 4,48 л
Завдання 4 Зразок розв’язку задачі 5 Дано: m (К2 SO4 ) = 34,8 г Мr (К2 О) = 39∙2+16= 94г Мr (К2 SO4 ) = 39∙2 +32+16∙4 = 174 г. Знайти :m ( К2 О) - ?Записуємо рівняння хімічної реакції, пам’ятаючи , щоб отримати з калій оксиду калій сульфат, необхідно, щоб калій оксид прореагував з сульфатної кислотою ( один з можливих варіантів ). К2 О + Н2 SO4 → К2 SO4 + Н2 ОЗаписуємо величини, що дані в задачі та ті, що треба знайти: m г 34,8 г К2 О + Н2 SO4 → К2 SO4 + Н2 О 94 г 174 гm=94∙34,8174=9,4∙2∙174174=18,8г Відповідь : m (К2 О)= 18,8 г
Завдання 4 Зразок розв’язку задачі 6. Дано: m (Ва і Ва. О) = 15 г. V(Н2 ) = 22,4 л. Знайти :m (Ва) -? m (Ва. О) -?Суміш складається з двох компонентів – барію (Ва) та оксиду барію (Ва. О) , тому записуємо два рівняння хімічних реакцій: Ва +2 НCl → Ва. Cl2 + Н2 ↑ (1) Ва. О + 2 НCl → Ва. Cl2 + Н2 О (2)Газ водень виділяться тільки в першому рівнянні, отже , беремо до уваги перше рівняння і записуємо відомі величини та ті, що треба знайти : Х г 2,24л Ва + 2 НCl → Ва. Cl2 + Н2 ↑ 137 г 22,4 л Х=137∙22,422,4=13,7 г Ва m (Ва. О) = 15 -13,7 = 1,3 г
Завдання 4 Зразок розв’язку задачі 7 Дано:m (С) =500 гw ( негорючих домішок у вугіллі) =4%Знайти: V (СО2 )-?Негорючі домішки у вугіллі складають 4%, отже, частка вугілля, яке буде горіти з утворенням вуглекислого газу, буде складати 100%-4%=96%Дізнаємося яка маса вугілля припадає на 96%, склавши пропорцію: 500г вугілля – 100% Х г вугілля – 96% Х=500∙96100=480 г С Записуємо рівняння горіння вугілля, підставляємо величини, які дані в умові задачі та ті, які треба знайти: 480 г Х л С + О2 → СО2 12 г 22,4 л. V=480∙22,412=40∙12∙22,412=896 л Відповідь: V (СО2 ) = 896 л
Завдання 4 Варіанти задач для самостійного розв’язування. Збірник задач та вправ з неорганічної хімії, автор М. М. Савчин, Львів 2004 Варіант 1. Кальцій масою 240г вступив в реакцію з водою. Який об’єм (н.у.) газу виділився?Варіант 2. Під дією високої температури піддали розкладу 30,6 г алюміній гідроксиду. Які маси продуктів реакції?Варіант 3. На купрум (ІІ) гідроксид подіяли розчином , що містив 18,9 г нітратної кислоти. Які маси продуктів реакції?Варіант 4. При взаємодії натрій гідроксиду з бромідною кислотою утворився натрій бромід масою 2,06 г. Які маси реагентів?Варіант 5. Під час взаємодії кальцію з киснем утворився кальцій оксид кількістю речовини 0,75 моль. Який об’єм кисню витратився?Варіант 6. Калій гідроксид кількістю речовини 2 моль повністю нейтралізували нітратною кислотою. Які маси продуктів реакції?Варіант 7. Через натрій гідроксид масою 32 г пропустили карбон ( ІV) оксид. Які маси продуктів реакції?
Завдання 4 Варіант 8. Фосфор масою 6,2 г згорів в атмосфері кисню. Який об’єм кисню витратився в результаті реакції?Варіант 9. Яка маса магній сульфату утвориться, якщо на магній оксид масою 4,8 г подіяли сульфатною кислотою?Варіант 10. На натрій силікат кількістю речовини 0,8 моль подіяли надлишком хлоридної кислоти. Які маси продуктів реакції?Варіант 11. Розклали кальцій карбонат масою 20 г. Який об’єм газу (н.у.) при цьому виділився?Варіант 12. На цинк масою 2,6 г подіяли хлоридною кислотою до повного його розчинення. Знайдіть маси продуктів реакції. Варіант 13. На барій оксид подіяли сульфатною кислотою кількістю речовини 0,5 моль. Знайдіть маси продуктів реакції. Варіант 14. Літій кількістю речовини 0,1 моль прореагував з водою. Який об’єм водню утворився? Якій масі відповідає утворений об’єм водню?Варіант 15. Ферум (ІІ) оксид масою 14, 4 г розчинили в сульфатній кислоті. Знайдіть маси продуктів цієї реакції.
Завдання 4 Варіант 16. Літій оксид масою 9 г сполучили з хлоридною кислотою. Знайдіть маси продуктів реакції. Варіант 17. Від взаємодії міді з киснем утворився купрум (ІІ) оксид кількістю речовини 2 моль. Яка маса міді витратилася?Варіант 18. Спалили карбон масою 720 г. Який об’єм кисню витратився на спалювання цієї маси карбону? Який об’єм вуглекислого газу при цьому утворився?Варіант 19. Розклали барій сульфіт масою 43,4 г. Знайдіть маси продуктів реакції. Варіант 20. Спалили сірку масою 8 г. Яка маса сульфур ( ІV) оксиду утворилася? Якому об’єму відповідає утворена маса сульфур ( ІV) оксиду?Варіант 21. Кальцій оксид сполучили з вуглекислим газом. Внаслідок реакції утворився кальцій карбонат масою 400г. Знайдіть маси реагентів. Варіант 22. Алюміній масою 9 г сполучили з киснем. Який об’єм кисню витратився? Яка маса алюміній оксиду утворилася?Варіант 23. На калій масою 15, 6 г подіяли водою до повного його розчинення. Який об’єм газу утворився? Яка маса калій гідроксиду утворилася?Варіант 24. При окисненні порошку магнію киснем утворився магній оксид масою 24 г. Яка маса магнію окислилася? Який об’єм кисню витратився?
-
 Меташоп Наталія Володимирівна 30.01.2021 в 19:50Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Меташоп Наталія Володимирівна 30.01.2021 в 19:50Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку