Поняття про лужні метали, галогени та інертні гази
Дана розробка розкриває питання існування природних груп хімічних елементів, таких як лужні метали, галогени та інертні гази. В розробці використані такі методи і прийоми, як: гра "хімічний проект", "спільний проект", ребус та шарада.
1
Тема. Поняття про лужні метали, галогени та інертні гази
Розум людський завжди прагне до діяльності
і не терпить безперервного спокою.
Цицерон.
Мета: продовжити знайомство учнів з класифікаціями хімічних елементів на основі знань про лужні метали, галогени та інертні гази, підвести учнів до сприйняття періодичного закону; поглибити знання учнів шляхом вивчення перерахованих природних груп, продовжувати формувати вміння учнів працювати із хімічними реактивами та економно їх використовувати; продовжувати формувати науковий світогляд на основі знань про класифікації хімічних елементів; розвивати пізнавальну діяльність, хімічну мову, мислення, увагу, уміння аналізувати.
Методи: “спільний проект”, бесіда, демонстрація, робота з підручником, гра, хімічний експеримент.
Обладнання та реактиви: вода, чашки Петрі, літій, натрій, калій, лезо, бром, йод, фенолфталеїн, метиловий рожевий, комп’ютер, проектор.
Тип уроку: засвоєння нових знань
ХІД УРОКУ
І. Організаційний момент
ІІ. Актуалізація опорних знань і чуттєвого досвіду учнів.
* Бесіда за запитаннями.
Перед тим як розпочати наш урок давайте пригадаємо:
1. Які класифікації хімічних елементів ми з вами вже вивчили та в чому вони заключаються? (Лавуазьє, Деберейнера, Одлінга, Шанкуртуа, Ньюлендса, Мейєра).
2. Хто найближче підійшов до створення періодичної системи? (Мейєр).
ІІІ. Мотивація навчальної діяльності.
1. * Гра “Хімічний елемент”.
Пропонується пограти у гру “Хімічні елементи”. Вчитель розповідає правила гри.
Я роздам вам три різних за кольором комплекти карток зі знаками хімічних елементів (десять штук, серед яких для однієї команди є лужні метали, для іншої – галогени, а для третьої – інертні гази). За сигналом кожна із команд повинна вибрати картки з тими хімічними елементами, які розміщені в одній групі. Перемагає команда, яка виконала завдання правильно та швидше за інших.
Завдання для першої команди:
Li, B, K, Al, Si, Na, Rb, As, Cs, I.
Завдання для другої команди:
N, F, S, Cl, Br, Se, Rn, I, Sn, At.
Завдання для третьої команди:
He, Kr, C, B, Ne, Cd, Xe, Ca, Ar, Bi.
Відповіді:
для першої команди: Li, K, Na, Rb, Cs.
для другої команди: F, Cl, Br, I, At.
для третьої команди: He, Kr, Ne, Xe, Ar.
2. * Проблемне питання.
Поясніть чому елементи, які ви відібрали, розміщені в одній групі?
3. * Слово вчителя. Оголошення мети та теми уроку.
Я бачу, що це завдання викликає у вас труднощі. Тож як ви гадаєте – якою є мета нашого уроку?. Запишіть тему сьогоднішнього уроку.
IV. Вивчення нового матеріалу.
1. * Слово вчителя.
Перед початком роботи пригадуємо правила техніки безпеки (див. слайд 1).

 .
. ![]() (слайд 1)
(слайд 1)
2. * “Спільний проект”
Робота в групах щодо пошуку розв’язання певної проблеми. Завдання, які отримують групи, мають різний зміст та висвітлюють загальну проблему з різних боків. Після завершення роботи кожна група звітує й записує результати на дощі. Із відповідей представників груп складається спільний проект.
Завдання для групи 1
1. Уважно розгляньте групу лужних металів та її представників (Li, K, Na, Rb, Cs, Fr).
2. Виясніть за якими ознаками виділено цю групу (Ними розпочинаються всі періоди. Лужні метали мають однакову загальну формулу оксиду, в якій лужні метали одновалентні. Вони мають невисокі температури кипіння та плавлення, належать до легких металів. Лужні метали надзвичайно активні прості речовини. Активно взаємодіють з киснем, з водою (утворюють луги)).
3. За допомогою характерних реакцій доведіть правильність цієї думки (Проводять реакцію з водою).
4. Запишіть в зошити рівняння необхідних реакцій (2Li + 2H2O = 2LiOH + H2; 4K + O2 = 2K2O; 2Na + S = Na2S).
Завдання для групи 2
1. Уважно розгляньте групу галогенів та їх представників (F, Cl, Br, I, At).
2. Виясніть за якими ознаками виділено цю групу (Легко вступають в реакцію з металами та утворюють солі безоксигенових кислот. Прості речовини галогенів виявляють високу хімічну активність. Мають різкий подразнюючий запах. Всі галогени мають колір. Мають низьку температуру плавлення (переважно від’ємну, окрім І)).
3. Яку будову мають прості речовини галогенів (Молекули всіх галогенів двохатомні).
4. Запишіть рівняння реакцій, згаданих в підручнику (H2 + F2 = 2HF; 2K + Cl2 = 2KCl).
Завдання для групи 3
1. Уважно розгляньте групу інертних газів (He, Ne, Ar, Kr, Xe, Rn).
2. Виясніть за якими ознаками виділено цю групу (Усі вони належать до малопоширених елементів на Землі. У вільному стані існують у вигляді газуватих речовин. Для них характерна висока інертність відносно інших речовин. Ними закінчується кожний період).
3. Яку будову мають прості речовини інертних газів (Вони мають одноатомний склад молекул).
V. Узагальнення та систематизація знань.
1. * Бесіда за запитаннями за слайдами (див. слайд 2,3).
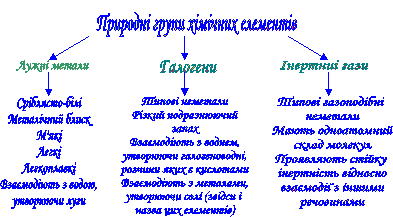 (слайд 2)
(слайд 2)
1. Які природні групи елементів ми вивчили?
2. Чому згадані елементи об’єднані в ці групи?
3. Що за елементи зашифровані у ребусі? До якої групи вони належать 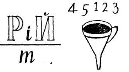 (слайд 3)
(слайд 3)
(Натрій і калій; лужні метали).
2. Відгадай шараду:
Я – газ, проста речовина,
Двоцифровий номер мій.
Склад перший – бог,
Ріка – мій другий склад.
До якої групи належить цей елемент?
(Радон; інертний газ).
VI. Домашнє завдання §§ 27, 28 вивчити, вправи 5-7 ст.125 та 1-5 ст.130


про публікацію авторської розробки
Додати розробку
