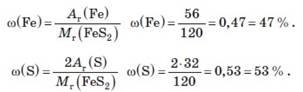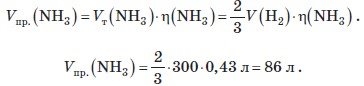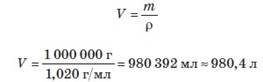Практикум "Компетентністні задачі з хімії (7-9 класи)"

Семеняк В.А. Практикум: компетентнісні задачі з хімії (для учнів 7-9 класів).
Матеріали запропонованого практикуму узгоджено з вимогами навчальних програм для 7-9 класів. У зручній формі представлені компетентнісні задачі з детальними розв'язками. Задачі охоплюють основні теми хімії, допомагаючи учням зрозуміти концепції та принципи хімічних явищ. Кожне завдання супроводжується вичерпним розв’язком та поясненням, що сприяє глибокому розумінню матеріалу.
Практикум дозволяє застосовувати отримані знання у реальних життєвих ситуаціях, що робить вивчення предмету «Хімія» більш ефективним - сприяють розвитку аналітичних навичок учнів та мають практичний зміст. Завдання охоплюють різноманітні аспекти хімії та дозволяють учням застосовувати отримані знання в повсякденних ситуаціях.
 Завдання практикуму спрямовані на допомогу вчителю в організації та проведенні проблемної навчальної діяльності школярів, розвитку їх компетентностей, самостійності у пошуку розв’язання завдань. Практикум призначений для впровадження в освітній процес з перемету «Хімія», а також для індивідуального навчання учнів 7-9 класів.
Завдання практикуму спрямовані на допомогу вчителю в організації та проведенні проблемної навчальної діяльності школярів, розвитку їх компетентностей, самостійності у пошуку розв’язання завдань. Практикум призначений для впровадження в освітній процес з перемету «Хімія», а також для індивідуального навчання учнів 7-9 класів.
ЗМІСТ
ПЕРЕДМОВА ..................................................................................................................................... 3
1. ЗАДАЧІ З ХІМІЇ ПОБУТОВОГО, ЕКОЛОГІЧНОГО ТА ПІЗНАВАЛЬНОГО ЗМІСТУ
УЧНІВ 7 КЛАСУ ................................................................................................................................ 5
1.1. Задачі на обчислення масової частки розчиненої речовини в розчині .............................. 5
1.2. Задачі на обчислення маси розчину ....................................................................................... 9
1.3. Задачі на обчислення маси розчиненої речовини ............................................................... 12 1.4. Задачі на визначення маси й об’єму води ........................................................................... 17
2. ЗАДАЧІ З ХІМІЇ ПРИКЛАДНОГО, ВИРОБНИЧОГО ТА ЕКОЛОГІЧНОГО ЗМІСТУ ДЛЯ
УЧНІВ 8 КЛАСУ .............................................................................................................................. 25
2.1. Приклади розв’язку та задачі до тем хімії: «Атоми. Молекули. Хімічні елементи.
Молекулярні маси. Маси атомів. Молярні маса та об’єм» ....................................................... 25 2 2.2. Приклади розв’язку та задачі до тем хімії: «Молярний об’єм газів. Кількісний склад
складних речовин. Визначення формул речовин» .................................................................... 27
2.3. Приклади розв’язку та задачі до тем хімії: «Розрахунки за ріннями хімічних реакції» 30
2.4. Задачі виробничого та пізнавального змісту ...................................................................... 32
2.5. Практика розрахунку задач екологічного змісту ............................................................... 34
3. ЗАДАЧІ З ХІМІЇ ПРИКЛАДНОГО СПРЯМУВАННЯ ДЛЯ УЧНІВ 9 КЛАСУ .................... 45
3.1. Задачі на визначення ступеню електролітичної дисоціації ............................................... 45
3.2. Вправи на визначення рН ..................................................................................................... 50
3.3. Задачі на визначення кількості йонів у розчині ................................................................. 52 3.4. Вправи на визначення йонів у розчині ................................................................................ 57
4. ПРИКЛАДНИЙ ПРОЕКТ - STEAM-ПРОЕКТ «ЛИСТОК – ЕНЕРГЕТИЧНЕ ПАЛИВО» ДЛЯ УЧНІВ 7-9 КЛАСІВ ............................................................................................................... 61
ДЖЕРЕЛА ......................................................................................................................................... 71
1. ЗАДАЧІ З ХІМІЇ ПОБУТОВОГО, ЕКОЛОГІЧНОГО ТА ПІЗНАВАЛЬНОГО ЗМІСТУ УЧНІВ 7 КЛАСУ
1.1. Задачі на обчислення масової частки розчиненої речовини в розчині
Задача 1
Антиалергічна мазь «Синафлан» масою 15 г містить 0,375 мг основної речовини. Визначте масову частку (%) діючої речовини у мазі.

Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
2) Обчислюємо масову частку препарату в розчині:
𝜔(речовини) ![]() %
%
Відповідь: ω(речовини) = 0,025 %.
Задача 2
Фруктоза включається до складу багатьох плодів та фруктів, знаходиться і в меді. Фруктозу застостовують у медицині, наприклад при лікувальних дієтах
(лікувальне харчування) хворих на цукровий діабет. Потрібно обчистити масову частку фруктози у розчині, що складається з 50 г фруктози та 200 г води.

Розв’язання
1)Знайдемо масу розчину глюкози:
 𝑚(розчину) = 𝑚(фруктози) + 𝑚(𝐻2𝑂)
𝑚(розчину) = 𝑚(фруктози) + 𝑚(𝐻2𝑂)
𝑚(розч. ) = 50г + 200г = 250г
2)Знаходимо масову частку глюкози у розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
50г
𝜔(речовини) ![]() %
%
Відповідь: ω(фруктози) = 20%.
Задача 3
Кобальт(ІІ) хлорид можемо вдало використовувати для криптографії (тайнопису): літери, що написані даним розчином, що включає в 25 мл води 1 г солі, зовсім невидимі. Проявляють таємний напис легким нагріванням паперу на якому писали літери, а слова при цьому стають синіми. Вирахуйте масову частку кобальт(ІІ) хлориду в цьому цікавому розчині.
 V(H O) = 25 мл
V(H O) = 25 мл
Оскільки ρ(води) = 1 г/мл m(H2O) = 1 г/мл ⋅25 мл = 25 г 2) Обчислимо масу розчину: m(розчину) = m(H2O) + m(речовини) m(розчину) = 25 г + 1 г = 26 г
3) Знайдемо масу розчиненої речовини за формулою:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
1г
𝜔(СоС𝑙2) ![]() %
%
Відповідь: ω(CoCl2) = 3,85 %.
Задача 4
Для консервування 1 кг буряка без оцту потрібно приготувати розсіл з 1 л води і 15 г солі. Розкладений в підготовлені банки буряк залити гарячим розсолом, стерилізувати і закатати. Визначте масову частку солі у розсолі.
![]()

Розв’язання
1) Знайдемо масу утвореного розчину: m(розчину) = 1000 г + 15 г = 1015 г
2) Знаходимо масову частку солі у розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
15г
𝜔(𝑁𝑎𝐶𝑙) ![]() %
%
Відповідь: ω(NaCl) = 1%.
Задача 5
Бетон — зв’язуюча суміш, яка застосовується в будівництві. Його готують із цементу, води й піску. Обчисліть масову частку (%) цементу у бетоні, при врахуванні що будівельники змішували 10 кг цементу, 20 кг піску і 10 л води.

Розв’язання
1) Записуємо формулу для визначення масової частки розчиненої речовини у розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() ( 2) Підставимо дані: 𝜔(цементу)
( 2) Підставимо дані: 𝜔(цементу) ![]()
𝑚(цементу)+𝑚(піску)+𝑚(води)
100%
3) Обчислюємо масову частку цементу:
𝜔(цементу) ![]() %
%
Відповідь: ω(цементу) = 25 %.
Задача 6
До розпускання бруньок настає пора першого обприскування плодових і ягідних насаджень. Препарат «30В» (індустріальне масло) використовують для боротьби із зимуючими стадіями шкідників з розрахунку 700 г на 10 л води. Обчисліть масову частку препарату в розчині.
 Дано: т(препарату) = 700 г V(H2O) = 10 л
Дано: т(препарату) = 700 г V(H2O) = 10 л
 Розв’язання
Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() ( 2) Знаходимо масу води за формулою:
( 2) Знаходимо масу води за формулою:
𝑚
𝑉 = ![]() , звідси𝑚 = 𝑉 ∙ 𝜌
, звідси𝑚 = 𝑉 ∙ 𝜌
𝜌
m(H2O) = 10 л = 10 000 мл 1 г/мл = 10 000 г
3)Обчислюємо масу розчину: m(розчину)
= m(речовини) + m(розчинника) m(розчину) = 700 г +10 000 г = 10 700 г
4)Обчислюємо масову частку препарату в розчині:
700г
𝜔(препарату) ![]() %
%
Відповідь: ω(препарату) = 6,54 %.
Задача 7
Для стимулювання росту розсади використовують різні препарати, часто вживаний серед них препарат «Корневин». Яка масова частка(%) діючої речовини, якщо змішують 1 г препарату та 1 л води?

1) Записуємо формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() ( 2) Знаходимо масу води за формулою: 𝑚 = 𝑉 ∙ 𝜌 𝑚(𝐻2𝑂) = 1л ⋅ 1000мл ⋅ 1 г⁄мл = 1000г 3) Обчислюємо масу розчину: 𝑚(розчину) = 1г + 1000г = 1001г
( 2) Знаходимо масу води за формулою: 𝑚 = 𝑉 ∙ 𝜌 𝑚(𝐻2𝑂) = 1л ⋅ 1000мл ⋅ 1 г⁄мл = 1000г 3) Обчислюємо масу розчину: 𝑚(розчину) = 1г + 1000г = 1001г
4) Обчислюємо масову частку препарату в розчині:
𝜔(речовини) ![]() %
%
Відповідь: ω(речовини) = 0,1 %.
Задача 8
Ретинол – це вітамін А який необхідний для нормальної діяльності зорового аналізатора, бере участь в формуванні зубів та кісток. Ретинол є нерозчинний у воді, але розчиняється у жирах – його варто приймати з їжею. Необхідно визначити масову частку(%) ретинолу (вітаміну А), якщо його маса 0,25 г, й об’єм жиру, в якому його розчинили, - 10 мл(густина жиру 0,975г/мл).
 Дано: т(вітаміну А) = 0,25 г V(жиру) = 10 мл ρ(жиру) = 0,975 г/мл ω(вітаміну) — ?
Дано: т(вітаміну А) = 0,25 г V(жиру) = 10 мл ρ(жиру) = 0,975 г/мл ω(вітаміну) — ?
Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() ( 2) Знаходимо масу жиру за формулою:
( 2) Знаходимо масу жиру за формулою:
𝑚 = 𝑉 ∙ 𝜌 𝑚(жиру) = 10мл ∙ 0,975 г⁄мл = 9,75г 3) Обчислюємо масу розчину: 𝑚(розчину) = 0,25г + 9,75г = 10г
4) Обчислюємо масову частку препарату в розчині:
𝜔(вітамінуА) ![]() %
%
Відповідь: ω(вiтамiну) = 2,5%.
Задача 9
Натрій хлорид NaCl (кам’яна сіль) має легкі антисептичні властивості. 10-15 %-й сольовий розчин запобігатиме розмноженню гнильних бактерій і часто його застосовують як консервант (наприклад консервація помідорів, огірків тощо).
Софійка готує розчин масою 400 г, що містить в собі 25 г натрій хлориду. Як Софійці віднайти масову частку натрій хлориду (%) в розчині. Розкажіть дівчинці чи можна такий розчин використати для консервації?

Розв’язання
1)  Визначаємо масову частку натрій хлориду в розчині за формулою:
Визначаємо масову частку натрій хлориду в розчині за формулою:
𝑚(𝑁𝑎𝐶𝑙)
𝜔(𝑁𝑎𝐶𝑙) =%
![]() 𝑚(
𝑚(
𝜔(𝑁𝑎𝐶𝑙) ![]() %
%
2) Приготовлений розчин не можна використати для консервації, так як масова частка натрій хлориду менша за 10-15 %.
Відповідь: ω(NaCl) = 6,25 %; даний розчин не можна використати для консервації.
Задача 10
Натрій гідроксид, каустична сода (каустик) або їдкий натр зареєстрований у якості харчової добавки E524. Його використовують у приготуванні їжі: для миття та очищення фруктів і овочів від шкірки, у виробництві шоколаду і какао, напоїв, морозива, фарбування карамелі, для розм’якшення маслин і надання їм чорного забарвлення.
Натрій гідроксид масою 10 г розчинили в 120 мл води. Обчисліть масу розчину та масову частку їдкого натру (%) в одержаному розчині.

𝑚(𝐻2𝑂) = 𝜌(𝐻2𝑂) ∙ 𝑉(𝐻2𝑂)
𝑚(𝐻2𝑂) = 1 г⁄мл ∙ 120мл = 120г 2) Обчислимо масу розчину:
m(розчину) = 10 г + 120 г = 130 г
3) Обчислимо масову частку NaOH в одержаному розчині:
𝑚(𝑁𝑎𝑂𝐻)
𝜔(𝑁𝑎𝑂𝐻) ![]() %
%
𝜔(𝑁𝑎𝑂𝐻) ![]() %
%
Відповідь: m(розчину) = 130 г; ω(NaOH) = 7,7%.
Задача 11
Для видалення бруду та іржі використовують засоби побутової хімії, більшість яких містять сульфатну та хлоридну кислоти. Якщо працювати без гумових рукавичок, ці засоби викликають опіки. Для того щоб нейтралізувати розчин кислоти і уникнути опіків, використовують розчин питної соди. Обчисліть яку масову частку питної соди повинен містити розчин, якщо відомо що у 250 г такого розчину міститься 5 г соди.

Розв’язання
1) Записуємо формулу для визначення масової частки розчиненої речовини у розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
2) Розчиненою речовиною у даному розчині є питна сода. Знаходимо масову частку соди у розчині за формулою:
5г
𝜔(речовини) ![]() %
%
Відповідь: ω(соди) = 2%.
Задача 12
Аспірин допомагає запобігти і попередити утворення гнилей на листках, які нерідко з’являються під час тривалої вологої погоди. Даним розчином обприскують рослини, його готують так: 500 мг аспірину на 4,5 л води. Обчисліть масову частку аспірину в даному розчині.

Розв’язання
1) Записуємо формулу для визначення масової частки аспірину в розчині:
𝑚(асп. )
𝜔(асп. ) = ![]() %
%
2) Визначаємо масу розчину за формулою:
𝑚(розч. ) = 𝑚(асп. ) + 𝑚(𝐻2𝑂) 3) Знаходимо масу води:
𝑚(𝐻2𝑂) = 𝜌(𝐻2𝑂) ∙ 𝑉(𝐻2𝑂)
𝜌(𝐻2𝑂) = 1 г⁄млг
𝑚(𝐻2𝑂) = 1 ![]() ∙ 4500мл = 4500гтому мл
∙ 4500мл = 4500гтому мл
𝑚(розч. ) = 0,5г + 4500г = 4500,5г 4) Розраховуємо масову частку аспірину:
0,5г
𝜔![]() %
%
 Відповідь: ω(асп.) = 0,0111%.
Відповідь: ω(асп.) = 0,0111%.
Задача 13
 Шахтарі у своїй роботі використовують лужні акумуляторні батареї. Для приготування розчину, який вони містять, використовують калій гідроксид масою 266 г і воду об’ємом 940 мл. Визначте масову частку калій гідроксиду в даному розчині. Дано: m(KOH) = 266г V(води) = 940 мл ω(КОН) — ?
Шахтарі у своїй роботі використовують лужні акумуляторні батареї. Для приготування розчину, який вони містять, використовують калій гідроксид масою 266 г і воду об’ємом 940 мл. Визначте масову частку калій гідроксиду в даному розчині. Дано: m(KOH) = 266г V(води) = 940 мл ω(КОН) — ?
Розв’язання
1) Обчислимо масу добутого розчину, враховуючи, що ρ(H2O) = 1 г/мл:
𝑚(р − ну) = 𝑚(води) + 𝑚(лугу)
𝑚(р − ну) = 940г + 266г = 1206г
2) Обчислимо масову частку, скориставшись формулою для масової частки розчиненої речовини:
𝑚(КОН)
𝜔(КОН) =
𝑚(р − ну)
266г
![]() 𝜔(КОН) = = 0,22або22%
𝜔(КОН) = = 0,22або22%
1206г
Відповідь: ω(KOH) = 0,22 (22%).
Задача 14
Натрій гідроксид застосовується у побуті й багатьох галузях промисловості (для виробництва паперу, мила, шампуню та інших миючих засобів, як агент для розчинення засмічень каналізаційних труб тощо). До 50 г натрій гідроксиду долили 200 мл води. Яка масова частка лугу в

𝑚(𝐻2𝑂) = 1 г⁄мл ⋅ 200мл = 200г 2) Знайдемо масу розчину:
𝑚(розчину) = 𝑚(𝐻2𝑂) + 𝑚(речовини)
𝑚(розчину) = 200г + 50г = 250г
3) Знайдемо масову частку утвореного
розчину
𝑚(речовини)
𝜔(речовини) =%
![]() 𝑚(
𝑚(
50г
𝜔(𝑁𝑎𝑂𝐻) ![]() %
%
|
Відповідь: ω(NaOH) = 20 %.
1.2. Задачі на обчислення маси розчину |
Задача 1
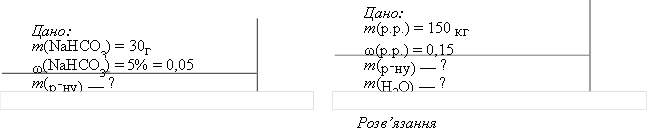 Натрій гідрогенкарбонат, у побуті — питна сода, міститься у багатьох мінеральних джерелах. Обчислити масу порції мінеральної води «Свалява» з масовою часткою натрій гідрогенкарбонату 5 %, якщо маса солі в ній становить 30 г.
Натрій гідрогенкарбонат, у побуті — питна сода, міститься у багатьох мінеральних джерелах. Обчислити масу порції мінеральної води «Свалява» з масовою часткою натрій гідрогенкарбонату 5 %, якщо маса солі в ній становить 30 г.
Розв’язання
Знаходимо масу розчину за формулою:
𝑚(речовини)
𝜔(речовини) =%, звідси
![]() (
(
𝑚(речовини)
𝑚(розчину) = ![]()
𝜔(речовини)
30г
𝑚(розчину) ![]() 600г
600г
Відповідь: 600 г.
Задача 2
Калій хлорид широко застосовується в сільському господарстві як калійне добриво. За температури 50°С його розчинність дорівнює 1,7. Визначте масу розчину, якщо таку кількість калій хлориду розчинити у воді масою 200 г?

1) Записуємо формулу для визначення розчинності речовини:
𝑚(𝐾𝐶𝑙) ∙ 𝑚(𝐻2𝑂)
𝑆(𝐾𝐶𝑙) = ![]()
100г 2) Знаходимо масу KCl за формулою:
𝑆(𝐾𝐶𝑙)
 𝑚(𝐾𝐶𝑙) =
𝑚(𝐾𝐶𝑙) = ![]() 100г
100г
3) Знаходимо масу розчину: 𝑚(р − ну) = 3,4г + 200г = 203,4г
Відповідь: m(р-ну) = 203,4 г.
Задача 3
Для підживлення картоплі на 1 га посівної площі потрібно внести 150 кг аміачної селітри. Обчислити масу води і масу розчину, який можна отримати, з масовою часткою розчиненої речовини 0,15.
1. Щоб визначити масу розчину, скористаємось формулою для масової частки розчиненої речовини:
𝑚(солі)
𝜔(солі) = ![]()
𝑚(розчину) 2. Знаходимо масу розчину:
𝑚(солі)
𝑚(розчину) =
𝜔(солі)
150кг
![]() 𝑚(розчину) = = 1000кг
𝑚(розчину) = = 1000кг
0,15
3. Знаходимо масу води, яку потрібно використати для приготування розчину:
𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚(сол𝑖) =
1000кг − 150кг = 850кг Відповідь: m(р-ну) = 1000 кг; m(H2O) = 850 кг.
Задача 4
Широке поширення в якості дезінфікуючого засобу отримав формалін — 40% водний розчин формальдегіду. У сільському господарстві він використовується для протруєння насіння та знезараження ґрунту, а у тваринництві — для дезінфекції приміщень. Обчисліть масу

𝜔(речовини) ![]() .
.
𝑚(розчину)
2) Знаходимо масу формаліну за формулою:
𝑚(розчину) ![]() .
.
𝜔(речовини)
20кг
𝑚(розчину) ![]() 50кг
50кг
Відповідь: m(р-ну) = 50 кг.
Задача 5
Для приготування маринаду для консервування помідорів застосовують 6% розчин NaCl (кухонної солі). Розрахуйте кількість маринаду, якщо у нас в наявності лише 300 г солі.
Дано: m(сoлi) = 300 г ω(солi) = 6% m(р-ну) — ?Розв’язання
1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
𝜔(речовини) ![]() .
.
𝑚(розчину)
2) Обчислюємо масу розчину за формулою:
𝑚(𝑁𝑎𝐶𝑙)
𝑚(розчину) =%
![]() (
(
300г
𝑚(розчину) ![]() 5000або5л
5000або5л
Відповідь: 5000 г, 5 кг.
Задача 6
Тепла вода з розчиненою в ній харчова сода гарно знімає втому ніг. Такий розчин містить в собі 60 г (це приблизно 3 столові ложки соди (NaHCO3), що дорівнює масовій частці (ω) 3%, й вода. Знайдіть масу такого розчину.

1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
2)  Розчиненою речовиною у даному розчині є питна сода. Позначаємо масу розчину — х. Підставляємо значення:
Розчиненою речовиною у даному розчині є питна сода. Позначаємо масу розчину — х. Підставляємо значення:
60г
3% = ![]() ∙ 100% х
∙ 100% х
60г
х ![]() % х = 2000габо2л. Відповідь: m(розчину) = 2000 г.
% х = 2000габо2л. Відповідь: m(розчину) = 2000 г.
Задача 7
Домашнє миловаріння на сьогоднішній день — дуже популярне хобі. Створити мило дуже просто, для цього необхідно взяти 6 г оливкової олії, масова частка якої становить 5,66%, і мильну основу, і за бажанням залити у гарну форму. Визначте масу мила, яке можна виготовити з даних інгредієнтів.
 Дано: m(олiї) = 6 г ω(олiї) = 5,66% = 0,0566 m(мила) — ?
Дано: m(олiї) = 6 г ω(олiї) = 5,66% = 0,0566 m(мила) — ?
Розв’язання Обчислюємо масу мила за формулою:
𝑚(олії)
𝑚(мила) =
𝜔(олії)
6г
![]() 𝑚(мила) = = 106г
𝑚(мила) = = 106г
0,0566 Відповідь: m(мила) = 106 г.
Задача 8
Щоб зрізані квіти краще зберігались, їх ставлять у 7% розчин цукру. Визначте масу розчину, якщо для його приготування

Розв’язання
Обчислюємо масу розчину:
𝑚![]()
𝜔(р−ну)
100% ∙ 24г
𝑚(р − ну) = ![]() = 342г
= 342г
7%
Відповідь: m(р-ну) = 342 г.
Задача 9
 Для обробки елементів дерев’яних будинків застосовують 4 % розчин натрій фториду. Визначте масу розчину, в якому міститься натрій фторрид масою 85 г. Дано: m(NaF) = 85г ω(NaF) = 4% m(р-ну) — ?
Для обробки елементів дерев’яних будинків застосовують 4 % розчин натрій фториду. Визначте масу розчину, в якому міститься натрій фторрид масою 85 г. Дано: m(NaF) = 85г ω(NaF) = 4% m(р-ну) — ?
Розв’язання
1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
𝑚(речовини)
𝜔(речовини) = %
(
2) Розчиненою речовиною у даному розчині є питна сода. Позначаємо масу розчину — x. Підставляємо значення:
85г 85г
4% = ![]() ∙ 100%, х =
∙ 100%, х = ![]() ∙ 100%, х = 2125г х 4%
∙ 100%, х = 2125г х 4%
Відповідь: m(р-ну) = 2125 г.
Задача 10
Юний хімік вирішив для своїх експериментів одержати концентровану сульфатну кислоту. Знайшовши в автомагазині електроліт для акумулятора, що являє собою 30 % розчин цієї кислоти, він прийшов додому й почав випарювати з електроліту воду. Яку масу електроліту він узяв, якщо в результаті отримав 250 г 98 % розчину кислоти?
 Дано: ω(поч. р-ну) = 30 % , або 0,3 m (кiнц. р-ну) = 250 г ω(кiнц. р-ну) = 98 % , або 0,98 m(поч. р-ну) — ?
Дано: ω(поч. р-ну) = 30 % , або 0,3 m (кiнц. р-ну) = 250 г ω(кiнц. р-ну) = 98 % , або 0,98 m(поч. р-ну) — ?
Розв’язання
1. Обчислюємо масу кислоти в кінцевому розчині:
𝑚(к − ти) = 𝜔(к𝑖нц. р − ну) ⋅ 𝑚(к𝑖нц. р − ну)
=
0,98 ⋅ 250 = 245г
2. Обчислюємо масу початкового розчину:
𝑚(к − ти) 245г
𝑚(поч. р − ну) = ![]() =
=
𝜔(поч. р − ну) 0,3 = 816,7г
Відповідь: 𝑚(поч. р-ну) = 816,7 г.
Задача 11
Ортофосфатну кислоту використовують у виробництві добрив, антикорозійних покриттів, у харчовій промисловості. Скільки грамів розчину ортофосфатної кислоти можна приготувати з 5 г кислоти з масовою часткою речовини 10 %? Дано:
ω(H3PO4) = 10% m(p.p.)(H3PO4) = 5 г m(р-ну) — ?
Розв’язання
1)Записуємо формулу для обчислення 9 масової частки розчиненої речовини:
m(р.p.)
𝑚(р. 𝑝. )
𝜔(р. 𝑝. ) = ![]() %
%
2)Обчислюємо масу розчину:
𝑚(р. 𝑝. )
𝑚![]() %
%
5г
𝑚 ![]() 50г
50г
Відповідь: можна приготувати 50 г розчину.
Задача 12
В одній тонні води Світового океану міститься 7 мг золота. Сукупна ж маса цього дорогоцінного металу у водах всіх океанів складає 10 млрд. тонн. Визначити, яку сукупну масу становлять води океанів?
Дано:
m1(вода) = 1т m1 (золото (Au)) = 7 мг m2 (Au) = 10 млрд. т m2(води) — ?
Розв’язання
Переведемо маси в кілограми:
m1 (води) = 103 кг m1(Au) = 7⋅10 6 кг m2(Au) = 1010 кг Складемо пропорцію:
103 кг (води) — 7-10-6 кг Au х кг (води) — 1010 кг Au
х ![]()
![]() кг
кг
Відповідь: 14,29 ∙ 1019кг.
Задача 13
У медицині застосовують водні розчини натрій хлориду. Зовнішньо: для ванн, обтирань, полоскань та при захворюваннях
𝑚(води) = 255млх ⋅ 1гмл = 255г 3) Обчислюємо масу розчину: 𝑚(розчину) = 𝑚(розч. реч. ) + 𝑚(води) 𝑚(розчину) = 14,6г + 255г = 269,6г
1.3. Задачі на обчислення маси розчиненої речовини |
Задача 1
Яку масу кухонної солі потрібно взяти для консервування огірків, якщо маса розчину 500 г, а масова частка кухонної солі 4 %?

1)Підставимо формулу для розв’язку за дачі:
𝑚(речовини)
𝜔(речовини) =%
![]() (
(
2)З формули знайдемо масу речовини
(солі):
𝑚(речовини) = 𝜔(речовини)𝑚(розчину) =
5000,04 = 20г
Відповідь: m(солi) = 20 г.
Задача 2
Натрій карбонат (кальцинована сода) входить до складу відбілювача для білих тканин «Персоль O2 ». Обчисліть масу цієї солі в розчині масою 200 г з масовою часткою соди 30 %.

Розв’язання
Обчислюємо масу розчиненої речовини (соди) в розчині за формулою:
𝜔(речовини) ![]() % →
% →
𝑚(розчину)
𝑚(р − ни) = 𝜔(р − ни) ⋅ 𝑚(р − ну) m(Na2CO3) = 0,3 ⋅ 200 г = 60 г Відповідь: m(Na2CO3) = 60 г.
Задача 3
При опіках, виразках, тріщинах та пролежнях використовують 8 % мазь таніну. Обчисліть масу таніну, необхідну для приготування 750 г такої мазі.
 Дано: ω(танiну) = 8% (0,08) m(мазi) = 750 г m(танiну) — ?
Дано: ω(танiну) = 8% (0,08) m(мазi) = 750 г m(танiну) — ?
Розв’язання
1) Записуємо загальну формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(розч. реч. )
𝜔(розч. речовини) =%
![]() ( 2) Обчислюємо масу розчиненої речовини за формулою:
( 2) Обчислюємо масу розчиненої речовини за формулою:
𝑚(розч. реч. )
𝜔(розч. речовини) ∙ 𝑚(розчину)
= ![]()
100%
𝑚(тан𝑖ну) = 0,08 ⋅ 750 = 60г
(якщо масова частка переведена, тоді на
100 % не ділимо) Відповідь: m(танiну) = 60 г.
Задача 4
При деяких захворюваннях в організм хворого вводять розчин хлористого натрію. Яку масу солі отримує організм хворого за 10 днів лікування, якщо щодоби крапельницею в організм вводять200 г розчину з масовою часткою діючої речовини 0,9 %?

Розв’язання
1) Обчислюємо масу солі у розчині за формулою:
𝑚(реч. )
𝜔(розч. речовини) = ![]() %
%
𝜔(𝑁𝑎𝐶𝑙) ∙ 𝑚(розч. )
𝑚(𝑁𝑎𝐶𝑙) =
100%
200г ∙ 0,9%
![]() 𝑚(𝑁𝑎𝐶𝑙) = = 1,8г
𝑚(𝑁𝑎𝐶𝑙) = = 1,8г
100%
2) Обчислюємо масу солі, який отримує хворий за 10 днів лікування:
𝑚(𝑁𝑎𝐶𝑙) = 1,8 ∙ 10 = 18г Відповідь: m(NaCl) = 18 г.
Задача 5
Мертве море одне з найсолоніших у світі. Обчисліть масу солі, яку можна отримати із морської води об’ємом 1 л (ρ = 1,4г/мл) з масовою часткою солі 0,337.

1)Знаходимо масу розчину:
𝑚
𝜌 = ![]() звідси𝑚 = 𝜌 ∙ 𝑉
звідси𝑚 = 𝜌 ∙ 𝑉
𝑉
𝑚(р − ну) = 1,4 г⁄мл 1000г = 1400г
2)Обчислимо масу солі, скориставшись формулою для масової частки розчиненої речовини:
𝑚(солі)
𝜔(солі) = ![]()
𝑚(розч. )
𝑚(сол𝑖) = 𝜔(сол𝑖) ∙ 𝑚(р − ну) = 0,337 ∙ 1400г
= 471,8г Відповідь: m(солi) = 471,8 г.
Задача 6
Яку масу кухонної солі потрібно взяти для консервування огірків, якщо маса розчину 500 г, а масова частка кухонної солі 4 %?
Дано:

 m(розчину) = 500 г ω(солi) = 4% = 0,04
m(розчину) = 500 г ω(солi) = 4% = 0,04
![]()
Розв’язання
1. Записуємо формулу:
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2. Обчислимо масу солі:
𝑚(сол𝑖) = 𝜔(сол𝑖) ⋅ 𝑚(розчину) =
500 ⋅ 0,04 = 20г
Відповідь: m(солi) = 20 г.
Задача 7
Постачальником енергії для нашого організму можуть бути жири, білки і вуглеводи, зокрема глюкоза. У розчині глюкози масою 120 г масова частка речовини становить 25 %. Обчисліть масу глюкози в розчині.

1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2) За формулою визначаємо масу глюкози:
𝑚(глюкози) = 𝜔(глюкози) ⋅ 𝑚(розчину)
𝑚(глюкози) = 0,25 ∙ 120г = 30г Відповідь: m(глюкози) = 30 г.
Задача 8
Золота каблучка 375 проби має масу 1,7 г. Визначте масу золота в даному ювелірному виробі.

Розв’язання
1)Записуємо формулу для визначення масової частки золота в сплаві:
𝑚(𝐴𝑢)
𝜔(𝐴𝑢) =%
![]() (
(
2)Визначаємо масу золота за фор мулою:
𝜔(𝐴𝑢) ∙ 𝑚(сплаву)
𝑚(𝐴𝑢) =
100%
37.5% ∙ 1.7г
![]() 𝑚(𝐴𝑢) = = 0,6375г
𝑚(𝐴𝑢) = = 0,6375г
100%
Відповідь: m(Au) = 0,6375 г.
Задача 9
У медицині використовується фізіологічний розчин (0,9 %-й розчин натрій хлориду) як дезін-токсикаційний засіб. Визначте масу натрій хлориду, яку треба розчинити у воді, щоб одержати 500 г фізіологічного розчину.

Розв’язання
1. Записуємо формулу для визначення масової частки натрій хлориду в розчині:
𝑚(𝑁𝑎𝐶𝑙)
𝜔(𝑁𝑎𝐶𝑙) = ![]() %
%
2. Визначаємо масу натрій хлориду за формулою:
𝜔(𝑁𝑎𝐶𝑙) ∙ 𝑚(р − ну)
𝑚(𝑁𝑎𝐶𝑙) =
100%
0,9% ∙ 500г
![]() 𝑚(𝐴𝑢) = = 4,5г
𝑚(𝐴𝑢) = = 4,5г
100%
Відповідь: m(NaCl) = 4,5 г
Задача 10
При виробництві ковбас і сирів, натрієва селітра (NaNO3) є барвником та консервантом, що перешкоджає поширенню збудника смертельного захворювання — ботулізму. В якості харчової добавки натрієва селітра позначається Е251. У великих дозах вона токсична для людини.
Яку масу натрій нітрату необхідно розчинити у 500 г води для одержання розчину з масовою часткою речовини 30 %?

1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
 𝑚(реч. )
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2) З формули знаходимо масу натрій нітрату:
𝑚(𝑁𝑎𝑁𝑂3) = 𝜔(𝑁𝑎𝑁𝑂3) ⋅ 𝑚(розчину) 3) Визначимо масу розчину: 𝑚(р − ну𝑁𝑎𝑁𝑂3) = 𝑚(𝐻2𝑂) + 𝑚(𝑁𝑎𝑁𝑂3)
4)Позначимо масу натрій нітрату через —
x.
5)Обчислюємо масу натрій нітрату, підставляючи дані за умовою задачі:
𝑥 = 0,3 ⋅ (500 + 𝑥)
𝑥 = 150 + 0,3𝑥
0,7𝑥 = 150
𝑥 = 214,29 Відповідь: m(NaNO3) = 214,29 г.
Задача 11
Фармацевтичний завод приготував 8 т 5 % розчину глюкози. Продавши 5 т цього препарату, завод отримав нове замовлення на виробництво 40 % розчину глюкози. Яку масу глюкози треба додати до розчину, що залишився, щоб виконати нове замовлення?
Дано:
 m(поч. р-ну) = 8 т ω(поч. р-ну) = 5%, або 0,05 m(р-ну пiсля продажу) = 3 т
m(поч. р-ну) = 8 т ω(поч. р-ну) = 5%, або 0,05 m(р-ну пiсля продажу) = 3 т
ω(кiнц. р-ну) = 40 % , або 0,4
m(глюкози) — ? Розв’язання
1) Обчислимо масу глюкози в розчині після продажу:
𝑚1(глюкози) = 𝜔(поч. р − ну) ⋅ 𝑚(р − нуп. п. )
=⋅
0,05 ⋅ 3т = 0,15т
2) Позначимо через х т масу доданої глюкози. Тоді отримаємо таке рівняння:
𝑚1(глюкози) + х
𝜔(кінц. р − ну) = ![]()
𝑚(р − нуп. п. ) + х
3) Підставляємо значення та знаходимо x:
0,15т + хт
0,4 = ![]() , звідсих = 1,75т
, звідсих = 1,75т
3т + хт
Відповідь: m(глюкози) = 1,75 т. Задачу можна розв’язати за правилом
«хреста».
Задача 12
Барій сульфат застосовують у виробництві паперу, гуми та білої фарби, а у медицині для рентгеноскопії шлунка («Барієва каша»). Визначте, яку масу барій сульфату необхідно взяти для приготування розчину солі масою 50 г із масовою часткою речовини 0,25.

Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини:
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2) Виходячи з формули обчислюємо масу речовини:
𝑚(𝐵𝑎𝑆𝑂4) = 𝑚(р − ну) ⋅ 𝜔(𝐵𝑎𝑆𝑂4)
Оскільки у даному випадку масова частка не у відсотках, а у частках від одиниці, то у формулі для обчислення «100 %» не наводиться.
3) Підставляємо дані:
𝑚(𝐵𝑎𝑆𝑂4) = 50г ⋅ 0,25 = 12,5г Відповідь: m(BaSO4) = 12,5 г.
Задача 13
Важка вода позначається формулою D2O (D — ізотоп Гідрогену 1H). Її вміст у природній воді становить ~ 0,02 %. Властивості важкої води помітно відрізняються від властивостей звичайної води, наприклад: tnjl =+3,8 °С, tкип =101,4 °C, ρ = 1,11г/см . Важка вода не підтримує життя тваринних і рослинних організмів.
Обчисліть масу важкої води у 250 г природної води.

1) Записуємо формулу визначення масової частки розчиненої речовини у розчині:
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2)  Обчислимо масу важкої води у природній за формулою:
Обчислимо масу важкої води у природній за формулою:
𝜔(речовини) ∙ 𝑚(розчину)
𝑚(реч. ) =
100%
0,02% ∙ 250г
![]() 𝑚(𝐷2𝑂) = = 0,05г
𝑚(𝐷2𝑂) = = 0,05г
100%
Відповідь: 𝑚(𝐷2𝑂)= 0,05 г
Задача 14
Бордоська суміш — це суміш мідного купоросу та вапна. Її використовують у садівництві для захисту садових та городніх рослин від грибкових шкідників. Визначити масу бордоської суміші, яку потрібно взяти для приготування 200 мл розчину з масовою часткою бордоської суміші 3 % (густина розчину дорівнює 1,33 г/мл).
 Дано: V(розчину) = 200 мл ω(бордоської сумiшi) = 3 % =
Дано: V(розчину) = 200 мл ω(бордоської сумiшi) = 3 % =
1) 𝑚(розчину) = 𝑉 ⋅ 𝜌 = 200мл ⋅
1,33 г⁄мл = 266г
2) т(бордоської сумiшi) = = т(розчину) ⋅ ω(бордоської сумiшi) = = 266г ⋅0,03 = 7,98г =8г Відповідь: маса бордоської суміші 8 г.
Задача 16
Гідроген перокcид — досить агресивна речовина. Проте відомо, що його використовують для відбілювання зубів. Руйнівна дія перекису по відношенню до зубної емалі знижується, якщо використовувати розведений розчин. Це позитивно впливає на ніжну оболонку ротової порожнини. Готують розчин так: 3 % розчин аптечного перокcиду Гідрогену масою 50 г розчиняють у 50 г води. Утворений розчин використовують для полоскання ротової порожнини. Потім полощуть зуби чистою теплою водою. Процедуру варто повторювати не частіше 1-2 рази на тиждень. Визначити скільки грамів гідроген перокcиду міститься у 200 г такого розчину.

Розв’язання
1) Напишемо формулу для визначення маси розчиненої речовини:
𝜔(речовини) ∙ 𝑚(розчину)
𝑚(реч. ) = ![]()
100%
2) Обчислимо масу перокcиду Гідрогену: М(𝐻2𝑂2) = 0,03 ⋅ 50 = 1,5г 3) Знайдемо масу розчину:
𝑚(розчину) = 50 + 50 = 100г
4) Знайдемо m(𝐻2𝑂2) у розчині: у 100 г р-ну міститься 1,5 г 𝐻2𝑂2 у 200 г р-ну міститься х г 𝐻2𝑂2 х = 3 г В 8ідповідь: m(𝐻2𝑂2) = 3 г.
Задача 17
Фізіологічний розчин (0,9 % водний розчин натрій хлориду) широко використовується в медицині. Його застосовують для розчинення лікарських препаратів у вигляді ін’єкцій та крапельниць. Знайдіть масу натрій хлориду, необхідну для приготування 200 г такого розчину, що продається в аптеці.


1)Записуємо формулу для визначення маси розчиненої речовини:
𝜔(речовини) ∙ 𝑚(розчину)
𝑚(реч. ) = ![]()
100%
2)Обчислимо масу натрій хлориду:
𝑚(𝑁𝑎𝐶𝑙) = 0,009 ⋅ 200 = 1,8г Відповідь: m(NaCl) = 1,8 г.
Задача 18
У медицині для ін’єкцій застосовують 10 % розчин кальцій хлориду як засіб, що поліпшує серцеву діяльність та зсідання крові. Обчисліть масу кальцій хлориду у 200 г розчину з масовою часткою речовини 10 %.
 Дано:
Дано:
m(р-ну) = 200 г
Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини:
𝑚(реч. )
𝜔(речовини) = ![]() %
%
2) З формули виводимо формулу для знаходження маси розчиненої речовини:
𝜔(𝐶𝑎𝐶𝑙2) ∙ 𝑚(розчину)
𝑚(𝐶𝑎𝐶𝑙2) = ![]()
100%
3) Підставляємо дані:
200г ∙ 10%
𝑚(𝐶𝑎𝐶𝑙2) ![]() 20г
20г
Відповідь: m(CaCl2) = 20 г.
|
1.4. Задачі на визначення маси й об’єму води |
Задача 1
Фізіологічний розчин — це штучно приготований водно-сольовий розчин, який використовується при переливанні крові, адже близький до її складу. Який об’єм води необхідний для приготування 1000 г фізіологічного розчину з масовою часткою кухонної солі 0,9 %?

Розв’язання
1) Запишемо формулу для розв’язання задачі:
𝜔(речовини) ![]() .
.
𝑚(розчину)
2) З формули знайдемо масу речовини(солі):
𝑚(речовини) = 𝜔(речовини) ⋅ 𝑚(розчину). 𝑚(сол𝑖) = 0,009 ∙ 1000г = 9г
3) Обчислимо масу води, яка містилась у розчині:
𝑚(води) = 𝑚(розчину) − 𝑚(речовини) =
1000г − 9г = 991г 4) Обчислимо об’єм води:
𝑚
𝑉 = ![]() ,
,
𝜌
звідси
991г
![]() 𝑉(𝐻2𝑂) = г = 991мл
𝑉(𝐻2𝑂) = г = 991мл
1 мл
Відповідь: V(H2O) = 991 мл.
Задача 2
Для побілки дерев готують рідку суміш, що складається із крейди, масова частка якої в розчині 19 %, мідного купоросу з масовою часткою 4 %, казеїнового клею масою 100 г та води. Обчисліть об’єм води, необхідний для приготування побілки масою 13,1 кг.

1) Записуємо загальну формулу для обчислення масової частки розчиненої речовини в розчині:
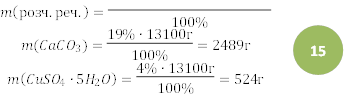 |
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
2) Обчислюємо масу СаСО3 та
CuSO4⋅5H2O у розчині за формулою:
𝜔(розч. реч. ) ∙ 𝑚(р − ну)
3) Обчислюємо масу води в розчині:
𝑚(𝐻2𝑂) = 13100г − (2489г + 524г + 100г) =
13100г − 626г = 12474г 4) Обчислюємо об’єм води в розчині:
𝑚
𝑉 = , звідси
𝜌
![]() 12474г 𝑉(𝐻2𝑂) = 1 г⁄мл = 12474або ≈ 12,5л
12474г 𝑉(𝐻2𝑂) = 1 г⁄мл = 12474або ≈ 12,5л
Відповідь: 𝑉(𝐻2𝑂) ≈ 12,5 л.
Задача 3
Хворому наклали гіпсову пов’язку масою 450 г. Після застигання пов’язка стала легшою на 8 %. Обчисліть масу води, що випарувалась, та масу пов’язки після

Розв’язання
1) Обчислимо масу води, скориставшись формулою:
𝑚(води)
𝜔(води) = ![]()
𝑚(розчину)
𝑚(води) = 𝜔(води) ⋅ 𝑚(р − ну) 𝑚(води) = 0,08 ⋅ 450г = 36г(𝐻2𝑂)
2) Обчислюємо масу пов’язки після висихання:
𝑚2(г𝑖псу) = 𝑚2(г𝑖псу) − 𝑚(води) =
450г − 36г = 414г
Відповідь: m(води) = 36 г; m(пов'язки) = 414 г.
Задача 4
У медицині використовують
фізіологічний розчин, що являє собою розчин кухонної солі з масовою часткою 0,85 %. Обчисліть масу солі й об’єм води, потрібний для приготування цього розчину масою 250 г.  Дано:
Дано:
Розв’язання
1) Обчислимо масу солі, скориставшись формулою для масової частки розчиненої речовини:
𝑚(солі)
𝜔(солі) = ![]()
𝑚(розчину)
𝑚(сол𝑖) = 𝜔(сол𝑖) ⋅ 𝑚(р − ну) 𝑚(сол𝑖) = 0,0085 ⋅ 250г = 2,13г
2) Знаходимо масу води, що потрібно для розчину:
𝑚(води) = 𝑚(р − ну) − 𝑚(сол𝑖) =
250г − 2,13г = 247,87г
3) Обчислимо об’єм води, якщо ρ(води) =
1 г/мл
𝑉(води) = 𝜌(води) ⋅ 𝑚(води) =
1гмл ⋅ 247,87г = 248мл
Відповідь: m(солi) = 2,13 г; V(H2O) = 248 мл.
Задача 5
У харчовій промисловості як приправу для страв уживають розчин оцтової кислоти з масовою часткою 0,09. Яку масу концентрованої оцтової кислоти з масовою часткою 0,8 (оцтової есенції) і води потрібно для приготування розчину масою 600 г?

Розв’язання
1) Обчислимо масу кислоти, що міститься у розчині з масовою часткою 0,09:
𝑚(𝑝. 𝑝. ) = 𝜔2(𝑝. 𝑝. ) ⋅ 𝑚2(р − ну)
𝑚(𝑝. 𝑝. ) = 0,09 ⋅ 600г = 54г
2) Обчислимо масу оцтової есенції, потрібної для приготування цього розчину:
𝑚(реч. )
𝜔(реч. ) =
![]() 𝑚(розчину)
𝑚(розчину)
𝑚(реч. )
𝑚1(р − ну) = 𝜔(р. р. )
 54г
54г
𝑚1(р − ну) = ![]() = 67,5г
= 67,5г
0,8
3) Обчислимо масу води для приготування розчину:
𝑚(води) = 𝑚2(р − ну) − 𝑚(р − ну) =
600г − 67,5г = 532,5г Відповідь: m1(р-ну) = 67,5 г; m(води) = 532,5 г.
Задача 6
Під час зберігання цукру масою 50 кг маса збільшилася на 700 г. Обчисліть масову частку води в цукрі, якщо початково він уже містив 2 % води.

Розв’язання
1) Обчислимо масу води, що містилась початково в цукрі, скориставшись формулою:
𝑚(води)
𝜔(води) = ![]()
𝑚(розчину)
𝑚(води) = 𝜔(води) ⋅ 𝑚1(цукру) 𝑚(води) = 0,02 ⋅ 50кг = 1кг(1000г)
2) Обчислимо масу цукру після вбирання води:
𝑚2(цукру) = 𝑚1(цукру) + ∆𝑚(води)
𝑚2(цукру) = 50000г + 700г = 50700г
3) Обчислимо загальну масу води в цукрі:
𝑚2(води) = 𝑚(води) + ∆𝑚(води) 𝑚2(води) = 1000г + 700г = 1700г
4) Обчислимо масову частку води, що ввібрав цукор:
𝑚2(води)
𝜔2(води) = 𝑚![]() 2(цукру) Відповідь: ω2(води) = 0,034 (3,4 %).
2(цукру) Відповідь: ω2(води) = 0,034 (3,4 %).
Задача 7
Майже в кожному домі є ртутний термометр. Та якщо його пошкодити, пари ртуті можуть викликати такі симптоми: головний біль, нудоту, слабкість та підвищення температури тіла. Саме тому важливо правильно обробляти забруднені ртуттю місця. Для цього до 5 л води додають 400 г мила. Потім додають 5,5 кг 9 %-го розчину соди. Обчисліть масову частку мила та об’єм води в утвореному розчині. Який об’єм води необхідно взяти для приготування 20 кг такої суміші?
 Дано: V1 (H2O) = 5 л (5000 мл) m1 (мила) = 400 г m2 (р-ну) = 5,5 кг (5500 г) ω2(Na2CO3) = 9% (0,09) m3 (р-ну) = 20 кг (20 000 г) ω(мила в утвор. роз-нi) — ? V3(H2O) — ?
Дано: V1 (H2O) = 5 л (5000 мл) m1 (мила) = 400 г m2 (р-ну) = 5,5 кг (5500 г) ω2(Na2CO3) = 9% (0,09) m3 (р-ну) = 20 кг (20 000 г) ω(мила в утвор. роз-нi) — ? V3(H2O) — ?
Розв’язання
1) Записуємо загальну формулу для обчислення масової частки розчиненої речовини в розчині:
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
2) Обчислюємо масу Na2CO3 в другому розчині за фор мулою:
𝜔(розч. реч. ) ∙ 𝑚(р − ну)
𝑚(розч. реч. ) = ![]()
100%
𝑚2(𝑁𝑎2𝐶𝑂3) = 0,09 ⋅ 5500г = 495г
3) Обчислюємо масу 𝐻2𝑂 у першому та другому розчинах:
𝑚1(𝐻2𝑂) = 𝑉(𝐻2𝑂) ⋅ 𝜌(𝐻2𝑂) = 5000мл ⋅ 1 г⁄мл
= 5000г
𝑚2(𝐻2𝑂) = 5500г − 495г = 5005г 4) Знайдемо масу першого розчину:
𝑚1(р − ну) = 𝑚1(мила) + 𝑚1(𝐻2𝑂) =
400г + 5000г = 5400г
5) Знаходимо масу розчину, що утворився:
𝑚утво.(р − ну) = 𝑚1(р − ну) + 𝑚2(р − ну) = 5400г + 5500г = 10900г
(10,9 кг)
6) Тепер можемо знайти масову частку мила в утвореному розчині:
400г
𝜔(мила) ![]() %
%
7) Знаходимо масу та об’єм (𝐻2𝑂) в утвореному розчині:
𝑚(𝐻2𝑂) = 𝑚1(𝐻2𝑂) + 𝑚2(𝐻2𝑂) = 5000г + 5005г = 10005г(≈ 10кг)
𝑉![]()
1г⁄мл
8) Складаємо пропорцію для обчислення об’єму води в розчині масою 20 кг: у 10, 9 кг розчину — 10 л (𝐻2𝑂) у 20 кг розчину — х л (𝐻2𝑂)
10 л⋅20 кг
10л ∙ 20кг
х ![]() 3л
3л
Відповідь: ω(мила) = 3,7%, 𝑚(𝐻2𝑂) = 18,3
л.
Задача 8
При отруєнні хлороводнем лікарі радять вдихати водяну пару або розпилений 2,5 %-й водний розчин питної соди (NaHCO3). Обчисліть масу соди та об’єм води, необхідні для приготування 250 г розчину.
Дано:
ω(NaHCO3) = 2,5% m(розч.) = 250 г m(NaHCO3) — ? V(H2O) — ?
Розв’язання 17
1) Знаходимо масу питної соди, потрібної для приготування розчину, за формулою:
𝜔(розч. реч. ) ∙ 𝑚(р − ну)
𝑚(реч. ) = ![]()
100%
250г ∙ 2,5%
𝑚(𝑁𝑎𝐻𝐶𝑂3) ![]() 25г
25г
2) Знаходимо масу води для приготування розчину:
𝑚(𝐻2𝑂) = 𝑚(розч. ) − 𝑚(реч. )
𝑚(𝐻2𝑂) = 250г − 6,25г = 243,75г 3) Знаходимо об’єм води за формулою:
𝑚
𝑉 = , звідси
𝜌
![]() 243.75г
243.75г
𝑉(𝐻2𝑂) = 1 г⁄мл = 243.75мл
Відповідь: m(NaHCO3) = 6,25 г, V(H2O) = 243,75 мл.
Задача 9
Для надання блиску волоссю використовують ополіскування розчином (40 °С) меду 2 рази на тиждень. У розчині масою
1040 г масова частка меду становить 3,8 %. Розрахуйте масу меду та об’єм води, необхідні для приготування такого розчину.
 Дано: m(розчину) = 1040 г
Дано: m(розчину) = 1040 г
масової частки розчиненої речовини у розчині:
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
2) Розчиненою речовиною у даному розчині є мед. Позначаємо масу меду — х.
Підставляємо значення:
𝑥
![]() %
%
х = 39,52 г
3) Оскільки маса розчину — це сума маси води та маси розчиненої речовини, то: 𝑚(𝐻2𝑂) = 𝑚(розчину) − 𝑚(речовини) Підставляємо значення:
𝑚(𝐻2𝑂) = 1040г − 39,52г = 1000,48г 4) Обчислюємо об’єм води за формулою:
𝑚
𝑉 = ![]()
𝜌
Густина води становить 1 г/мл.
Підставляємо значення:
1000,48г
𝑉(𝐻2𝑂) = ![]() 1 г⁄мл = 1000,48мл або приблизно 1 л.
1 г⁄мл = 1000,48мл або приблизно 1 л.
Відповідь: m(меду) = 39,52 г, V(води) = 1000,48 мл, або приблизно 1 л.
Задача 10
Для підняття вмісту вітамінів й цукру у полуниці в літній період варто проводити підживлення цих рослин 20% розчином K2SO4 (калій сульфату). Допоможіть садоводу визначити масу води, де буде розчинятись 900 г калій сульфату, для приготування підживлюючого розчину для полуниці.

1)Визначимо масу розчину:
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
𝑚(р − ну𝐾2𝑆𝑂4) ![]() 𝜔(𝐾2𝑆𝑂4)
𝜔(𝐾2𝑆𝑂4)
100% ∙ 900г
𝑚(р − ну𝐾![]() 4500г
4500г
2)Розрахуємо масу води, необхідну для приготування розчину:
𝑚(𝐻2𝑂) = 𝑚(р − ну𝐾2𝑆𝑂4) − 𝑚(𝐾2𝑆𝑂4)
𝑚(𝐻2𝑂) = 4500г − 900г = 3600г Відповідь: m(H2O) = 3600 г.
Задача 11
 При нежиті для промивання носових пазух, а також при інфекціях верхніх дихальних шляхів для полоскання або для інгаляції використовують 0,892 %-й фізіологічний розчин, який можна приготувати в домашніх умовах, узявши для цього 9 г солі, а також кип’ячену чи бутильовану воду. Визначте об’єм води, який необхідно взяти для приготування даного розчину.
При нежиті для промивання носових пазух, а також при інфекціях верхніх дихальних шляхів для полоскання або для інгаляції використовують 0,892 %-й фізіологічний розчин, який можна приготувати в домашніх умовах, узявши для цього 9 г солі, а також кип’ячену чи бутильовану воду. Визначте об’єм води, який необхідно взяти для приготування даного розчину.
𝑚(солі)
![]() 𝑚(р − ну) = 𝜔(солі)
𝑚(р − ну) = 𝜔(солі)
9г
𝑚(р − ну) = = 1009г
0,00892
2) Визначаємо масу води за формулою:
𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚(сол𝑖)
𝑚(𝐻2𝑂) = 1009г − 9г = 1000г 3) Визначаємо об’єм за формулою:
𝑚
𝑉 =
𝜌
![]() 1000г
1000г
𝑉(𝐻2𝑂) = 1 г⁄мл = 1000мл
Відповідь: V(H2O) = 1000 мл = 1 л.
Задача 12
Лаборант для виконання учнями практичної роботи приготував 280 г розчину, в якому масова частка солі становить 16 %. Скільки води потрібно додати до цього розчину, щоб отримати розчин з масовою часткою солі 3 %?

Розв’язання
1) Записуємо формулу для визначення маси розчиненої речовини у розчині:
𝜔(реч. ) ∙ 𝑚(р − ну)
𝑚1(реч. ) = ![]()
100%
16% ∙ 280г
𝑚![]() 8г
8г
2) Після того як лаборант додав до розчину воду, маса речовини не змінилася.
Тому:
𝑚(речовини)
𝑚![]() %
%
44,8г
𝑚![]() %
%
3) Розрахуємо масу води, необхідну для приготування розчину:
𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚(речовини)
𝑚(𝐻2𝑂) = 1493г − 44,8г = 1448,2г Відповідь: m(H2O) = 1448,2 г.
Задача 13
Формалін (40 % водний розчин формальдегіду) використовують як засіб для вичинки шкір, консервування анатомічних препаратів, для протруювання насіння з метою знищення личинок шкідників. Скільки потрібно формальдегіду і води, щоб виготовити 10 кг розчину?
Дано:
 m(розчину) = 10 кг ω(формальдегiду) = 40 % m (формальдегiду) — ? V(H2O)
m(розчину) = 10 кг ω(формальдегiду) = 40 % m (формальдегiду) — ? V(H2O)
— ?
Розв’язання 1) Обчислимо масу формальдегіду:
𝜔(реч. ) ∙ 𝑚(р − ну)
𝑚(реч. ) =
100%
40% ∙ 10кг
![]() 𝑚(формальдегіду) = = 4кг
𝑚(формальдегіду) = = 4кг
100%
2) Визначимо масу води: 𝑚(𝐻2𝑂) = 10кг − 4кг = 6кг(6000г) 3) Визначаємо об’єм за формулою:
6000г
𝑉(𝐻2𝑂) = 1![]() г⁄мл = 6000млабо6л
г⁄мл = 6000млабо6л
Відповідь: т(формальдегiду) = 4 кг,
𝑉(𝐻2𝑂) = 6 л.
Задача 14
Водний 0,9 % розчин натрій хлориду за сольовим складом, величиною рН та іншими властивостями, близькими до сироватки крові, називається фізіологічним. Його використовують внутрішньовенно в разі нестачі рідини в організмі хворого. Обчислити масу солі та об’єм води, необхідний для приготування 100 склянок фізіологічного розчину масою по 400 г.

 Дано: т1 (склянки) = 400 г 100 склянок ω(солi) = 0,9% m солi) — ? V(води) — ?
Дано: т1 (склянки) = 400 г 100 склянок ω(солi) = 0,9% m солi) — ? V(води) — ?
Розв’язання
1) Обчислимо масу розчину, який необхідно приготувати:
𝑚(р − ну) = 400г ⋅ 100 = 40000г
2) Обчислимо масу солі, скориставшись формулою для масової частки розчиненої речовини:
𝑚(солі)
𝜔(солі) = ![]()
𝑚(розчину)
𝑚(сол𝑖) = 𝜔(сол𝑖) ⋅ 𝑚(р − ну) 𝑚(сол𝑖) = 0,009 ⋅ 40000г = 360г
3) Знаходимо масу води, що потрібна для розчину:
𝑚(води) = 𝑚(р − ну) − 𝑚(сол𝑖) =
40000г − 360г = 39640г 4) Обчислимо об’єм води, якщо ρ(води) =
1 г/мл .
𝑚
𝑉 = ![]()
𝜌
39640г
![]() = 39640мл
= 39640мл
1 г⁄мл
Відповідь: m(солi) = 360 г, V(води) = 39 640 мл.
Задача 15
Для дослідження властивостей шлункового соку учень зі шкільної лабораторії взяв 30 г 10 % розчину хлоридної кислоти. Який об’єм води потрібно додати та яку масу штучного шлункового соку можна одержати, якщо відомо, що масова частка хлоридної кислоти в шлунку 0,5 %?  Дано:
Дано:
початковому розчині:
𝑚(к − ти) = 𝑚(поч. р − ну) ⋅ 𝜔(поч. р − ну) =
30г ⋅ 0,1 = 3г 2) Обчислимо масу кінцевого розчину:
𝑚(к − ти) 3г
𝑚(к𝑖нц. р − ну) = ![]() =
=
𝑚(к𝑖нц. р − ну) 0,005
= 600г
3) Обчислимо масу води, яку було додано:
𝑚(𝐻2𝑂) = 𝑚(к𝑖нц. р − ну) − 𝑚(поч. р − ну) =
600г − 30г = 570г
4) Обчислимо об’єм води:
𝑚 570г
𝑉(води) = ![]() = = 570мл
= = 570мл
𝜌 1 г⁄мл
Відповідь: V(H2O) = 570 мл; m(кiнц. р-ну) = 600 г.
Задача 16
Столовий оцет (9 % розчин оцтової кислоти) можна зробити і в домашніх умовах. Для цього потрібно взяти оцтову есенцію (70 % розчин оцтової кислоти) та розбавити її водою. Яку масу води потрібно додати до 250 мл (ρ = 1,0685 г/мл) оцтової есенції, щоб отримати столовий оцет?
 Дано: V(поч. р-ну) = 250 мл ρ(поч. р-ну) = 1,0685 г/мл ω(поч. р-ну) = 70 % , або 0,7 ω(кiнц. р-ну) = 9 % , або 0,09 m(𝐻2𝑂) — ?
Дано: V(поч. р-ну) = 250 мл ρ(поч. р-ну) = 1,0685 г/мл ω(поч. р-ну) = 70 % , або 0,7 ω(кiнц. р-ну) = 9 % , або 0,09 m(𝐻2𝑂) — ?
Розв’язання
1)Обчислимо масу початкового розчину:
𝑚(поч. р − ну) = 𝜌(поч. р − ну)
⋅ 𝑉(поч. р − ну) =
1,0685 г⁄мл ⋅ 250мл = 267,1г
2)Обчислимо масу кислоти в початковому розчині:
𝑚(к − ти) = 𝜔(поч. р − ну) ⋅ 𝑚(поч. р − ну) =
0,7 ⋅ 267,1 = 187г 3) Обчислимо масу кінцевого розчину:
𝑚(к − ти) 187г
𝑚(к𝑖нц. р − ну) = ![]() =
=
𝜔(к𝑖нц. р − ну) 0.09
= 2077,8г
4) Обчислимо масу доданої води:
𝑚(𝐻2𝑂) = 𝑚(к𝑖нц. р − ну) − 𝑚(поч. р − ну) =
2077,8г − 267,1г = 1810,7г Відповідь: m(H2O) = 1810,7 г.
Задача 17
 Коли консервують овочі у власному соку або шматочки фруктів у сиропі й потрібно зберегти їхню форму, щоб готовий продукт виглядав апетитно й акуратно, використовують розчин алюміній сульфату. А також за допомогою цієї сполуки очищають природну воду перед направленням у водопровід. Визначте масу та об’єм води, у якій необхідно розчинити алюміній сульфат масою 20 г, щоб одержати розчин з масовою часткою 20 %.
Коли консервують овочі у власному соку або шматочки фруктів у сиропі й потрібно зберегти їхню форму, щоб готовий продукт виглядав апетитно й акуратно, використовують розчин алюміній сульфату. А також за допомогою цієї сполуки очищають природну воду перед направленням у водопровід. Визначте масу та об’єм води, у якій необхідно розчинити алюміній сульфат масою 20 г, щоб одержати розчин з масовою часткою 20 %.
![]() Дано:
Дано:

Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини:
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
2) Згідно з умовою задачі, нам відома маса речовини і масова частка, отже, знаходимо масу розчину:
𝑚(реч. )
𝑚(р − ну) = 100%
![]() 𝜔(реч. )
𝜔(реч. )
20г
𝑚(р − ну) = 100% = 100г
20%
3) Обчислимо масу води:
𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚
100г − 20г = 80г 4) Обчислимо об’єм води:
𝑚 80г
𝑉(води) = ![]() = = 80мл
= = 80мл
𝜌 1 г⁄мл
Відповідь: m(H2O) = 80 г, V(H2O) = 80мл. Задача 18
Обчисліть масу цукру та об’єм води, які необхідно взяти для приготування 10 кг хлібного квасу з масовою часткою цукру
0,02.

Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини:
𝑚(розч. реч. )
𝜔(розч. ![]() %
%
2) Записуємо формулу для визначення маси розчиненої речовини у розчині:
𝜔(реч. ) ∙ 𝑚(р − ну)
𝑚![]()
𝑚(цукру) = 𝑚(розчину) ⋅ 𝜔(цукру) =
10кг ⋅ 0,02кг = 0,2кг 3) Обчислимо масу води:
𝑚(𝐻2𝑂) = 𝑚(розчину) ⋅ 𝑚(цукру) =
10кг − 0,2кг = 9,8кг 4) Обчислимо об’єм води за формулою:
𝑚 9800г
![]() 𝑉(води) = 𝜌 = 1 г = 9800млабо9,8л мл
𝑉(води) = 𝜌 = 1 г = 9800млабо9,8л мл
Відповідь: m(цукру) = 0,2 кг, V(H2O) =
9,8л.
Задача 19
Великі срібні вироби можна очистити від темного нальоту, використовуючи оцет. Беремо 6 % розчин оцту, нагріваємо його і фланелевою серветкою протираємо виріб. Яка маса оцту і води міститься у 500 г такого розчину?

Розв’язання
1) Обчислимо масу солі, скориставшись формулою для масової частки розчиненої речовини:
𝑚(солі)
𝜔(солі) =%
![]() (
(
𝑚(сол𝑖) = 𝜔(сол𝑖) ⋅ 𝑚(р − ну)
𝑚(сол𝑖) = 0,06 ⋅ 400г = 24г
2) Обчислимо масу води, що потрібна для розчину:
𝑚(води) = 𝑚(р − ну) − 𝑚(сол𝑖) =
400г − 24г = 376г
3) Обчислимо об’єм води, якщо ρ(води) =
1 г/мл
𝑚 376г
![]() 𝑉(води) = 𝜌 = 1 г = 376мл мл
𝑉(води) = 𝜌 = 1 г = 376мл мл
Відповідь: m(солi) = 24 г, V(води) = 376 мл.
Задача 20
При проведенні хімічних експериментів використовують кислоти різної концентрації. Якщо не дотримуватися правил техніки безпеки, кислота може потрапити в очі. Для нейтралізації кислоти слід промити їх 2 % розчином питної соди (NaHCO3). Яку масу води необхідно взяти, щоб приготувати 500 г такого розчину ?

Розв’язання
1) Напишемо формулу для визначення маси питної соди у розчині.
𝑚(розч. реч. ) = 𝜔 ⋅ 𝑚(р − ну)
2) ![]() За відомою масою розчину і його масовою часткою обчислимо масу питної соди.
За відомою масою розчину і його масовою часткою обчислимо масу питної соди.
𝑚(𝑁𝑎𝐻𝐶𝑂3) = 0,02 ⋅ 500г = 10г 3) Обчислимо масу води.
𝑚(води) = 𝑚(р − ну) − 𝑚(розч. реч. ) =
500г − 10г = 490г
Відповідь: m(води) = 490 г.
Задача 21
Натрієва селітра широко застосовується в сільському господарстві — в якості добрив. Який об’єм води необхідно додати до 20 г натрій нітрату, щоб отримати 2 % розчин? Дано:
Розв’язання
1) Записуємо формулу для обчислення масової частки розчиненої речовини:
𝑚(реч. )
𝜔(реч. ) =%
![]() ( 2) З формули знаходимо масу розчину:
( 2) З формули знаходимо масу розчину:
𝑚(реч. )
𝑚(р − ну) = 100%
![]() 𝜔(р. р. )
𝜔(р. р. )
20г
𝑚(р − ну) = 100% = 1000г
2%
3) Знаходимо масу води:
𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚(𝑁𝑎𝑁𝑂3) =
1000г − 20г = 980г 4) Знаходимо об’єм води:
ρ(води) = 1 г/мл
𝑚 980г
![]() 𝑉(води) = 𝜌 = 1 г = 980мл мл
𝑉(води) = 𝜌 = 1 г = 980мл мл
Відповідь: V(H2O) = 980 мл.
Задача 22
Калій хлорид (чи правильно сказати розчин) відіграє важливу роль в організмі людини. Він нормалізує кислотно-лужний баланс, регулює внутрішньоклітинний тиск, синтез білка, транспорт амінокислот, проведення нервових імпульсів, скорочення скелетних м’язів.
Обчисліть масу калій хлориду та об’єм води, які потрібно взяти для приготування 0,2 кг розчину з масовою часткою солі 0,03.
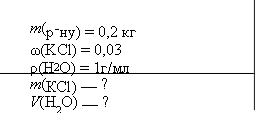 Дано:
Дано:
2) Обчислимо масу води в розчині: Розв’язання 𝑚(𝐻2𝑂) = 𝑚(р − ну) − 𝑚(𝐾𝐶𝑙) =
𝑚(𝐾𝐶𝑙) 200 − 6 = 194г
𝜔(𝐾𝐶𝑙) = 𝑚![]() (розчину) 3) За формулою розраховуємо об’єм води:
(розчину) 3) За формулою розраховуємо об’єм води:
![]()
1) За формулою обчислимо масу солі, яка 𝑉(𝐻2𝑂) = 𝑚𝜌 = 1941 гг = 194мл повинна бути в розчині:
𝑚(𝐾𝐶𝑙) = 𝜔(𝐾𝐶𝑙) ∙ 𝑚(р − ну) = Відповідь: m(KCl) = 6 г, млV(H2O) = 194 мл. 0,03 ⋅ 200 = 6г
2. ЗАДАЧІ З ХІМІЇ ПРИКЛАДНОГО, ВИРОБНИЧОГО ТА ЕКОЛОГІЧНОГО ЗМІСТУ ДЛЯ УЧНІВ 8 КЛАСУ
2.1. Приклади розв’язку та задачі до тем хімії: «Атоми. Молекули. Хімічні елементи. Молекулярні маси. Маси атомів. Молярні маса та об’єм»
Задача 1
Над Землею на висоті 20–30 км знаходиться шар озону O3, що убезпечує поверхню Землі від ультрафіолетових променів (випромінювання). Припустимо, що в середньому на будьякого жителя деякої країни у повітряному просторі належить по 140 моль озону. Скільки молекул та яка маса озону припадає в середньому на одного мешканця?
Дано: Розв’язання
![]() n(O3) =140 моль Для розв’язання задачі використовується рівняння, яке M(O3) = 48г/моль пов’язує між собою число молекул N(O3), кількість речовини NA = 6,02 1023 моль-1 n(O3) і сталу Авогадро NA:
n(O3) =140 моль Для розв’язання задачі використовується рівняння, яке M(O3) = 48г/моль пов’язує між собою число молекул N(O3), кількість речовини NA = 6,02 1023 моль-1 n(O3) і сталу Авогадро NA:
![]() N(O3) — ?
N(O3) — ?
m(O3 ) — ? 𝑛 𝑁𝐴 ,
звідки N(O3) = n(O3)⋅NA.
N(O3) = 140 моль⋅6,02⋅1023 моль-1 = = 8,43 1025 молекул. m(O3) = n(O3)⋅М(O3).
![]() M(O3) = 48г/моль.
M(O3) = 48г/моль.
![]() m(O3) = 140 моль⋅ 48 г/моль = 6720 г = 6,72 кг .
m(O3) = 140 моль⋅ 48 г/моль = 6720 г = 6,72 кг .
Відповідь: у повітряному просторі на кожного мешканця країни припадає 6,72 кг озону, або 8,43⋅1025 молекул O3.
Задача 2
Під час грози у атмосфері створюється певна кількість оксиду Нітрогену невідомого складу. Установлено, що маса 1 молекули такого оксиду Нітрогену склала 4,99⋅10-23 г. Потрібно визначити формулу оксиду.
|
Дано: |
Розв’язання |
|
m(NxOу) = 4,99⋅10-23 г NA = 6,02 1023 моль1 |
𝑀𝑟(𝑁𝑥𝑂𝑦) М𝑟(𝑁𝑥𝑂𝑦). M r = M. M(NxOy) = 30. Це відповідає нітроген(ІІ) оксиду монооксиду NO (М(NO) = 30 г/моль). |
|
NxOу — ? |
|
|
|
|
Відповідь: формула оксиду — NO.
Задачі для самостійного опрацювання та розв’язку:
6.
У воді для пиття виявлено залишки речовини, що має токсичний вплив на організм людини. На основі кількісного та якісного аналізу було нами встановлено, що масові частки елементів у цій речовини становлять: C - 55%, O - 14,8%, H - 4,2%, Cl - 27%. З'ясуйте молекулярну формулу такої речовини.
7. Рослини суші та Світового океану щороку виділяють під час фотосинтезу 320 млрд т кисню, що поповнює витрати цього газу у промисловості, енергетиці та на транспорті. Який об’єм кисню (за н. у.) виділяється щороку?

Знайдіть кількість речовини та масу катіонів Hg2+ у ставку. Чи є небезпечною ставкова вода, якщо об’єм води у ставку 80 м3, а санітарні норми передбачають уміст Hg2+ не більш ніж 0,01 г в 1 м3 води?
2.2. Приклади розв’язку та задачі до тем хімії: «Молярний об’єм газів. Кількісний склад складних речовин. Визначення формул речовин»
Задача 1
Карбон(ІІ) оксид (чадний газ) — небезпечний забруднювач атмосфери. Він з’єднується з гемоглобіном крові та перешкоджає потраплянню кисню до клітин. Викликає хвороби серцево-судинної системи, знижує активність роботи мозку. Через неповне згоряння природного газу щорічно на Землі утворюється 5⋅10 т цієї речовини. Визначте, який об’єм (н.у.) займе ця маса чадного газу.
![]() Розв’язання
Розв’язання
𝑚(𝐶𝑂)
![]() 𝑛(𝐶𝑂) = 𝑀(𝐶𝑂)
𝑛(𝐶𝑂) = 𝑀(𝐶𝑂)
𝑉(𝐶𝑂)
𝑛(𝐶𝑂) =
𝑉𝑚
Тобто 𝑚(𝐶𝑂) 𝑉(𝐶𝑂)
![]() =
=
𝑀(𝐶𝑂) 𝑉𝑚
Звідси
𝑉𝑚 ⋅ 𝑚(𝐶𝑂)
𝑉![]()
22,4 ⋅ 5 ⋅ 1014 л ∙ г ∙ моль
![]() 𝑉
𝑉![]()
Відповідь: чадний газ займе об’єм 400 км3 (н. у.).
Задача 2
Повітря, яким ми дихаємо, — це суміш газів, однак лише один з них забезпечує життєдіяльність людини. Розрахуйте об’єм, який займає (н. у.) порція цього газу, якщо вона містить 2,7⋅1022 молекул. Який це газ?
![]()
![]()
Задача 3
Велика кількість шкідливих речовин утворюється в результаті першої стадії промислового добування сульфатної кислоти — випалювання піриту, мінералу, склад якого виражається формулою FeS2. Визначте масові частки (у відсотках) заліза та сірки у піриті. Обчисліть масу сірки, яка міститься в 1 т піриту.
|
Дано: |
Розв’язання Спочатку визначимо масову частку кожного елемента, що входить до складу сполуки:
Останню величину можна розрахувати інакше: ω(S) = 100% − ω(Fe). ω(S) = 100 % − 47 % = 53 % . Тепер розрахуємо масу Сульфуру в 1 т піриту: m(S) = ω(S) |
|
m(FeS2 ) =1т Ar (Fe) =56 Ar (S) =32 Mr (FeS2 )=120 |
|
|
ω(Fe) — ? |
|
|
ω(S) — ? |
|
|
m(S) — ? |
|
|
Відповідь: у піриті ω(Fe) = 47 %; ω(S) = 53 %. Маса Сульфуру в 1 т піриту — 530 кг. |
|
Задачі для самостійного розв’язання
1.
Порівняйте в екологічному співвідношенні кабінети біології та хімії ліцею, якщо об’єм повітря кожного з кабінетів складає 600 м3. Обчисліть масу Карбону у повітрі кожного кабінету, враховуючи, що уміст вуглекислого газу (за об’ємом) у повітрі кабінету біології 0,03%, а кабінету хімії — 0,06 %. Як це пояснити?
2. За одну годину людина видихає 28 л СО2 (н. у.). Обчисліть кількість речовини та масу вуглекислого газу, який видихають члени вашої родини за добу.
3. Обчисліть об’єм хлору (н. у.), який використовується для знезараження 10 м3 води, якщо на кожен літр води витрачається 1 мг хлору. Напишіть рівняння реакції взаємодії хлору з водою і поясніть на чому ґрунтується його знезаражуюча дія. Хлор - небезпечна речовина, яка використовувалася як отруйний газ у Першій світовій війні. Розрахуйте який необхідно об’єм хлору (н. у.), щоб кількість молекул дорівнювала 2,056-10? Порахуйте масу такої кількості хлору.
4. Якщо спалити 1 млн тонн мазуту, то в атмосферу потрапляє 22,4 млн м3 (н. у.) сульфур(ІV) оксиду. Якщо сульфур(IV) оксид вловити фільтрами і переробити, можна одержати сульфатну кислоту й амоній сульфат. Напишіть рівняння відповідних реакції. Яку масу цих речовин можна одержати?
5. В період термічного розкладу деревини у печі з дефектним димоходом виникає суміш газів, включаючи карбон(IV) оксиду й менш токсичний карбон(IV) оксид. Маса 100 літрів (нормальних умов) такої газової суміші складає 181,2 грама. Визначіть об'єму кожного газу в суміші (н. у.).
6. Усі солі Кадмію сильно токсичні. Зрівняйте масові частки такого елементу в сульфаті Кадмію CdSO4, нітраті Кадмію Cd(NO3)2, хлориді Кадмію CdCl2 й бромідові Кадмію CdBr2 + сформуйте висновки, про найотруйнішу соль Кадмію.
7. Підводні човни для запасанням киснем та зв’язування карбон(ІV) оксиду застосовують натрій пероксид:
2Na2O2 +CO2 +H2O =Na2CO3 +O2 +2NaOH
Розрахуйте яку ж масу натрій пероксиду варто узяти, щоб 30-вмісний підводний човен з членами екіпажу тримався під водою до 3 діб. При цьому кожному з члену екіпажу необхідно до 600 л кисню на добу?
8. У 1000 л атмосферного повітря окрім кисню й азоту припадає близько 30 л (н. у.) карбон(IV) оксиду. Обчисліть масу і кількість такої речовини у класі кімнаті, що має розмір 8×15×4м.
9. Водень є екологічно чисте паливо, що не забруднює довкілля, бо під час його спалювання утворюється вода: 2H2 +O2 = 2H2O. Обчисліть об’єм (н. у.) кисню, який витрачається на спалювання 448 л водню, і масу води, яка при цьому утворюється.
10. Дефоліантами іменують речовини, що активізують штучний листопад. Ці речовини застосовують при машинному зборі урожаю різних культур – соняшнику, пшениці тощо. У склад одного з таких дефоліантів входить 33,3% хлору, 21,6% натрію, 45,1% кисню. Відшукайте найпростішу хімічну формулу такої речовини.
11. Який об’єм води додатково одержуватиме водне господарство міста, якщо на сучасному заводі з виробництва амоніаку витрата води на одержання однієї тонни амоніаку знизиться з 550 м3 до 500 м3, а потужність установки 3000 т амоніаку на добу?
12. ![]() Санітарний лікар у зразку води масою 0,5 кг визначив нітрати, масова частка яких становила 0,02 %. Чи можна вживати цю воду, якщо гранично допустима концентрація нітратів у воді становить 45,0 мг/л?
Санітарний лікар у зразку води масою 0,5 кг визначив нітрати, масова частка яких становила 0,02 %. Чи можна вживати цю воду, якщо гранично допустима концентрація нітратів у воді становить 45,0 мг/л?
20. Побутове сміття виділяє газ, макрокомпонентами якого є метан (40–70 %) і карбон(IV) оксид (30–60 %). Яка кількість теплоти виділиться в разі спалювання 2 т сміття, що містить 70 % метану, якщо під час згорання 1 моль метану виділяється 880 кДж теплоти? Поясніть, чи можна будувати електростанції на звалищах побутових відходів.
21. Автомобіль BMV Hydrogen-7 витрачає 4 л рідкого водню на 1 км шляху. Обчисліть об’єм (н. у.) кисню та масу води, які утворяться унаслідок використання 200 л рідкого водню. Поясніть чому водень є альтернативним видом палива й може використовуватися замість бензину. Яка небезпека існує в разі використання водню як палива?
2.3. Приклади розв’язку та задачі до тем хімії: «Розрахунки за ріннями хімічних реакції»
Розрахунок кількості речовини та маси реагентів і продуктів.
Розрахунок об’єму газоподібних реагентів та продуктів.
Теоретичний та практичний вихід продукту реакції. Масова доля домішок у речовинах.
Задача 1
Під час проведення рентгеноскопічного дослідження організму людини застосовують так звані рентгеноконтрастні речовини. Перед процедурою ренгену шлунку, пацієнт випиває суспензію важкорозчинного барій сульфату, що не пропускає рентгенівські промені. Обчисліть кількість речовини сульфатної кислоти й барій оксиду, що будуть необхідні при отриманні 100 г барій сульфату.
Дано: Розв’язання
![]()
![]() m(BaSO4) =100 г BaO+H2SO4 = BaSO4 +H2O M(BaSO4) = 233 г/моль 𝑁(𝐵𝑎𝑆𝑂4) 100 г ∙ моль 429моль.n(BaO) — ? n(H2SO4) — ? дорівнюють 1, кількість речовин BaSOЗгідно з коефіцієнтами рівняння реакції, які в нашому випадку 4, BaO та H2SO4 однакова:
m(BaSO4) =100 г BaO+H2SO4 = BaSO4 +H2O M(BaSO4) = 233 г/моль 𝑁(𝐵𝑎𝑆𝑂4) 100 г ∙ моль 429моль.n(BaO) — ? n(H2SO4) — ? дорівнюють 1, кількість речовин BaSOЗгідно з коефіцієнтами рівняння реакції, які в нашому випадку 4, BaO та H2SO4 однакова:
n(BaO) = n(H2SO4) = n(BaSO4) = 0,429 моль. Відповідь: необхідно по 0,429 моль барій оксиду та сульфатної кислоти.
Задача 2
![]() Перш ніж вилити в каналізацію рідкі відходи лабораторних робіт, які містять хлоридну кислоту, належить їх нейтралізувати лугом (наприклад, натрій гідроксидом) або кальцинованою содою (натрій карбонатом). Визначте маси гідроксиду і натрій карбонату, необхідних для нейтралізації відходів, які містять 0,46 моль HCl. Який об’єм газу (н. у.) виділиться під час нейтралізації вказаної кількості відходів содою?
Перш ніж вилити в каналізацію рідкі відходи лабораторних робіт, які містять хлоридну кислоту, належить їх нейтралізувати лугом (наприклад, натрій гідроксидом) або кальцинованою содою (натрій карбонатом). Визначте маси гідроксиду і натрій карбонату, необхідних для нейтралізації відходів, які містять 0,46 моль HCl. Який об’єм газу (н. у.) виділиться під час нейтралізації вказаної кількості відходів содою?
![]()
![]() Розв’язання
Розв’язання
Запишемо рівняння реакції:
HCl + NaOH = NaCl + H2O (1)
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑ (2)
Згідно з рівняннями реакцій, для нейтралізації заданої кількості HCl необхідно: n(NaOH) = n(HCl) = 0,46 моль
m(NaOH) = n(NaOH) ⋅M(NaOH).
Задача 3
Найважливіша проблема промислового виробництва азотних добрив — отримання так званого зв’язаного азоту. Сьогодні її розв'язують засобами синтезу амоніаку з водню і азоту. Який об’єм амоніаку (н.у.) ми можемо отримати при такому процесі, коли об’єм початкового водню відповідає 300 л, а практичний вихід продукту — 43 % від теоретично допустимого?
|
Дано: |
Розв’язання |
|
V(H2) =300 л η(NH3) = 43% = 0,43 |
Запишемо рівняння реакції: N2 +3H2 =2NH3 Об’єм амоніаку, який можна отримати з 300 л водню, складає:
|
|
V (NH3) — ? |
|
|
Відповідь: можна отримати 86 л (н. у.) амоніаку. |
|
Задачі для самостійного розв’язання
1. Дверцята витяжної шафи в хімічній лабораторії можуть бути вкриті білим нальотом хлориду амонію NH4Cl. Причина цього явища — постійна присутність в повітрі лабораторій амоніаку NH3 та хлороводню HCl. Розрахуйте кількість речовини та об’єм (н. у.) цих газів, з яких утворюється 5 г хлориду амонію.
2. Природний газ складається в основному з метану CH4, але в ньому присутні й домішки, наприклад отруйний гідроген сульфід H2S — до 50 г на 1 кг метану. Щоб видалити домішок H2S, можна окиснити його калій перманганатом у кислому середовищі до сірки. Розрахуйте масу сірки, яку можна таким чином виділити з 1 тонни природного газу. Розрахуйте також масу сульфатної кислоти, яку можна отримати із цієї сірки, якщо практичний вихід кінцевого продукту становить 72 %.
3. Видобуток вугілля із 4000 шахт у різних державах світу супроводжується забрудненням та викидами в атмосферу 17 млрд. кубометрів вуглекислого газу й 27 млрд.м3 метану. В результаті згорання1 моль метану виділилось 880 кДж енергії. Вирахуйте теплоту, що виділилась би під час згоряння шахтних викидів метану.
4. У присутності води корозія заліза на повітрі призводить до утворення ферум(ІІІ) метагі-дроксиду складу FeO(OH). Розрахуйте масу кородованого заліза, якщо під час корозії було отримано 12,5 моль вищевказаної речовини. Визначте об’єм (н. у.) кисню, який узяв участь у реакції.
5. Під час випікання печива як розпушувач тіста використовують питну соду (натрій гідрокарбонат), до якої додають оцтову кислоту. Під час реакції виділяється вуглекислий газ. Розрахуйте об’єм (н. у.) вуглекислого газу, який виділиться під час використання 1 чайної ложки (5 г) соди та надлишку оцтової кислоти.
6. З 1 т твердих побутових відходів утворюється до 100 м3 біогазу. Який об’єм кисню необхідно витратити для спалювання цього об’єму біогазу, якщо вміст метану в ньому становить 60 %?
7. Розрахуйте об’єм (н. у.) хлору, який би знезаразив 20 м3 води, якщо на кожний літр води витрачається 1 мг хлору. Напишіть рівняння реакції хлору з водою та поясніть, на чому ґрунтується знезаражувальна дія хлору.
8. Склад та наркотична дія «звеселяючого газу» (N2O) було відкрито англійським хіміком Гемфрі Деві на початку ХІХ ст. Щоб отримати цей газ, Деві використав реакцію термічного розкладу амоній нітрату, під час якої крім основних продуктів утворюються інші гази (наприклад, оксиди Нітрогену(ІІ) та (IV)). Розрахуйте практичний вихід N2O у відсотках від теоретично можливого, якщо маса амоній нітрату дорівнює 11,75 г, а об’єм отриманого
«звеселяючого газу» — 2,1 л (н. у.)
9. Добре відомо, що легкове авто забруднює викидами повітря: за кожні 10 км шляху до атмосфери потрапляє 196 г карбон(ІІ) оксиду і 30 г нітроген(ІІ) оксиду. Розрахуйте масу шкідливих речовин, які потрапляють до атмосфери під час поїздки на авто від міста до дачі, якщо заміський будинок розташований на відстані 80 км?
10. У разі 10-хвилинного вдихання повітря, вміст карбон(ІІ) оксиду в якому становить 5,7 мг/м3, настає смерть. Отруйна дія CO полягає в тому, що він з’єднується з гемоглобіном крові, внаслідок чого вона втрачає властивість перенесення кисню з легень до тканин. Основним джерелом викидів CO у довкілля є автомобільний транспорт. Запропонуйте шляхи його екологізації, тобто зниження вмісту карбон(ІІ) оксиду у відпрацьованих газах.
11. ![]() Теплова електростанція спалює за добу до 1000 т вугілля. У складі вугілля 84 % Карбону, 3,75 % Сульфуру, 5 % вологи, 2,5 % негорючих домішок. Яка повинна бути площа лісу, що міг би компенсувати втрати кисню, який витрачається на спалення вугілля, якщо 1 га лісу на добу виробляє 10 кг кисню?
Теплова електростанція спалює за добу до 1000 т вугілля. У складі вугілля 84 % Карбону, 3,75 % Сульфуру, 5 % вологи, 2,5 % негорючих домішок. Яка повинна бути площа лісу, що міг би компенсувати втрати кисню, який витрачається на спалення вугілля, якщо 1 га лісу на добу виробляє 10 кг кисню?
12. У загальному вигляді процес фотосинтезу виражається рівнянням:
6CO2 +6H2O =C6H12O6 +6O2 Встановлено, що 1 га дубового лісу продукує за рік близько 6,7 т кисню, березового — 5 т, соснового — 5,9 т. Яка маса глюкози при цьому утворюється?
2.4. Задачі виробничого та пізнавального змісту
Фізичні властивості основ.
Хімічні властивості лугів та нерозчинних основ.
Задача 1
Юний будівельник розпочав ремонт квартири з білування стелі та стін. Йому привезли замовлені матеріали: мішки з крейдою і паленим вапном. Під час транспортування етикетки з мішків були втрачені. Як з’ясувати, які речовини містяться у мішках?
Серед досліджуваних речовин крейда (СаСО3) і палене вапно (СаО). Якщо до зразків цих речовин долити трохи води, то крейда не розчиняється, а палене вапно бурхливо взаємодіє з водою з утворенням гашеного вапна:
𝐶𝑎𝑂 + 𝐻2𝑂 = 𝐶𝑎
Пояснення учні супроводжують демонстрацією дослідів. Задача 2
У кімнаті на стелі з’явилася іржава пляма. Господар прочитав, що для її виведення знадобиться розчин мідного купоросу (CuSO4⋅5H2O). Відмірявши необхідну кількість солі та води, він змішав усе в оцинкованому відрі, а потім пішов до крамниці за іншими матеріалами для ремонту. Коли він повернувся, то… Що ж він побачив?
Відро стало руйнуватися, бо відбулася реакція між мідним купоросом і цинком:
𝑍𝑛 + 𝐶𝑢𝑆𝑂4 = 𝑍𝑛𝑆𝑂4 + 𝐶𝑢
Мідь червоно-коричневим нальотом відклалася на стінках відра.
Поширеність у природі та використання оксидів, кислот, основ і середніх солей Використання оксидів
1. Алюміній оксид використовують:
- як сировину для виробництва алюмінію;
- для виробництва лазерів; з нього виготовляють різці для різання сталі, точильні камені;
- зневодненням алюміній гідроксиду отримують алюміній оксид, який має досить високу внутрішню поверхню (так звану активну поверхню). Такий алюміній оксид здатен поглинати гази, пари і речовини з розчинів. Він дістав застосування як адсорбент при очищенні різних сполук.
2. Нітроген(І) оксид застосовується для знеболення при хірургічних операціях.
3. Ферум(ІІІ) оксид (Fe2O3), ферум(ІІ, ІІІ) оксид (Fe3O4) — сировина для виплавки чавуна і сталі. Найпотужніші поклади залізних руд зосереджені на Криворіжжі.
4. Кальцій оксид, негашене вапно (CaO) здавна використовувався у будівництві для скріплення каменів і цегли. Зазвичай із негашеного вапна (кипілки) при додаванні води отримували гашене вапно:
𝐶𝑎𝑂 + 𝐻2𝑂 = 𝐶𝑎
Це так зване гідратаційне тверднення. Продукт реакції — гашене вапно, розчинне гірше від негашеного. А це достатня умова для утворення міцного скріплення.
5. ![]() Манган(IV) оксид (MnO2) — піролюзит. Найбільші поклади цього мінералу зосереджені в Україні (м. Марганець Дніпропетровської області). Майже 95 % його витрачається на розкиснення і десульфурацію чавуну та сталі й на добавки у спеціальні сталі, які набувають таких цінних властивостей, як корозійна стійкість, зносостійкість, твердість.
Манган(IV) оксид (MnO2) — піролюзит. Найбільші поклади цього мінералу зосереджені в Україні (м. Марганець Дніпропетровської області). Майже 95 % його витрачається на розкиснення і десульфурацію чавуну та сталі й на добавки у спеціальні сталі, які набувають таких цінних властивостей, як корозійна стійкість, зносостійкість, твердість.
6. Вуглекислий газ (CO2) .
Харчова промисловість — основний споживач вуглекислого газу. Цей оксид використовується для газування охолоджувальних фруктових напоїв та газованої води.
ü Вуглекислий газ застосовується у виробництві розпушувачів тіста (амоній карбонату).
ü Для виробництва такого мінерального добрива, як карбамід (сечовина), витрачаються великі кількості цієї речовини.
ü Твердий вуглекислий газ — це сухий лід. Він використовується як чудовий холодильний агент, охолоджувальна здатність якого у 2 рази вища, ніж у звичайного льоду. Це особливо цінно для успішного довготривалого зберігання та транспортування продуктів, які швидко псуються.
ü Сухий лід використовують для випробовування виробів та приладів, які призначені для роботи в «царстві холоду»: Арктиці, Антарктиці, стратосфері.
ü Сухий лід знаходить застосування для викликання штучних опадів.
У повітрі, яке містить водяні пари у концентраціях, близьких до насичених, при невеликому охолодженні утворюється туман або хмара, які докорінним чином змінюють властивості повітря й умови обміну теплом між ґрунтом і атмосферою. Можна використати досить високу чутливість атмосфери до деяких домішок у надзвичайно малих кількостях. Кількох сотень грамів твердого вуглекислого газу досить, щоб 1 км3 переохолодженої хмари, яка містить близько 1000 тонн води, перетворився на кристалічний стан і розсіявся.
Це відкрило широкі можливості перетворення деяких атмосферних явищ розсіювання туманів і хмар, отримання додаткових опадів і, врешті-решт, зміни розвитку купчастих хмар. Таким способом розсіюють хмари на багатьох льотовищах і отримують додаткові опади у посушливих районах.
Цікаві результати впливу сухого льоду на потужні купчасті хмари з метою попередження граду. З допомогою ракет у хмари закидаються речовини, які викликають перекристалізацію частини хмари. Це викликає опади на ранній стадії розвитку хмари і тим самим послаблює її ріст. Невелика ракета швидко злітає вгору, потрапляє у велику купчасту хмару, в якій розвиваються процеси утворення граду. Хмара розсіюється, і замість граду проливається дощ, захищаючи від граду десятки тисяч гектарів виноградників і садів.
А коли взимку холодно і є загроза вимерзання озимих культур, то так можна викликати сніг, який вкриє поле і захистить майбутній урожай. На підводних човнах видихуваний командою вуглекислий газ проходить через 2 хімічних поглиначі газів. Ці установки всмоктують вуглекислий газ у рідину, яку потім зливають в океан.
7. Вода (H2O) — про використання цього оксиду ми вже неодноразово говорили на різних уроках і щоденно переконуємося в цьому.
Використання кислот
1. Борна кислота використовується:
ü у промисловості для виробництва спеціального скла й емалей; ü у медицині як антисептик.
2. Сульфатна кислота (H2SO4). Її недарма називають «хлібом» хімічної промисловості, бо без неї не обходиться величезна кількість інших хімічних виробництв. Зокрема: ü Близько 40 % сульфатної кислоти витрачається для виробництва мінеральних добрив.
ü У хімічній промисловості її застосовують для виробництва вибухівки, синтетичних мийних засобів, барвників, лікарських препаратів, штучного (віскозного) шовку.
ü Її застосовують у металургії та металодобуванні.
ü Сульфатною кислотою заповнюють свинцеві акумулятори. Недарма один із її сортів називають акумуляторною сульфатною кислотою.
ü Сульфатна кислота витрачається для очищення нафти і нафтопродуктів: тут вона допомагає звільнитися від шкідливих домішок — органічних сполук Сульфуру.
ü ![]() Сульфатна кислота найдешевша, найдоступніша й універсальна серед кислот — вона так само необхідна техніці, як метали і вугілля, нафта і цемент. Ось чому рівень промислового розвитку країн визначається за таким показником, як рівень виробництва сульфатної кислоти і темп його росту.
Сульфатна кислота найдешевша, найдоступніша й універсальна серед кислот — вона так само необхідна техніці, як метали і вугілля, нафта і цемент. Ось чому рівень промислового розвитку країн визначається за таким показником, як рівень виробництва сульфатної кислоти і темп його росту.
3. Хлоридна кислота (HCl) — один із найважливіших продуктів хімічної промисловості.
Вона використовується для:
ü Отримання хлоридів різних металів.
ü Синтезу хлорвмісних органічних продуктів.
ü У металургії нею обробляють руди.
ü У шкіряній промисловості хлоридною кислотою обробляють шкіру перед дубленням.
ü Її застосовують при травленні металів для видалення з них поверхневих оксидів. Така попередня обробка необхідна для паяння та лудження.
ü Хлоридна кислота — один із найважливіших реактивів у хімічних лабораторіях.
4. Нітратна кислота (HNO3) дістає широке застосування: ü У виробництві мінеральних добрив (амоній нітрат).
ü У виробництві аніліну і барвників на його основі.
ü У виробництві вибухових речовин (тринітро-гліцерину — динаміту, тринітроцелюлози — піроксиліну або бездимного пороху, тринітро-толуену — тротилу, толу та інших).
ü Разом з гідразином застосовується як компонент ракетного палива.
ü Нітратна кислота використовується у виробництві деяких полімерних матеріалів та в інших галузях народного госпо дарства.
5. Ортофосфатна кислота (H3PO4) дістає широке застосування у виробництві мінеральних добрив: амоній фосфату, нітрофосу та нітрофоски, подвійного суперфосфату.
2.5. Практика розрахунку задач екологічного змісту
Задача 1 «Кислота в шлунку»
Більшість процесів, що відбуваються в шлунку людини, потребують кислого середовища, яке створюється за рахунок виділення залозами хло-ридної кислоти. Розрахуйте масу хлоридної кислоти, що за день виділяється в складі шлункового соку об’ємом 2 л, густиною 1,006 г/мл, якщо масова частка хлоридної кислоти в ньому 0,5 %.
Додаткові питання
A. Яка застаріла назва хлоридної кислоти?
Б. Яка її роль у шлунковому соку?
B. Якими залозами шлунка виділяється?
Г. Які наслідки порушення виділення HCl?
|
Дано: |
Розв’язок 1) Розраховуємо масу шлункового соку: m = p*V m = 1,006 г/мл⋅2000 мл = 2012 г 2) Обчислюємо масу чистої HCl, що є в шлунковому соку: 2012 г — 100 % х г — 0,5 %
𝑥 06г |
|
V(HCl) = 2 л ρ(HCl) = 1,006 г/мл ω(HCl) = 0,5% |
|
|
m(HCl) — ? |
|
|
Відповіді на питання |
|
А. Соляна кислота, цю назву часто використовують у біології.
Б. Хлоридна кислота в складі шлункового соку виконує декілька функцій: активує ферменти, полегшує розщеплення білків, викликаючи їх денатурацію та набухання. Також HCl знищує патогенні бактерії, грибки, яйця глистів, перешкоджає розвитку гнильних процесів.
В. HCl виділяється обкладовими залозами шлунка.
Г. Збільшення секреції хлоридної кислоти в шлунку призводить до печії, гастриту, виразки. Зменшення секреції має наслідком взуття, діарею, погіршення апетиту, неприємний присмак у роті після ї0 ж 33і, погір6 ш ,0ення перетравлювання спожитих харчів.
Задача 2 «Порошок-рятівник»
Відомий медичний препарат «Атоксіл» є сучасним ентеросорбентом, що випускається у вигляді порошку силіцій оксиду в пакетиках по 2 грами. Розрахуйте масу і число атомів Силіцію та Оксигену в такому пакетику.
Додаткові питання
A. З якою метою цей препарат використовується? Б. Поясніть механізм його дії. B. Які ще речовини мають хімічну формулу SiO2?
![]() Розв’язок
Розв’язок
1) Знаходимо кількість силіцій оксиду:
2) Обчислюємо кількість атомів Силіцію та Оксигену: n(Si) = 0,003 моль 1 = 0,033 моль n(O) = 0,033 моль⋅2 = 0,066 моль
3) Визначаємо масу атомів Силіцію:
т= n⋅М
Mr (Si) = 28
m(Si) = 0,033 моль⋅28 г/моль = 0,924 г
4) Визначаємо масу атомів Оксигену:
т= n![]() М
М
M r(O) = 16 m(O) = 0,066 моль 16 г/моль = 1,056 г
5) Визначаємо число атомів Силіцію:
N = NA![]() n
n
N(Si) = 0,033 моль![]() 6,021023 моль-1 =
6,021023 моль-1 =
= 0,198661023 =198,661020 атомiв
6) Визначаємо число атомів Оксигену:
N = NA![]() n
n
N(O) = 0,066 моль![]() 6,021023 моль-1 =
6,021023 моль-1 =
= 0,397321023 =397,321020 атомiв Відповіді на питання
A. Препарат використовують при гострих кишкових інфекціях (наприклад, сальмонельоз, харчові отруєння). Також атоксіл можна використовувати для зовнішнього лікування гнійних ран, виразок та опіків.
Б. Механізм дії препарату полягає в адсорбції, тобто поглинанні з кишково-шлункового тракту різноманітних токсинів, алергенів та виведенні їх з організму разом з каловими масами. При зовнішньому використанні атоксіл адсорбує з рани токсини, продукти гниття рани, а тому сприяє її очищенню та заживленню.
B. SiO2 — кремнезем, головний компонент більшості гірських порід. У крові людини його концентрація 0,001 %. У природі кремнезем має декілька модифікацій, зокрема кварц та його різновиди гірський кришталь, опал, халцедон, тощо.
Задача 3 «Із запахом тухлих яєць»
![]() Невідома воднева сполука є у вулканічних газах та утворюється при гнитті білкових решток. Визначте її молекулярну формулу та вкажіть назву, якщо відносна густина її випарів за повітрям дорівнює 1,17, а невідомий елемент належить до 6-А групи. Запишіть реакцію горіння даної сполуки.
Невідома воднева сполука є у вулканічних газах та утворюється при гнитті білкових решток. Визначте її молекулярну формулу та вкажіть назву, якщо відносна густина її випарів за повітрям дорівнює 1,17, а невідомий елемент належить до 6-А групи. Запишіть реакцію горіння даної сполуки.
Додаткові питання
A. Де поширена дана речовина в природі?
Б. Чи є в організмі людини та як впливає на його функціонування?
B. Чому небезпечне насичення повітря даною сполукою? Г. Чи використовує дану сполуку людина?
|
Дано: |
Розв’язок 1) Знаходимо молярну масу сполуки, враховуємо, що загальна формула водневої сполуки елемента 6-А групи — H2E: M (H2E ) = Dпов. ( H2E ) = 1,17 2) Обчислюємо молярну масу невідомого елемента: M(E) = M(H2E)-M(H) = 34 г/моль - 2 г/моль = 32 г/моль Отже, невідомий елемент — Сульфур (S), а сполука — H2S (гідроген сульфід або сірководень). 3) Записуємо рівняння горіння сірководню: 2H2S+3O2 → 2H2O+2SO2 |
|
Dпов. (H2E) = 1,17 |
|
|
H2E — ? |
|
|
Відповіді на питання |
|
А. У природі сірководень виділяється при гнитті білкових решток та інших сірковмісних сполук, а також є у вулканічних газах. Це безбарвний газ, досить отруйний, має запах тухлих яєць. Є H2S у морських глибинах, що зумовлює специфічний запах морської води. У Чорному морі на глибині 150–200 м немає аеробних організмів саме через наявність сірководню.
Б. H2S — утворюється в організмі людини в мізерних кількостях і виконує ряд сигнальних функцій: сприяє розслабленню гладеньких м’язів, розширенню судин, захищає від серцево-судинних захворювань, бере активну участь у процесах пам’яті. Так, нейрофізіологи довели, що при хворобі Альцгеймера кількість H2S у мозку знижена, а при хворобі Дауна, навпаки, — підвищена. Ендокринологи дослідили, що при цукровому діабеті першого типу в клітинах підшлункової залози спостерігається надлишок H2S.
В. Сірководень у повітрі викликає ураження слизових оболонок очей і дихальних шляхів, хвороби дихальної системи, судоми, психічні порушення. Шкідлива дія зумовлена взаємодією з йонами металів з утворенням важкорозчинних сульфідів. Наприклад, H2S реагує з гемоглобіном крові й утворює нерозчинний ферум сульфід, що значно утруднює транспорт кисню по організму.
Г. Сірководень використовують при обробці шкіри, виробництві штучних волокон, гуми, очищення стічних вод.
Задача 4 «Цілюща морська вода»
Відомо, що морська вода — це не лише відмінний загарувальний засіб, але й джерело цінних хімічних речовин, наприклад кухонної солі. Так, добування кухонної солі з вод Світового океану становить третину від загального добування цієї речовини на нашій планеті.
Розрахуйте масу натрій хлориду, що можна отримати з 1 тонни морської води, якщо солоність становить 35 г/л (35 ‰), густина морської води 1,020 г/мл, а вміст натрій хлориду складає 85 % від загальної маси всіх солей.
Додаткові питання
A. Які корисні для нашого здоров’я речовини є в складі морської води? Чи можна вважати її своєрідним електролітом? Записати формули сполук. Б. Як дані сполуки впливають на організм людини?
B. Які цінні речовини людина добуває з морської води?
![]() Г. Які моря мають «найсолонішу» воду?
Г. Які моря мають «найсолонішу» воду?
|
Дано: m(мор.води) =1т η(солонiсть) = 35 г/л (35 ‰) ω(NaCl) = 85% ρ = 1,020 г/мл |
Розв’язок 1) Обчислюємо об’єм морської води:
2) Розраховуємо загальну масу солей, використовуючи пропорцію: 35 г — 1 л х1 г — 980,4 л
3) Знаходимо масу чистої кухонної солі, що можна добути з 1 тонни морської води: 34,3 кг — 100 % х2 кг — 85 %
|
|
m(NaCl) — ? |
|
|
Відповіді на питання |
|
А. Морська вода містить велику кількість солей, необхідних нашому організму елементів, йонів. Серед солей найбільший вміст саме натрій хлориду NaCl (85 %), також є магній хлорид MgCl2, магній сульфат MgSO4, кальцій сульфат CaSO4, натрій бромід NaBr. Багато сполук міститься у дисоційованому стані, утворюючи йони, тому морську воду можна вважати розчином слабкого електроліту. Серед йонів у морській воді найпоширеніші: Na+, Cl, Br-, Mg2+, Ca2+, 𝑆𝑂42−, I-, S2-, С𝑂32−, Zn2+, Cu2+, Mn2+; є також сполуки Селену (Se) та Силіцію (Si), сірководень (H2S).
Б. Купання в морській воді дуже корисне і сприяє загальному оздоровленню та зміцненню організму. При купанні в шкіру потрапляють електроліти, які поліпшують обмінні процеси, сприяють виведенню токсинів, шлаків, прискорюють процес схуднення, а морські хвилі дають ефект гідромасажу. Завдяки цінним речовинам морська вода позбавляє болів у суглобах, лікує артрити, артрози, ревматизм, покращує кровообіг, позбавляє нежитю, гаймориту, допомагає вилікувати бронхіт, прискорює процеси регенерації шкіри, сприяє омолодженню.
Позитивний ефект для здоров’я чинять практично всі складові морської води:
y Ca2+ — позбавляє депресії, допомагає загоювати рани, нормалізує зсідання крові; y Mg2+ — усуває набряки, розслаблює м’язи, покращує обмін речовин, знімає
нервозність, дратівливість, попереджає розвиток алергій; y Mn2+ — активізує утворення кісткової тканини; y S-2 — знищує збудників грибкових захворювань;
y I- — повертає молодість шкіри, знижує рівень холестерину, налагоджує роботу
щитовидної залози, покращує роботу мозку, зміцнює імунітет; y Zn2+ — попереджає розвиток пухлин, підтримує нормальне функціонування статевих
залоз, покращує імунітет; y Cu2+ — перешкоджає розвитку анемій; y Br- — заспокійливо діє на нервову систему;
![]() y Cl- — бере участь в утворенні шлункового соку та плазми крові; y Si4+ — покращує еластичність судин;
y Cl- — бере участь в утворенні шлункового соку та плазми крові; y Si4+ — покращує еластичність судин;
y Se2+ — захищає від онкологічних хвороб. В. З морської води, крім кухонної солі,
людина одержує гіпс, калійні добрива, бром. В Арабських Еміратах та Катарі, де немає запасів прісної води, проводять опріснення морської води, яка надалі використовується населенням. Г. «Найсолонішими» є Червоне море (42 ‰) та Мертве море (300 ‰).
Задача 5 «Надокучлива печія»
Підвищена кислотність шлункового соку — досить поширена проблема, з якою стикається кожен третій житель планети. Найчастіше вона проявляється печією та неприємним присмаком у роті. Сучасний медичний засіб «Алмагель» усуває дану проблему через наявність двох діючих речовин: алюміній гідроксиду та магній гідроксиду. Запишіть реакції, які відбуваються в шлунку при застосуванні даного препарату, та розрахуйте масу хлоридної кислоти, яка нейтралізується при вживанні 5 г препарату, якщо маса алюміній гідроксиду в цій дозі становить 2180 мг, а магній гідроксиду — 350 мг.
Додаткові питання
A. Запишіть рівняння необхідних реакцій у молекулярній, повній та скороченій йонних формах.
Б. У чому причина підвищення кислотності шлункового соку?
B. Які наслідки для здоров’я при підвищеній кислотності?
Г. Як нормалізувати кислотність шлункового соку без використання медичних препаратів?

3) Обчислюємо кількість магній гідроксиду:
Мr (Mg (OH)) = 58
![]() n(Mg(OH))= 0,350г =0,006моль 2 58 г/моль
n(Mg(OH))= 0,350г =0,006моль 2 58 г/моль
4) Знаходимо кількість хлоридної кислоти, яка нейтралізується алюміній гідроксидом:
![]()
х1 = 0,084 моль
5) Знаходимо кількість хлоридної кислоти, яка нейтралізується магній гідроксидом:
![]()
х2 =0,012 моль
6) Розраховуємо сумарну кількість хлоридної кислоти, яка нейтралізується: n(HCl) = 0,084 моль + 0,012 моль = 0,096 моль
7) Визначаємо масу даної хлоридної кислоти:
m(НСі) = n(НСl) ⋅М(НСl)
Мr(HCl) = 36,5
m(HCl) = 0,096 моль⋅36,5 г/моль = 3,5 г
Відповіді на питання
А. Al (OH)3 + 3HCl →AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl¯ → Al 3+ + 3Cl¯ + 3H2O
Al(OH)3 + 3H+ → Al 3+ + 3H2O
![]() Mg (OH)2 + 2HCl → MgCl2 + 2H2O
Mg (OH)2 + 2HCl → MgCl2 + 2H2O
Mg (OH)2 + 2H+ + 2Cl¯ → Mg2+ + 2Cl¯ + 2H2O
Mg (OH)2 + 2H+ → Mg2+ + 2H2O
Б. Кислотність шлункового соку збільшується при підвищеній секреції обкладовими залозами шлунку хлоридної кислоти. Причинами можуть бути стреси, нервові зриви, вживання занадто солоної, копченої, смаженої їжі, великої кількості кави, солодощів, а також паліннята вживання алкоголю. Також дану проблему можуть спровокувати хелікобактерії.
В. Наслідками цієї проблеми, крім печії і неприємного присмаку в роті, є біль у лівому підребер’ї, легка нудота, при відсутності лікування розвивається гастрит, а згодом — виразка.
Г. Якщо проблема не запущена, то нормалізувати кислотність шлункового соку можна, відмовившись від шкідливих звичок та дотримуючись дієти. Раціон харчування має містити супи, крупи, молочні продукти, відварені овочі та нежирне м’ясо. Від свіжого білого хліба, булочок, солодощів, газованих напоїв, копченостей та гострих страв варто відмовитись.
Задача 6 «Алкогольні проміле»
Відомо, що поширеною причиною ДТП, злочинів, асоціальної поведінки є зловживання алкогольними напоями. Визначте ступінь алкогольного сп’яніння (концентрацію алкоголю в організмі ‰) чоловіка масою 70 кг, що випив 300 мл коньяку, з об’ємною часткою спирту 42%, густина етанолу 0,79 г/мл.
Додаткові питання
A. Поясніть, чому в стані алкогольного сп’яніння людина не може контролювати власну поведінку.
Б. Як алкоголь виводиться з організму людини?
B. Які органи зазнають негативного впливу етанолу?
Г. Поміркуйте, чому зловживання алкогольними напоями є не лише медичною проблемою, а й соціальною.
Дано: Розв’язок
m =70 кг 1) Розраховуємо масу рідини в тілі людини, враховуючи, що вода Vкон. =300 мл складає 60 %:
![]() ω(C2H5OH) = 42 % m =70 кг⋅0,6 = 42 кг ρ(C2H5OH) = 0,79 г/моль 2) Визначаємо об’єм етилового спирту у випитому коньяку: ω‰ — ? 300 мл — 100 % х — 42 %
ω(C2H5OH) = 42 % m =70 кг⋅0,6 = 42 кг ρ(C2H5OH) = 0,79 г/моль 2) Визначаємо об’єм етилового спирту у випитому коньяку: ω‰ — ? 300 мл — 100 % х — 42 %
300мл ∙ 42%
𝑥
3) Обчислюємо масу даного спирту:
m = р ⋅ V = 0,79 г/моль ⋅ 126 мл = 99,54 г = 100 г 38
4) Обчислимо стандартну похибку, яка складає 10 % (ця частка алкоголю дуже швидко виводиться з організму): 100 г⋅0,1 = 10 г, тому маса спирту, яка потрапила в організм, дорівнює: m = 100г - 10г = 90г 5) Обчислимо концентрацію алкоголю в організмі (проміле):
𝑚(спирту) 90г
𝜔‰ = ![]() = = 2,14проміле
= = 2,14проміле
𝑚(рід. орг. ) 42кг
Відповіді на питання
А. Після споживання алкогольних напоїв значна його частина потрапляє в мозок і діє на нейромедіатори, викликаючи збудження, а потім гальмування. Це призводить до виникнення неприродного почуття радості, задоволення, а часто агресивності та імпульсивності. Поряд з цим контроль за поведінкою послаблюється і людина робить необдумані вчинки. У міру сп’яніння переважають гальмівні реакції, людина може заснути, втратити свідомість, часто виникають галюцинації. Крім того, етанол та етаналь (продукт окис-ення спирту) руйнують нервові клітини мозку, тому людина може нічого не пам’ятати. При регулярному споживанні алкогольних напоїв у людини розвивається алкогольне слабоумство, пошкоджуються психічні та інтелектуальні функції кори великих півкуль головного мозку.
Б. Незначна частина алкоголю (близько 10 %) після споживання досить швидко в незміненому вигляді виводиться з організму разом із сечею (2–4 %) та через легені з видихуваним повітрям (3–7 %). Решта етанолу під дією ферменту алкогольдегідрогенази у печінці окиснюється до оцтового альдегіду (етаналю), який з током крові розноситься до всіх органів, чинить токсичний вплив і зазнає подальшого розкладу під впливом ферментів, через цикл Кребса, до вуглекислого газу та води. Швидкість повного окиснення алкоголю і виведення його з організму залежить від кількості спожитого спирту, стану організму, генетичної схильності до вироблення необхідних ферментів (алкогольдегідрогенази) і складає в середньому від 4 до 15 годин.
В. Токсичного впливу етанолу та ацетальдегіду зазнають усі без винятку органи, але найбільше його накопичується у печінці та мозку. При систематичному вживанні алкоголю виникає захворювання алкоголізм. Відомо, що люди, схильні до пияцтва, скорочують власне життя на 15–20 років.
Г. Алкоголізм — відома соціальна проблема, адже демонструє поганий приклад безвідповідальності підростаючому поколінню, збільшує статистику злочинності, за якою стоять людські трагедії, поламані сім’ї, позбавлені батьківської турботи діти тощо. Людям, залежним від алкоголю, важко знайти пристойну роботу, вони часто позбавлені поваги людей і близьких. У періоди загострення хвороби, через важку форму алкогольної інтоксикації, може виникати «біла гарячка». У цей період у людини виникають галюцинації, затьмарення свідомості, дезорієнтація, підвищена агресивність. Такі хворі є особливо небезпечними для оточуючих і потребують термінової медичної допомоги.
Задача 7 «Корисні жири»
Важливою складовою харчового раціону людини є рослинні олії, що слугують джерелом незамінних жирних кислот. Визначте масу жирних кислот, що утворяться в кишечнику людини в результаті розщеплення 0,5 моль трилінолеату, якщо гідролізу піддалося 85 % даного жиру.
Додаткові питання
A. Поясніть, чому надходження ненасичених вищих карбонових кислот важливе для організму людини.
Б. Які наслідки для здоров’я нестачі лінолевої кислоти?
B. Які продукти варто споживати, аби організм не відчував нестачі незамінних жирних кислот?
Г. Які ферменти каталізують реакції розщеплення жирів у кишково-шлунковому тракті, яка роль жовчі в цьому процесі?
![]()
![]() Розв’язок n(C H O ) = 0,5 моль 1) Записуємо рівняння даної реакції:
Розв’язок n(C H O ) = 0,5 моль 1) Записуємо рівняння даної реакції:
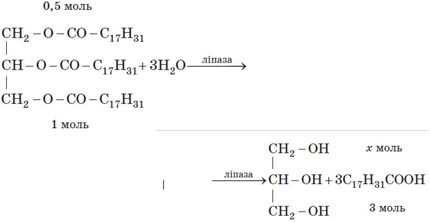
2) Визначаємо кількість лінолевої кислоти, яка утвориться при повному гідролізі:
0,5моль х
![]() =
=
1моль 3моль
х = 1,5 моль
3) Обчислюємо кількість утвореної вищої карбонової кислоти, враховуючи ступінь гідролізу; використовуємо пропорцію: 1,5 моль — 100 % у моль — 85 %
1.5моль ∙ 85%
𝑦 ![]() 275моль
275моль
4) Розраховуємо масу лінолевої кислоти, що утвориться в кишечнику: m(C17H31COOH) = n⋅М M = M r
M r (C17H31COOH) = 18 ⋅ Ar (C) + 32A r (H) + 2A r (O) =
= 1218 + 1⋅32 + 16⋅2 = 280
m(C17H31COOH) = 1,275 моль⋅280 г/моль = 357 г
Відповіді на питання
A. Поліненасичені вищі карбонові кислоти (олеїнова, лінолева, ліноленова, арахідонова), відомі як вітамін F, є незамінними для організму людини, адже у ньому не синтезуються, але виконують життєво важливі функції: є джерелом енергії, регулюють метаболізм холестеролу, стабілізують рівень інсуліну і цукру в крові, беруть участь в утворенні гемоглобіну, призупиняють запальні процеси в тканинах, зміцнюють імунітет, зменшують прояв алергічних реакцій, регулюють рівень води в епітеліальних тканинах та їх похідних.
Б. Нестача лінолевої кислоти негативно впливає на стан здоров’я людини: погіршуються пам’ять і зір, порушується координація рухів і дрібної моторики, спостерігається затримка росту, випадіння волосся, погане загоювання ран, людина відчуває постійну спрагу та часто пітніє, за тривалої нестачі порушується робота серця, виникають артрити та артрози.
B. Ненасичені жирні кислоти є в жирних сортах морської риби (тунець, лосось, форель), соняшниковому та гарбузовому насінні, горіхах, соєвому маслі та практично у всіх видах рослинних олій.
Г. У шлунково-кишковому тракті жири розщеплюються з допомогою біологічних каталізаторів — ферментів групи ліпаз, що виділяються підшлунковою залозою. Розщепленню великих скупчень жирів допомагає жовч, яка виробляється печінкою і надходить у дванадцятипалу кишку. Жовч емульгує жири, тобто розбиває їх на менші краплинки (порції) та робить доступнішими для ліпаз.
Задача 8 «Ацетономічний синдром»
Ацетон часто виявляють у сечі хворих на цукровий діабет. Розрахуйте масову частку даної речовини в сечі певного пацієнта об’ємом 200 мл з густиною 1,030 г/мл, якщо кількість ацетону становить 0,008 моль.
Додаткові питання
A. До якого класу речовин належить ацетон, які ще має назви?
Б. Який його вплив на організм людини?
B. ![]() Назвіть основні причини утворення ацетону в організмі. Розв’язок
Назвіть основні причини утворення ацетону в організмі. Розв’язок
т = n⋅М
2) Обчислюємо масу розчину:
![]() 0.464г
0.464г
Відповіді на питання
А. Ацетон — це представник оксигеновмісних органічних сполук — кетонів; його ще називають пропанон (сучасна назва) або диметилкетон.
Б. Ацетон у дуже мізерних кількостях може бути в сечі здорових людей. Але збільшення його концентрації свідчить про ацетонурію — підвищення в сечі вмісту кетонових тіл. Наслідком цього є ураження клітин головного мозку, підвищення температури тіла, нудота,блювота, запаморочення, слабкість, судоми, отруєння організму. В. Причинами утворення кетонів в організмі людини є порушення обміну речовин, нестача травних ферментів, цукровий діабет, надмірне споживання гострої, копченої їжі, консервованих продуктів, надмірна фізична активність.
Задача 9 «Деталі криються в будові»
У побуті часто як харчові добавки використовують оцтову та амінооцтову кислоти. Доведіть за допомогою відповідних розрахунків, у якій зі сполук — оцтовій кислоті чи амінооцтовій кислоті — масова частка Карбону більша.
Додаткові питання
A. Як називають іще ці сполуки?
Б. До яких класів органічних сполук вони належать?
B. Чи подібні фізичні властивості даних речовин?
Г. Порівняйте застосування даних кислот людиною.
Дано: Розв’язок
![]() CH3COOH 1) Обчислюємо відносну молекулярну масу оцтової кислоти:
CH3COOH 1) Обчислюємо відносну молекулярну масу оцтової кислоти:
NH2CH2COOH Mr(CH3COOH) = 2Ar(C) + 4Ar(H) + 2Ar(O) =
= 12⋅2 +1⋅4+ 16⋅2 = 24 + 4+ 32 = 60
ω1(C) — ?
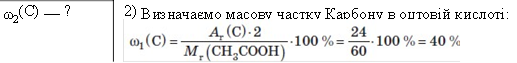
3) Обчислюємо відносну молекулярну масу амінооцтової кислоти:
Mr (NH2CH2COOH) = 2 ![]() A r (C) + 5
A r (C) + 5 ![]() A r (H) + 2
A r (H) + 2 ![]() A r (O) = = 12
A r (O) = = 12![]() 2 + 1+16
2 + 1+16![]() 2 + 14
2 + 14![]() 2 = 24 + 5 + 32 + 28 = 75
2 = 24 + 5 + 32 + 28 = 75
4) Визначаємо масову частку Карбону в амінооцтовій кислоті:
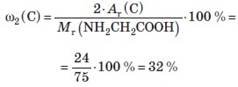
Отже, в оцтовій кислоті масова частка Карбону більша.
Відповіді на питання
A. Оцтова кислота (СН3СООН) має назву за номенклатурою IUPAC — етанова кислота; амі-нооцтова кислота — аміноетанова. Крім того, в біології, медицині, фармакології остання сполука відома під назвою гліцин.
Б. CH3COOH — це представник одноосновних насичених карбонових кислот, NH2CH2COOH — найпростіша амінокислота.
B. Оцтова кислота — рідина, що має характерний різкий запах і кислий смак; гліцин — біла дрібнокристалічна речовина, солодка на смак.
Г. Етанова кислота має дуже широке застосування: в побуті й харчовій промисловості як консервант, регулятор кислотності, смакова приправа (Е260), дезінфектор; у промисловості її використовують для виробництва полімерів, барвників, лікарських препаратів (аспірин), штучного волокна, кіноплівки тощо.
![]() Аміноетанова кислота входить до складу більшості білків, тому є постійно в організмі людини і в складі білкових продуктів, що споживає людина. Гліцин у вигляді медичного препарату призначають людям, які страждають від нервового перенапруження, поганого сну, після черепно-мозкових травм, адже він є нейромедіатором, що відповідальний за процеси гальмування в нервовій системі. Часто гліцин використовують як біодобавку і підсо-лоджувач.
Аміноетанова кислота входить до складу більшості білків, тому є постійно в організмі людини і в складі білкових продуктів, що споживає людина. Гліцин у вигляді медичного препарату призначають людям, які страждають від нервового перенапруження, поганого сну, після черепно-мозкових травм, адже він є нейромедіатором, що відповідальний за процеси гальмування в нервовій системі. Часто гліцин використовують як біодобавку і підсо-лоджувач.
Задача 10 «Енергетична картопелька»
Яку масу картопляного пюре має спожити підліток, щоб поповнити організм 45 г глюкози, якщо картопля містить 20 % крохмалю? Яку кількість енергії отримає школяр, якщо відомо, що при розщепленні 1 г вуглеводів виділяється 17 кДж енергії?
Додаткові питання
A. Як довести, що бульби картоплі містять крохмаль?
Б. Яких перетворень зазнає крохмаль в організмі людини?
B. Які продукти багаті на крохмаль?
Г. Яка роль глюкози в організмі людини?
![]() Розв’язок
Розв’язок
Записуємо рівняння реакції:
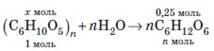
1) Обчислюємо кількість глюкози: n = m/M
М(C6H12O6) = 180 г/моль
n(C6H12O6) = 45 г / 180 (г/моль) = 0,25 моль
2) Використовуючи рівняння реакції, визначаємо кількість крохмалю, який гідролізував:
![]()
3) Обчислюємо масу крохмалю: т = n⋅М
M(C6H10O5)n = 162n г/моль m = 0![]() ,25 моль ⋅162n г/моль = 40,5 г
,25 моль ⋅162n г/моль = 40,5 г
𝑛
4) Складаємо пропорцію і знаходимо масу картопляного пюре: 40,5 г — 20 % х г — 100 %
40,5г ∙ 100%
х ![]() 5г
5г
5) Визначаємо кількість енергії, яку отримає школяр: г — 17 кДж
40,5 г — х кДж
40,5г ∙ 17кДж
х = ![]() = 720кДж
= 720кДж
1г
Відповіді на питання
A. ![]() Якісною реакцією на крохмаль є дія спиртового розчину йоду. Тому, крапнувши на картоплю йод, спостерігатимемо фіолетово-синє забарвлення, що свідчить про наявність крохмалю.
Якісною реакцією на крохмаль є дія спиртового розчину йоду. Тому, крапнувши на картоплю йод, спостерігатимемо фіолетово-синє забарвлення, що свідчить про наявність крохмалю.
Б. Крохмаль в організмі людини під дією ферментів амілаз розпадається до глюкози, яка всмоктується мікроворсинками тонкого кишечника і по кровоносних судинах надходить до клітин тіла.
B. Крохмаль — основний полісахарид у харчуванні людини. На крохмаль багаті різноманітні крупи (масова частка крохмалю в них 55-60 %), хлібобулочні вироби, печиво, різноманітні овочі.
Г. Глюкоза є основним джерелом енергії для клітин тіла, особливо м’язових і нервових. Її нестача спричиняє втому, зниження працездатності, головний біль, слабкість, запаморочення. Надлишок глюкози відкладається про запас у клітинах печінки у формі глікогену. У цілому засвоєння глюкози клітинами і її депонування в печінці регулюється гормоном інсуліном.
3. ЗАДАЧІ З ХІМІЇ ПРИКЛАДНОГО СПРЯМУВАННЯ ДЛЯ УЧНІВ 9 КЛАСУ
3.1. Задачі на визначення ступеню електролітичної дисоціації
Задача 1
Кислота ортофосфорна зареєстровано як харчову добавку Е338. Використовується у промисловості як регулятор кислотності для газованих напоїв («Пепсі» й «Кока-кола»). Дослідження науковців підтверджують, що ця харчова добавка Е338 вимиває кальцій з організму людини вже за першу годину після споживання такого напою.
Обчисліть ступінь дисоціації ортофосфатної кислоти, якщо за температури 20 °С у воді 40 молекул із 180 розпалися на йони. Які це електроліти?
|
Дано: n = 40 N =180 |
Розв’язання 1) Ступінь дисоціації речовини: 𝑛 𝛼 = 𝑁 2) Обчислюємо ступінь дисоціації: 𝛼 = |
|
α — ? |
|
|
Відповідь: α = 22 %. Ортофосфатна кислота є електролітом середньої сили. |
|
Задача 2
У лужних акумуляторах автомобілів як електроліт використовують розчин натрій гідроксиду з масовою часткою 20 %. Обчисліть ступінь дисоціації електроліту, якщо у 800 г розчину міститься 3,6 моль йонів.
|
Дано: m(р-ну) = 800 г ω(NaOH) = 20% = 0,2 n(йонiв) = 3,6 моль |
Розв’язання 1) Обчислюємо масу натрій гідроксиду за формулою: m(реч.) = m(р-ну) ⋅ ω(реч.) m(NaOH) = 800 г⋅0,2 = 160 г 2) Обчислюємо кількість речовини натрій гідроксиду за формулою: 𝑚 𝑛 = |
|
α — ? |
|
|
M(NaOH) = 40 г/моль |
|
n(NaOH) = 160 г / 40 (г/моль) = 4 моль
3) Запишемо рівняння електролітичної дисоціації натрій гідроксиду: NaOH → Na+ + OH-
4) З рівняння видно, що кожна молекула натрій гідроксиду дисоціює на 2 йони: n моль(дисоційованих) = n (йонiв дисоцiйованих)/2=
3,6 моль/2 = 1,8 моль 5) Обчислюємо ступінь дисоціації електроліту натрій гідроксиду за формулою:
𝑛(йонів)
𝛼 ![]() %
%
1,8моль
𝛼 ![]() %
%
Відповідь: α = 45 %.
Задача 3
У розчині оцтової кислоти міститься 0,002 г гідроген-іонів і недисоційованих молекул кількістю речовини 0,5 моль.
Який ступінь дисоціації оцтової кислоти в цьому розчині?
Дано: Розв’язання
![]() m( H+) = 0,002г 1) Обчислимо кількість гідроген-іонів: n(недисоц.) = 0,5 моль M( H+ ) = 1г/моль
m( H+) = 0,002г 1) Обчислимо кількість гідроген-іонів: n(недисоц.) = 0,5 моль M( H+ ) = 1г/моль
|
α — ? |
1 г — 1 моль 0,002 г — х 0,002г∙1моль х = 1г |
|
2) За рівнянням дисоціації оцтової кислоти знайдемо кількість оцтової кислоти, що |
|
продисоціювала:
х 0,002 моль
СН3COOH → CH3COO− + H+
1 моль 1 моль
х — 0,002 моль 1 моль — 1 моль х = 0,002 моль
3) Знайдемо загальну кількість оцтової кислоти:
N = n(дисоц.) + n(недисоц.) =
= 0,002 моль + 0,5 моль = 0,502 моль 4) Обчислимо ступінь дисоціації оцтової кислоти:
𝑛(дисоц. ) 0,002
𝛼 = ![]() = = 0,00398(0,004%)
= = 0,00398(0,004%)
𝑁(заг. ) 0,502
Відповідь: α= 0,00398 (0,04 %).
Задача 4
У кожній домашній аптечці є розчин борної кислоти. Його застосовують при запаленні вуха (отиті), при кон’юнктивітах, у боротьбі з нігтьовими грибками. У розчині борної кислоти з кожних 500 молекул розпадаються на йони тільки 15. Обчисліть ступінь дисоціації речовини.
Визначте, якої сили електроліт.
Дано: Розв’язання
![]()
![]() N(H3BO3) = 500 Розраховуємо ступінь дисоціації за формулою: n(H3BO3) = 15 𝑛(дисоц. ) α(Н3В03) — ? 𝛼 =
N(H3BO3) = 500 Розраховуємо ступінь дисоціації за формулою: n(H3BO3) = 15 𝑛(дисоц. ) α(Н3В03) — ? 𝛼 = ![]() 𝑁(заг. ) ∗ 100%
𝑁(заг. ) ∗ 100%
𝛼![]() %
%
Відповідь: α(Н3В03) = 3% — це електроліт слабкий, тому що
|
|
3 % α 30 % |
|
|
слабкі електроліти |
електроліти середньої сили |
сильні електроліти |
|
|
|
|
Задача 5
Засоби для чищення сантехніки містять хлоридну кислоту. Визначте ступінь дисоціації ( %) хлоридної кислоти, якщо відомо, що не продисоціювало 100 молекул, а дисоційованих йонів 1400.
|
Дано: n моль(недисоцiйованих) = 100 n(йонiв дисоцiйованих) = 1400 |
Розв’язання 1) Напишемо рівняння дисоціації кислоти: HCl = H++Cl− 2) Із рівняння видно: Кожна молекула кислоти дисоціює на 2 йони: 𝑛моль(дисоц𝑖йованих) = 𝑛(йон𝑖вдисоц𝑖йованих|2) = |
|
α(НСІ) — ? |
|
|
3) Обчислимо загальну кількість молекул, що була в розчині: |
|
N моль (загальне) = 700 дисоцiйованих +
+ 100 недисоцiйованих = 800 молекул 4) Напишемо формулу для розв’язку задачі:
𝑛моль(дисоц. )
𝛼(речовини) = ![]() %
%
5) Підставимо дані у формулу:
𝑛моль(дисоц. ) 700
𝛼(речовини) = ![]() = = 0,875
= = 0,875
𝑁моль(заг. ) 800
6) Щоб результат був у відсотках, потрібно домножити на 100 %:
0,875⋅100% = 87,5% Відповідь: α(HCl) = 87,5%.
Задача 6
Мурашина кислота (НСООН) є компонентом крему для засмаги, який використовується в солярії. Вона грає роль розігріваючого елемента, завдяки якому виходить більш рівний, насичений і стійкий колір, а обмінні процеси в шкірі поліпшуються. Обчисліть ступінь дисоціації мурашиної кислоти, якщо за температури 20 °С у воді розчинилося 3 молекули із 150 цієї речовини. Який це електроліт?
![]() Розв’язання 1) Записуємо формулу визначення ступеня дисоціації:
Розв’язання 1) Записуємо формулу визначення ступеня дисоціації:
𝑛
𝛼 = ![]()
𝑁
Підставляємо значення:
𝛼 ![]() %
%
2) Електроліти, ступінь дисоціації яких менше 3 %, належать до слабких. Отже, мурашина кислота — слабкий електроліт. Відповідь: α = 2%, слабкий електроліт.
Задача 7
![]() Для забезпечення вагонів потяга електроенергією під час стоянок використовують лужні акумулятори, електролітом у яких є розчин натрій гідроксиду. Обчисліть ступінь дисоціації та силу електроліту, якщо з кожних 50 молекул на йони розпадається 40.
Для забезпечення вагонів потяга електроенергією під час стоянок використовують лужні акумулятори, електролітом у яких є розчин натрій гідроксиду. Обчисліть ступінь дисоціації та силу електроліту, якщо з кожних 50 молекул на йони розпадається 40.
|
Дано: N (розчиненi) = 50 молекул n(дисоцiйованi) = 40 молекул |
Розв’язання Визначимо ступінь дисоціації натрій гідроксиду: 𝑛 40
|
|
α(NaOH) — ? |
|
|
|
|
Відповідь: α(NaOH) = 80%, сильний електроліт.
Задача 8
Газовані напої містять слабку карбонатну кислоту H2CO3, яка існує у вигляді гідрату С02Н2О. Обчисліть ступінь дисоціації електроліту, якщо з кожних 160 молекул 4 продисоціювали. До якої групи електролітів належить дана речовина?
|
Дано: N (розчиненi) = 160 молекул n(дисоцiйованi) = 4 молекули |
Розв’язання Визначимо ступінь дисоціації карбонатної кислоти: 𝑛 4
𝑁 160 Отже, карбонатна кислота — слабкий електроліт. |
|
α — ? |
|
|
Відповідь: α(H2CO3) = 2,5 %, слабкий електроліт. |
|
Задача 9
Багатьом відомий смак пряних, смачних ядер з кісточки абрикоса. Але не всі розуміють, що цей, здавалося б, нешкідливий, природний продукт містить у своєму складі небезпечний компонент — синильну кислоту (HCN). Обчисліть ступінь дисоціації кислоти, якщо на кожну пару йонів припадає 6 молекули сполуки.
Дано: Розв’язання
![]() N(H+)=N(CN−)=1 1) Пара йонів H+ і CN− утворюється з однієї молекули кислоти:
N(H+)=N(CN−)=1 1) Пара йонів H+ і CN− утворюється з однієї молекули кислоти:
![]() HCN = H++CN−
HCN = H++CN−
2) Отже, знайдемо загальне число молекул:
N(заг.) = 6 + 1 = 7
3) Обчислюємо ступінь дисоціації кислоти:
α(HCN) = N(дис.) / N(заг.) ![]() 100 % = 1/7 *100%= 14,3 % Відповідь: α(HCN) = 14,3%.
100 % = 1/7 *100%= 14,3 % Відповідь: α(HCN) = 14,3%.
Задача 10
Вода є найважливішою речовини нашої планети. Тварини і рослини містять понад 60% води за масою. На Землі водою вкрито 70,9 % поверхні. Вода виконує постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді атмосферних опадів. Вона має велике значення для сільського господарства (с/г) й промисловості. За температури 18 °С ступінь дисоціації води дорівнює 1,4 ![]() 10-9. Обчисліть, скільки молекул продисоціює в 1 л води.
10-9. Обчисліть, скільки молекул продисоціює в 1 л води.
|
Дано: t
V(H2O) = 1 л = 1000 мл |
Розв’язання 1) Обчислимо масу води: m = p m(H2O) = 1 г/мл 𝑚 𝑛 = 𝑀 |
|
n(Н2О) — ?
|
|
|
|
Mr(H2O) = 21 + 116 = 18 |
M(NaNO3) = 18 г/моль
1000г
𝑛 = ![]()
18 г⁄моль
![]() 3) Обчислимо число молекул води у заданій порції речовини за формулою: N = NA
3) Обчислимо число молекул води у заданій порції речовини за формулою: N = NA![]() n N(H2O) = 6,02
n N(H2O) = 6,02![]() 1023 моль-1
1023 моль-1 ![]() 55,56 моль = 334,5
55,56 моль = 334,5![]() 1023 4) Обчислимо кількість молекул води, що продисоціювали:
1023 4) Обчислимо кількість молекул води, що продисоціювали:
𝑛
𝛼 ![]() звідки𝑛
звідки𝑛 ![]() 𝑁
𝑁
n = 1,4![]() 10-9
10-9 ![]() 334,5
334,5![]() 1023=468,3
1023=468,3![]() 1014
1014
Відповідь: 468,3![]() 1014.
1014.
Задача 11
Будь-який гальванічний елемент складається з електродів, які можна виготовити з різних металів та електроліту — розчину сульфатної кислоти, що проводить електричний струм завдяки наявності в ній великої кількості вільних заряджених частинок — йонів. Ступінь дисоціації сульфатної кислоти становить 50 %. Скільки молекул з кожних 80 розпадеться на йони?
|
Дано: N (заг.) = 80 α = 50 % |
Розв’язання 1) Записуємо формулу для визначення ступеня дисоціації: 𝑛моль(дисоц. ) 𝛼(речовини) = 𝑁моль(заг. ) 2) Виводимо формулу для знаходження кількості молекул, що розпалися на йони: 𝑛 |
|
n — ?
|
|
|
3) Знаходимо кількість молекул, що розпалися на йони: |
|
n = 0,5![]() 80 = 40 Відповідь: n = 40 молекул.
80 = 40 Відповідь: n = 40 молекул.
Задача 12
Основна галузь застосування алюміній нітрату — це текстильна промисловість. Речовину використовують на фабриках для протруєння тканин перед фарбуванням. Визначте число йонів, що припадає на кожні 40 недисоційованих молекул, якщо ступінь дисоціації алюміній нітрату 70 %.
|
Дано: n(недис.) = 40 α = 70 % |
Розв’язання 1) Записуємо загальну формулу: 𝑛моль(дисоц. ) 𝛼(речовини) = 𝑁моль(заг. ) 2) Припустимо, що в розчині містилося 100 молекул алюміній нітрату. Тоді n(дис) = α ⋅ N (заг.) n(дис) = 0,7 ⋅ 100 = 70 n(недис.) = 100 - 70 = 30 |
|
n(йонiв) — ?
|
|
|
3) Записуємо рівняння електролітичної дисоціації: |
|
Al(NO3)3=Al3++3NO−3
4) За рівнянням утворилося 70 йонів Al + і 210 йонів NO−3 : N (йонiв) = 210 + 70 = 280 5) Складаємо пропорцію:
30 недис. молекул — 280 йонів 40 недис. молекул — x йонів x = 373 йони Відповідь: 373 йони.
Задача 13
![]() Сульфат Натрію Na2SO4 застосовується у виробництві соди і скла. Яку масу йонів Натрію можна отримати при дисоціації даної солі масою 71 г.
Сульфат Натрію Na2SO4 застосовується у виробництві соди і скла. Яку масу йонів Натрію можна отримати при дисоціації даної солі масою 71 г.
|
Дано: M(Na2SO4) = 71г |
Розв’язання 1) Записуємо рівняння дисоціації: Na2SO4 →2Na++SO42- 2) Записуємо формулу знаходження кількості речовини: 𝑚 𝑛 = 𝑁 3) Знаходимо молярну масу натрій сульфату: M(Na2SO4) = 142 г/моль |
|
m(Na+ ) — ? |
|
|
4) Знаходимо кількість речовини натрій сульфату: |
|
71г
𝑛 = ![]() = 0,5моль
= 0,5моль
142 г⁄моль 5) З рівняння реакції бачимо, що: n(Na+) = 2 ⋅ n ( Na2SO4 ) = 2 ⋅ 0,5 моль = 1 моль
6) Знаходимо масу йонів Натрію: m (Na+) = 23 г/моль ⋅ 1 моль = 23 г Відповідь: m(Na+) = 23 г.
Вправа 1. Електропровідність
Сахароза, натрій гідроксид, глюкоза, натрій карбонат — речовини білого кольору. Чи можливо за допомогою приладу для визначення електропровідності розчинів розпізнати їх?
Відповідь: приготувати розчини даних сполук та під’єднати прилад. У розчинах сахарози та глюкози лампа світитися не буде, так як вони є неелектролітами. У розчинах натрій гідроксиду та натрій карбонату лампа світитиметься.
3.2. Вправи на визначення рН
Вправа 1
рН свіженького молока складає 6,3-6,7. При зберіганні унаслідок молочнокислого бродіння у ньому утворюється молочна кислота. При скисанні молока, його рН поступово зменшується. Високоякісні молочні вироби мають таку характеристику рН: йогурти — 4,0– 4,3; кефір — 4,85–4,65; молоко згущене — 6,1–6,4; сирна сироватка — 4,3–4,6.
Вкажіть:
1. Яким із перелічених індикаторів можна скористатися для визначення кислотності середовища:
а) універсальний індикатор;
б) лакмус;
в) метилоранж;
г) фенолфталеїн;
д) настій синьої капусти?
2. Який колір матимуть індикатори у розчинах цих продуктів?
3. Яким індикатором найкраще скористатись?
вправа 2
Встановіть відповідність між даним розчином та значенням pH і реакцією середовища.
|
№з /п |
Розчини |
pH |
Реакція середовища |
|
1 |
Шлунковий сік |
А — 6 |
а) слабколужна |
|
2 |
Кров |
Б — 1,7 |
б) слабокисла |
|
3 |
Дощова вода |
Г — 7,1 |
в) сильнокисла |
|
|
Сік підшлункової залози |
В — 8 |
г) лужна |
|
Відповідь: 1 — Б — в; 2 — Г — а; 3 — А — б; 4 — В — Г. |
|||
Вправа 3
![]() Учень готував розчини речовин для дослідів і визначав pH середовища. Визначте яка кислотність середовища та колір лакмусу.
Учень готував розчини речовин для дослідів і визначав pH середовища. Визначте яка кислотність середовища та колір лакмусу.
|
№з/п |
Розчини |
Кислотність середовища |
Колір індикатора |
|
1 |
Дистильована вода |
А — кисле |
а) фіолетовий |
|
2 |
Розчин питної соди |
Б — нейтральне |
б) червоний |
|
3 |
Розчин оцтової кислоти |
В — лужне |
в) синій |
|
|
|
|
|
Вправа 4
У першу пробірку налили розчин засобу, який використовується для видалення жиру, у другу — розчин засобу для видалення іржі. У кожну пробірку додали по кілька крапель лакмусу. Розчин у пробірці № 1 набув синього кольору, у пробірці № 2 — рожевого. Визначте рН кожного з розчинів. Складіть правила безпеки, яких слід дотримуватись при використанні даних засобів.
Розв’язання
Розчин лакмусу набуває синього кольору в лужному середовищі, а рожевого — у кислому. Отже, розчин у пробірці № 1 має лужне середовище, тобто значення водневого показника більше 7, а у пробірці № 2 — кисле, значення водневого показника менше 7.
Принципи безпеки при експлуатації засобів:
1. Призначення та Використання: Усі засоби повинні використовуватися лише згідно з їх призначенням, дотримуючись пристрасно інструкцій та рекомендацій, що регулюють їх експлуатацію.
2. Безпека при роботі з Хімічними Речовинами: Під час маніпуляцій із препаратами, що включають агресивні хімічні компоненти, такі як кислоти та луги, обов'язково слід використовувати гумові рукавички та окуляри, забезпечуючи повноцінний захист від можливих ризиків та контактів
Відповідь: № 1 має лужне середовище, тобто значення водневого показника більше 7, а у пробірці № 2 — кисле, значення водневого показника менше 7.
Вправа 5*
Для шкіри людини характерне значення рН — 5,5. Використання побутових хімічних препаратів для миття і прибирання веде до руйнування поверхневих шарів дерми, що позбавляє шкіру природного захисту. Це спричиняє появу алергій, розтріскувань, дерматитів, сухості поверхні рук. Які речовини входять до складу миючих засобів, викликаючи таку реакцію шкіри? Чому це відбувається? Як при цьому змінюється рН шкіри?
Відповідь: верхній шар шкіри має слабкокис-лу реакцію (pH = 5,5). Це перешкоджає проникненню хвороботворних бактерій у більш глибокі шари шкіри. Верхній роговий шар шкіри долонь складається переважно з кератину, структуру якого обумовлюють водневі зв’язки. Часте вмивання з милом, використання миючих засобів змінює значення рН шкіри (pH≥7-12 і призводить до зниження природної захисної реакції. Мила — це натрієві солі вищих жирних кислот — стеаринової та пальмітинової. Як і всі розчинні солі, вони можуть вступати в реакції обміну з кислотами та іншими солями. Луг, що утворюється під час гідролізу мила, взаємодіє з білками. Споліскування рук слабкокислим розчином, використання кремів, гелів тощо сприяє відтворенню водневих зв’язків і міцності рогового шару шкіри, а також його природній слабко-кислій реакції. Крім того, в кислому середовищі більшість хвороботворних бактерій та грибків гірше розмножуються.
Вправа 6
Хімічно доведено цілющі властивості фруктів, а саме яблук, які містять велику кількість різних цукрів, заліза, пектину. Антиоксидантні властивості яблук відносять їх до борців із захворюваннями головного мозку, онкологічними й іншими серйозними захворюваннями.
Неозброєним оком ми можемо спостерігати зміну кольору відоприготовленого соку з яблуку – він може змінювати свій колір. Яка кислотність приготовленого яблучного соку, якщо метиловий оранжевий змінив своє забарвлення на рожеве. Відповідь: рН цього розчину менше 7.
![]()
Вправа 7. Домашній експеримент
Виявлення рН найбільш поширених розчинів, що використовуються у побуті, за допомогою універсального індикаторного папірця та шкали для визначення рН.
1. Під час роботи дотримуйтеся правил техніки безпеки при роботі з гострими, ріжучими предметами, електричними приладами, скляним посудом.
2. Приготуйте розчини: лимонного соку, молока, чорної кави, яблучного соку, кефіру.
3. Помістіть їх у окремі пронумеровані посудини.
4. За допомогою універсального індикаторного папірця визначте рН кожного розчину.
5. Дані занесіть до таблиці 1.
Таблиця 1
|
№ п/п |
Розчин |
рH |
|
1 |
Лимонного соку |
|
|
2 |
Молока |
|
|
3 |
Чорної кави |
|
|
4 |
Яблучного соку |
|
|
5 |
Кефіру |
|
|
6. Підготуйте звіт про виконану роботу у вигляді презентації. |
||
Вправа 8
Для зміцнення волосся корисно після миття використовувати домашній «ополіскувач»:
підкислену оцтом воду. Якою має бути концентрація катіонів H+, якщо pH = 5,5?
![]() Дано: Розв’язання
Дано: Розв’язання
pH = 5,5 1) Записуємо значення рН:
|
[ H+ ] — ? |
pH = −lg [ H+]
[H ] = 10 =3,16⋅10 |
|
Відповідь: [H+] = 10-5,5= 3,16 ⋅10-6. |
|
Вправа 9
Засіб для прочищення каналізаційних труб «Кріт» при розчиненні у воді та додаванні індикатора фенолфталеїну набуває малинового забарвлення.
З’ясуйте рH цього розчину та встановіть назву йона, що спричиняє дане забарвлення. а) рН = 7; Na+;
б) рН < 7; OH ;
в) рН > 7; OH ;
г) рН < 0; H+.
3.3. Задачі на визначення кількості йонів у розчині
Задача 1
Споживання калій йодиду є важливим методом лікування йододефіцитних захворювань. Йододефіцит призводить до розвитку злоякісних і доброякісних пухлин щитовидної залози. Дуже чутливою до дефіциту йоду в організмі є нервова система. Відповідно у разі стабільного йододефіциту з раннього віку у дитини відбувається затримка психічного розвитку, різке відставання у розумовому розвитку.
Обчисліть кількість речовини аніонів при розчиненні однієї таблетки калій йодиду. (1 таблетка містить калію йодиду в перерахунку на суху речовину 0,25 г, а йоду — добова потреба в дітей підліткового віку: 5,9⋅10-4 моль).
![]() Дано: Розв’язання m(KI) = 0,25 г 1. Калій йодид, як сильний електроліт, дисоціює в розчині повністю: n(I2) = 5,9 ⋅10-4 моль 𝐾𝐼 ⥃ 𝐾++𝐼−(1) n(I−) — ? 2. Визначаємо кількість речовини калій йодиду в розчині за формулою:
Дано: Розв’язання m(KI) = 0,25 г 1. Калій йодид, як сильний електроліт, дисоціює в розчині повністю: n(I2) = 5,9 ⋅10-4 моль 𝐾𝐼 ⥃ 𝐾++𝐼−(1) n(I−) — ? 2. Визначаємо кількість речовини калій йодиду в розчині за формулою:
n = m / M
![]() М(KI) = 39 + 127 = 166 г/моль n(KI) =m (KI) / M(KI) = 0.25 / 166 = 0.0015 моль 3. З рівняння дисоціації (1) видно, що при розчиненні 0,0015 моль калій йодиду утворюється 0,0015 моль аніонів йоду, а це складає дві добові потреби йоду у підлітків. Відповідь: 0,0015 моль.
М(KI) = 39 + 127 = 166 г/моль n(KI) =m (KI) / M(KI) = 0.25 / 166 = 0.0015 моль 3. З рівняння дисоціації (1) видно, що при розчиненні 0,0015 моль калій йодиду утворюється 0,0015 моль аніонів йоду, а це складає дві добові потреби йоду у підлітків. Відповідь: 0,0015 моль.
Задача 2
Натрій сульфіт — харчова добавка, яку використовують для покращення смаку та свіжостім’ясних виробів. Яка кількість йонів утвориться у розчині натрій сульфіту масою 500г?
|
Дано: m(Na2SO3) = 500г |
Розв’язання 1. Знаходимо кількість речовини натрій сульфіту за формулою: 𝑚 𝑛 = 𝑁 M(Na2SO3) = 126 г/моль 𝑛(𝑁𝑎2𝑆𝑂3) = |
|
n(Na+; 𝑆𝑂32− — ? |
|
|
2. Рівняння дисоціації натрій сульфіту: |
|
𝑁𝑎2𝑆𝑂3 ⥃ 2𝑁𝑎++𝑆𝑂32−)
3. За рівнянням (1) складаємо співвідношення та обчислюємо кількість йонів:
1 моль Na2SO3 дисоціює на 3 йони (2 йони
Na+ + 1 йон S𝑂32− За умовою, 4 моль Na2SO3 дисоціє на x йонів
= 4![]() 3 / 1 = 12 йонів Відповідь: n(Na+; S𝑂32−) = 12моль.
3 / 1 = 12 йонів Відповідь: n(Na+; S𝑂32−) = 12моль.
Задача 3
Розчин кальцій хлориду застосовують у медицині для лікування алергічних захворювань, при запальних та ексудативних процесах. Яка кількість йонів хлору утворюється у розчині при повній дисоціації 2,5 моль кальцій хлориду?
Дано: Розв’язання n (CaCl2) = 2,5 моль 1. Рівняння дисоціації кальцій хлориду:
n(Cl−) — ? CaCl2 ⥃ Ca++ 2Cl− (1) 51
![]() 2. За рівнянням (1) при розчиненні 1 моль СаС12 утворюється 2 моль Cl−, тоді, відповідно, при розчиненні 2,5 моль СаС12 утвориться: n(Cl−) = 2 2,5 = 5 моль.
2. За рівнянням (1) при розчиненні 1 моль СаС12 утворюється 2 моль Cl−, тоді, відповідно, при розчиненні 2,5 моль СаС12 утвориться: n(Cl−) = 2 2,5 = 5 моль.
Відповідь: n (Cl−) = 5моль.
Задача 4
Розбавлені розчини ортофосфатної кислоти використовують у приготуванні газованих напоїв у якості підкиснювача і консерванту.
Для приготування напою «Pepsi» розчинили ортофосфатну кислоту масою 49 г у воді масою 451 г. Обчисліть масову частку аніонів у розчині, якщо вважати, що кислота повністю дисоціює.
![]() Дано: Розв’язання m(H3PO4) = 49г 1. Знаходимо кількість речовини ортофосфатної кислоти за формулою:
Дано: Розв’язання m(H3PO4) = 49г 1. Знаходимо кількість речовини ортофосфатної кислоти за формулою:
m(H2O) = 451г 𝑛 = 𝑚![]()
ω(P𝑂43−) — ? M(H3PO4) = 98 г/моль; 𝑁
n(H3PO4) = 49/48 = 0,5 моль
2. Рівняння дисоціації ортофосфатної кислоти:
H3PO4 ⥃ 3H++P𝑂43− (1)
3. З рівняння дисоціації (1) видно, що при розчиненні 0,5 моль ортофосфатної кислоти утворюється 0,5 моль аніонів Р𝑂43− . 4. Маса аніонів Р𝑂43− становить:
т = n![]() М;
М;
M(Р![]() ) = 95 г/моль; m = 0,5
) = 95 г/моль; m = 0,5![]() 95 = 47,5 г.
95 = 47,5 г.
5. Масову частку аніонів Р𝑂43− визначаємо за формулою:
𝜔![]() 100 %;
100 %;
𝑚![]()
𝜔
Відповідь: 9,5 %.
Задача 5
У водоймах для розведення риби гранично допустима концентрація (ГДК) нітрат-іонів становить 40 мг/л. Із стічними водами до водойму потрапило 200 кг натрієвої селітри. Обчисліть концентрацію нітрат-іонів у водоймі об’ємом 105 м3. Чи не перевищує вона гранично допустиму концентрацію нітрат-іонів у водоймі?
Дано: Розв’язання
![]() C(N𝑂4−) = 40 мг/л (ГДК) 1. Рівняння електролітичної дисоціації солі NaNO3:
C(N𝑂4−) = 40 мг/л (ГДК) 1. Рівняння електролітичної дисоціації солі NaNO3:
|
V(водойми) = 105 м3 m (NaNO3) = 200 кг |
NaNO3 ⥃ Na++NO3 (1) 2. Обчислюємо молекулярну масу NaNO3 та NO3: M(NaNO3) = 85 кг/моль; M(N𝑂3−) = 62 кг/моль. |
|
С(N𝑂4−)) — ?
|
|
|
3. За рівнянням (1) складаємо співвідношення та обчислюємо кількість йонів N𝑂3−: |
|
Із 85 кг NaNO3 утворюється 62 кг N𝑂3− Із 200 кг NaNO3 утворюється x кг N𝑂3− x = 200![]() 60 / 85 = 146 кг
60 / 85 = 146 кг
4. Обчислюємо концентрацію нітрат-іонів у водоймі та виражаємо в однакових одиницях з ГДК:
105м3=108л, 146 кг = 146 ![]() 106мг;
106мг;
𝐶
Відповідь: C = 1,46 мг/л; ГДК не перевищено.
Задача 6
Кальцій гідроксид використовують у харчовій промисловості як харчову добавку Е526 завдяки його здатності нейтралізувати занадто високу кислотність продуктів. Наприклад, у консервації, у виготовленні напоїв, у виробництві дитячого харчування. Ця харчова добавка вважається натуральною та безпечною для здоров’я.
Обчисліть масову частку гідроксид-іонів у розчині, який виготовили із 37 г кальцій гідроксиду і 63 г води.
|
Дано: m (Ca(OH)2) = 37г m(H2O) = 63 г |
Розв’язання 1. |
𝑛 𝑁
|
|
ω(OH−) — ?
|
||
|
2. Рівняння електролітичної дисоціації: |
||
![]()
Ca(OH)2 ⥃ Ca2++2OH− (1)
3. За рівнянням (1) видно, що при розчиненні
1 моль Ca(OH)2 утворюється 1 моль Ca+ та 2 моль OH− n(OH−) = ½ n(Ca(OH)2) =0.5 / 2 = 0,25 моль
4. Знаходимо масу гідроксид-іонів за формулою т = М ![]() n:
n:
M (OH−) = 16 + 1 = 17 г/моль m(OH−) = n(OH−) ![]() М(OH−) = 0,25
М(OH−) = 0,25![]() 17 = 4,25 г
17 = 4,25 г
5. Знаходимо масу розчину: m(р-ну) = m(Ca(OH)2) + m(H2O) = 37 г + 63 г = 100 г
6. Масову частку гідроксид-іонів у розчині обчислюємо за формулою:
𝜔![]() 100 %;
100 %;
𝑚![]()
𝜔 Відповідь: 𝜔
Задача 7
Для утворення хрусткої скоринки та для запобігання випаровуванню вологи в хлібобулочні вироби додають стабілізатор Е-524 — гідроксид Натрію.
Обчисліть кількість катіонів і аніонів у розчині, що містить 5 г натрій гідроксиду.
![]() Дано: Розв’язання
Дано: Розв’язання
m(NaOH) = 5г 1. Кількість речовини у порції заданої маси обчислюємо за формулою:
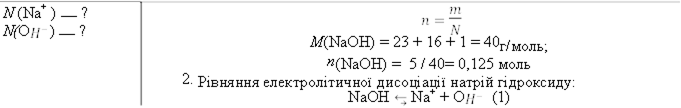
3. За рівнянням (1) видно, що при розчиненні
1 моль NaOH утворюється 1 моль Na+ та 1 моль O𝐻− , тоді n(NaOH) = n ( Na+ ) = n (O𝐻−) = 0,125 моль
4. Визначаємо число структурних частинок у розчині за формулою N = n ⋅ NA;
NA = 6,021023 моль- ;
N(Na+ ) = N(O𝐻−) = 0,125⋅6,02⋅1023 = 7,51022 йонiв
Відповідь: N(Na+ ) = 7,5⋅1022 йонiв; N(O𝐻−) = 7,5⋅1022 йонiв.
Задача 8
Кальцій хлорид не дозволяє утворюватися ожеледі та сніжно-крижаним накатам, а також сприяє зниженню сил зчеплення льоду з поверхнею дороги за рахунок утворення розсолу. Після прибирання кальцій хлорид не залишає слідів на асфальті та тротуарній плитці й не руйнує бетонні перекриття. Обчисліть кількість катіонів та аніонів у розчині, що містить 11,1 г кальцій хлориду?
Дано: Розв’язання
m(CaCl2) = 11,1 г 1. Знаходимо кількість речовини кальцій хлориду за формулою
![]() n (Са2+ ) — ? 𝑛 = 𝑚
n (Са2+ ) — ? 𝑛 = 𝑚![]()
n ( Cl−) — ? 𝑁
M(СаС12) = 111 г/моль
n(CaCl2) =11,1 г / 111 (г / моль) = 0,1 моль
2. Рівняння дисоціації кальцій хлориду:
![]() СаС12 ⥃ Са2++2 Cl− (1) 3. За рівнянням (1) видно, що при розчиненні
СаС12 ⥃ Са2++2 Cl− (1) 3. За рівнянням (1) видно, що при розчиненні
1 моль СаС12 утворюється 1 моль Ca2+ та 2 моль Cl−, тоді
n ( Ca2+ ) = n ( CaCl2 ) = 0,1 моль, а n ( Cl− ) = 2n ( CaCl2 ) = 0,2 моль.
Відповідь: n ( Ca2+ ) = 0,1 моль, n ( Cl− ) = 0,2 моль.
Задача 9
Сульфатна кислота є дуже важливим продуктом хімічної промисловості. Вона використовується для виробництва добрив, миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, фарб, емалей, а також як осушувач газів.
Обчисліть кількість йонів H+ у розчині сульфатної кислоти масою 196 г, якщо масова частка кислоти — 50 %. Ступінь дисоціації кислоти прийняти за 100 %.
|
Дано: m(р-ну) = 196 г ω(H2SO4) = 50% α = 100 % |
Розв’язання 1. Обчислимо масу сульфатної кислоти у розчині за формулою: 𝜔(𝑝. 𝑝. ) ⋅ 𝑚(р − ну) 𝑚(𝑝. 𝑝. ) = 100% 50% ∙ 196г
|
|
n ( H+ ) — ?
|
|
|
2. Кількість речовини сульфатної кислоти визначаємо за формулою: |
|
𝑚
𝑛 = ![]() М
М
M(H2SO4) = 2⋅1 + 1⋅32 + 4⋅16 = 98 г/моль
98г
𝑛 = ![]() = 1моль
= 1моль
98
3. Рівняння дисоціації сульфатної кислоти:
H2SO4⥃2H++S𝑂42− (1) 4. За рівнянням (1) видно, що при розчиненні
1 моль H2SO4 утворюється 2 моль H+ та 1 моль S𝑂42−.
Відповідь: n(H+) = 2моль
Задача 10
Кров містить 0,5 моль йонів Феруму Fe+. Обчисліть масу йонів Феруму, які містяться в даній порції крові.
Задача 11
Шлунковий сік містить 0,1 моль хлоридної кислоти. Обчисліть сумарну кількість речовини йонів Гідрогену і Хлору в шлунковому соку.
|
Дано: n(HCl) = 0,1 моль |
Розв’язання 1. Рівняння дисоціації хлоридної кислоти: HCl ⥃ H++Cl− (1) 2. За рівнянням (1) видно, що при розчиненні 1 моль HCl утворюється 1 моль H+ та 1 моль Cl−, тоді, відповідно, з 0,1 моль HCl утвориться 0,1 моль йонів Гідрогену та 0,1 моль йонів Хлору. Разом 0,2 моль. |
|
n(H+,Cl−) — ? |
|
|
Відповідь: 0,2 моль. |
|
Задача 12
Пральний порошок, до складу якого входить натрій фосфат кількістю речовини 2 моль, розчинили у воді. Внаслідок повної дисоціації цієї солі утворилися йони Натрію кількістю: 1) 1 моль; 2) 2 моль; 3) 5 моль; 4) 6 моль.
Дано: Розв’язання
![]() n(Na3PO4) = 2 моль 1. Рівняння дисоціації натрій фосфату: n ( Na+ ) — ? Na3PO4 ⥃ 6Na++2PO3− (1) 2. Із рівняння (1) видно, що при розчиненні 1 моль Na3PO4 утворюється 6 моль
n(Na3PO4) = 2 моль 1. Рівняння дисоціації натрій фосфату: n ( Na+ ) — ? Na3PO4 ⥃ 6Na++2PO3− (1) 2. Із рівняння (1) видно, що при розчиненні 1 моль Na3PO4 утворюється 6 моль
Na+, тоді, відповідно, з 2 моль Na3PO4 утвориться 6 моль йонів Натрію.
Відповідь: 4) 6 моль.
Задача 13
Кальцій хлорид використовується для збільшення жорсткості води в плавальних басейнах. Це зменшує розмивання бетону в басейні. Обчисліть кількість аніонів у розчині, що містить кальцій хлорид кількістю речовини 4 моль.
|
Дано: n(CaCl2) = 4 моль |
Розв’язання 1. Рівняння електролітичної дисоціації кальцій хлориду: CaCl2 ⥃ Ca2+ + 2Cl− (1) 2. За рівнянням (1) видно, що при розчиненні 1 моль СаС12 аніонів Cl−, тоді, відповідно, з 4 моль HCl утвориться 8 моль аніонів Хлору. |
|
n ( Cl− ) — ? |
|
|
Відповідь: 8 моль. |
|
утворюється 2 моль
3.4. Вправи на визначення йонів у розчині
Вправа 1
Укажіть йони, які не можуть одночасно перебувати у розчині. Речовина, яку вони утворюють, застосовують у лікарні під час діагностики хвороб шлунково-кишкового тракту. а) Ва2+ і Cl−;
б) Ва2+ і N𝑂3−;
в) Ва2+ і SO2−;
г) Ва2+ і OH−. Відповідь: в) BaSO4↓ — барій сульфат.
Вправа 2
Укажіть формулу сполуки, що утворює під час повної дисоціації йони Ca2+, які зміцнюють емаль зубів та опорно-рухову систему людини:
а) СаН2;
б) СаО;
в) Са3(РО4) ;
г) Ca(HCO3) .
Відповідь: г; Ca(HCO3) ⥃ Ca2+ +2HC𝑂3−.
Вправа 3
У процесі повної дисоціації речовини цей катіон забезпечує жорсткість води. Внаслідок дисоціації за першим ступенем речовини, до складу якої він входить, утворюється катіон із зарядом +1. Вкажіть відповідь та напишіть рівняння електролітичної дисоціації даної сполуки: а) барій хлорид;
![]() б) барій сульфат;
б) барій сульфат;
в) магній гідрогенкарбонат;
г) магній карбонат.
Відповідь: в;
Mg (HCO3)2 ⥃ Mg2+ + 2HC𝑂3−;
Mg (HCO3)2 ⥃ MgHCO3+ + HC𝑂3−. Катіон Mg + забезпечує жорсткість води.
Вправа 4
Яка з перелічених речовин, якими користуємося повсякчасно, проводить електричний струм:
а) суха кухонна сіль;
б) розчин кухонної солі;
в) розчин цукру;
г) водопровідна вода? Відповідь: б, г — тому що у розчинах присутні йони солей, які проводять струм.
Вправа 5
У чотирьох склянках маємо: а) етиловий спирт;
б) гліцерин;
в) цукор;
г) кухонну сіль.
У кожну склянку додали кип’ячену (дистильовану) воду. Який з утворених розчинів є електролітом? Чому?
Відповідь: електроліт — розчин кухонної солі NaCl — неорганічної речовини з йонним зв’язком. Інші речовини — органічні зі слабким ковалентним полярним зв’язком — неелектроліти.
Виявлення в розчині гідроксид-іонів та йонів гідрогену. Якісні реакції на деякі йони.
Застосування якісних реакцій
• Речовин відомо дуже багато. За якими ознаками можна розпізнати речовини?
(За зовнішнім виглядом, за характерним запахом, кольором, густиною, розчинністю у воді, агрегатним станом)
• У чотирьох склянках містяться мідь, алюміній, мідний купорос, оцтова кислота. Як їх розпізнати?
(А як розпізнати кисень і вуглекислий газ, які містяться у двох пробірках, адже зовні вміст пробірок нічим не відрізняється між собою? (Учні перевіряють скалками і роблять висновок.)
З киснем усе зрозуміло, а ось із тим, що вуглекислий газ не підтримує горіння і палаюча скалка в ньому згасла — з такою відповіддю не можна погодитися повністю, адже азот теж безбарвний, без запаху і не підтримує горіння. Пригадайте, з якою ще реакцією з ідентифікації вуглекислого газу ви знайомилися у 8 класі? Пригадайте, як іще можна ідентифікувати вуглекислий газ?
(Учні через пластикову трубочку для коктейлю обережно видихають повітря з вуглекислим газом і пропускають його у розчин вапнякової води до її помутніння.)
З допомогою органів чуття — зору, нюху, слуху — можна визначити характерні ознаки, які супроводжують хімічні реакції. Подібні реакції називаються якісними.
Якісні реакції — це хімічні перетворення, які супроводжуються характерними ознаками, з допомогою яких проводиться розпізнавання речовин.
![]() Явища, які відбуваються під час проведення якісних реакцій, називаються аналітичними сигналами.
Явища, які відбуваються під час проведення якісних реакцій, називаються аналітичними сигналами.
Щоб реакцію можна було вважати якісною, слід упевнитися, що аналітичний сигнал проявляється при взаємодії даної речовини з одним або, у крайньому випадку, з небагатьма реагентами, інакше неможливо буде визначити, про яку саме речовину йде мова. Прикладом такої специфічної реакції є взаємодія крохмалю з розчином йоду з появою синьо-фіолетового забарвлення, або якісна реакція на фосфат-іон.
Проблемна ситуація. Як, використовуючи мінімальне число реактивів, розпізнати прозорі безбарвні розчини калій фосфату та калій йодиду.
Вміст кожної пробірки розділяємо на 2 пробірки. Перша пробірка — для контролю, а з умістом пробірки № 2 проводимо подальші досліди. До вмісту обох пробірок доливаємо прозорий безбарвний розчин арґентум нітрату (реактив на розчинні галогеніди металів). Але спостерігаємо, що в обох пробірках випав жовтий осад. Нам відомо, що арґентум йодид ні в чому не розчинний. Спробуємо розчинити ці осади в нітратній кислоті. Вміст першої пробірки не розчиняється (отже, тут містився калій йодид). Вміст другої пробірки розчинився (отже, спочатку там містився калій ортофосфат).
Сформувалась і розвинулась окрема наукова галузь — аналітична хімія, предметом дослідження якої є якісний аналіз складу речовин і матеріалів. Уміння проводити якісний аналіз внесено до переліку професійних умінь хіміків-лаборантів, провізорів, експертів з якості харчової продукції, води та фахівців інших спеціальностей. Важливе значення мають якісні реакції в питаннях захисту довкілля від забруднень. З їх допомогою здійснюють контроль за якістю води, повітря, ґрунту. І якщо ми з вами на уроках спостерігали за якісними реакціями візуально, то у промисловості чи довкіллі це роблять з допомогою спеціальних приладів, які можуть помітити надзвичайно малі концентрації речовин.
Якісні реакції знайшли широке застосування у промисловості, сільському господарстві, побуті, медицині.
На заводах визначають якісний і кількісний склад виробленої продукції чи відходів виробництва (наприклад, який склад коксового газу чи вміст заліза у чавуні). На упакуванні харчової продукції ми завжди читаємо про те, яка жирність молока (2,5 % чи 3,8 %), скільки відсотків білків, жирів та вуглеводів міститься в крупах та інших продуктах харчування.
На водоочисних станціях хіміки-аналітики визначають якісний і кількісний склад питної води, адже дуже важливо, які домішки у ній містяться. Так, жителі нашого міста дуже потерпають від значно перевищеної жорсткості питної води, і це є сигналом для того, щоб удома для пом’якшення води скористатися спеціальними насадками у домашніх фільтрах.
У медицині й фармації постійно проводять якісний і кількісний аналіз лікарських препаратів. Та й самі ми неодноразово здавали сечу і кров на аналізи для полегшення встановлення правильного діагнозу лікарем.
Якісні реакції дістали дуже широке застосування у криміналістиці, бо дали змогу швидше і якісніше розкривати скоєні злочини.
Завдання
Дайте пояснення такій ситуації:
• Під час рентгеноскопії шлунка пацієнту дають випити суспензію BaSO4. Поясніть, чому чистий барій сульфат не викликає отруєнь, у той час як зафіксовано випадки зі смертельним наслідком у разі застосування BaSO4 з домішками ВаС12?
(Чистий барій сульфат не викликає отруєнь, бо ця речовина не розчинна у воді, а барій хлорид добре розчиняється у воді, є сильним електролітом, а під час дисоціації утворює йони Барію, які є отрутою для організму людини.)
ВаСl2 → Ва2+ + 2Сl−
Завдання для розумників «перегонка нафти»
Нафта — суміш вуглеводнів, у сирому вигляді не використовується, її почали переробляти із середини XVIII століття.
![]() Первинна переробка нафти полягає в її перегонці, яку здійснюють на нафтоперегінних заводах після відділення з нафти супутніх газів. Перегонка, або ректифікація, — це фізичний спосіб розділення нафти на фракції, який ґрунтується на різних температурах кипіння (конденсації) окремих компонентів нафти.
Первинна переробка нафти полягає в її перегонці, яку здійснюють на нафтоперегінних заводах після відділення з нафти супутніх газів. Перегонка, або ректифікація, — це фізичний спосіб розділення нафти на фракції, який ґрунтується на різних температурах кипіння (конденсації) окремих компонентів нафти.
Спочатку сиру нафту нагрівають у трубчастій печі до температури близько 400 °С, де компоненти нафти переходять у пароподібний стан. Отримані пари спрямовують знизу вгору в ректифікаційну колону, всередині якої по всій висоті містяться тарілки, на яких при охолодженні конденсується та чи інша фракція.
У процесі перегонки нафти одержують світлі нафтопродукти (табл. 2).
Таблиця 2. Фракції перегонки нафти
|
Фракція |
Число атомів С в молекулах |
Температу ра кипіння (°с) |
Застосування |
|
Бензин |
5–10 |
30–180 |
Автомобільне та авіаційне пальне, розчинник у хімічній промисловості |
|
Лігроїн |
6–12 |
160–200 |
Паливо, сировина для вторинної переробки нафтопродуктів, а також високооктанова добавка до бензину, розчинник у лакофарбовій промисловості |
|
Гас |
10–16 |
180–250 |
Авіаційний бензин, пальне для тракторів, компонент пального для ракет |
|
Газойль (солярове масло) |
13–25 |
220–350 |
Дизельне пальне, сировина для отримання крекінгбензину |
|
Важкий газойль (мазут) |
26–30 |
350–430 |
Паливо для теплоелектро станцій |
|
Важкий мазут |
>30 |
При нагріванні розкладаєть ся |
Паливо для промислових печей, переганяють у вакуумних установках, отримуючи низку речовин (гудрон, бітум, вазелін, парафін, паливо для котелень) |
Отриманий перегонкою нафти бензин не може задовольнити зростаючий попит на нього, а тому перед нафтопереробною промисловістю постало завдання — знайти додаткові джерела отримання бензину. І таке завдання було розв’язано — це крекінг-процеси (термічний і каталітичний), а також риформінг. Це хімічні процеси розкладу нафтопродуктів на більш легкі фракції. У процесі розкладу нафтопродуктів утворюються ненасичені вуглеводні, що підвищує октанове число бензину, а отже, і його якість.
Завдання
1. ![]() Як ви розумієте зміст висловлювання Д. І. Менделєєва: «Нафта не паливо. Топити можна й асигнаціями». Свої аргументи підтвердьте записом відповідних рівнянь реакцій.
Як ви розумієте зміст висловлювання Д. І. Менделєєва: «Нафта не паливо. Топити можна й асигнаціями». Свої аргументи підтвердьте записом відповідних рівнянь реакцій.
2. Наведіть приклади синтезу органічних сполук, виходячи з нафти та нафтопродуктів.
3. Уявіть собі, що на Землі скінчаться запаси нафти та природного газу (адже вони не безкінечні). Що зміниться у повсякденному житті людей? Які товари та послуги зникнуть із ужитку? Втрата яких із них стане для людини непоправною?
Домашнє завдання. Лист із майбутнього
Запропонуйте учням виявити фантазію і написати твір. Але не простий, а від людини з майбутнього. Про те, з якими енергетичними проблемами їй доведеться зіткнутися.
4. ПРИКЛАДНИЙ ПРОЕКТ - STEAM-ПРОЕКТ «ЛИСТОК – ЕНЕРГЕТИЧНЕ
ПАЛИВО» ДЛЯ УЧНІВ 7-9 КЛАСІВ
Стислий опис:
STEM (S — science, T — technology, Е — engineering, М — mathematics)
Алгоритм виконання проекту
• Визначити проблему, що буде вивчатися
• Спроектувати роботу
• Знайти інформацію
• Провести дослідження
• Презентувати роботу
• Презентація, створити лепбук, творчі звіти.
Опис проекту
1. Дослідження хімічних явищ: Вивчення хімічних процесів, що відбуваються в листку рослин, які визначають його фізичні та біологічні властивості.
2. Вивчення взаємодії з природою: Аналіз корисних та негативних наслідків переробки опалого листя на природу, включаючи його вплив на екосистеми та біологічний розвиток.
3. Функції листка та гальванічний елемент: Формулювання функцій листка у процесах фотосинтезу та визначення концепції гальванічного елемента, який може бути асоційований з хімічними реакціями в рослинах.
4. Утилізація опалого листя: Ознайомлення з різними методами утилізації опалого листя населенням, включаючи створення брикетів для опалення, синтез біогазу та компостування].
5. ![]() Сприяння громадській увазі: Проведення інформаційних заходів для привертання уваги громадськості та місцевого керівництва до проблеми винаходу та підтримки найкращих способів утилізації опалого листя, зокрема через ініціативи стосовно створення енергетичних джерел та екологічних рішень.
Сприяння громадській увазі: Проведення інформаційних заходів для привертання уваги громадськості та місцевого керівництва до проблеми винаходу та підтримки найкращих способів утилізації опалого листя, зокрема через ініціативи стосовно створення енергетичних джерел та екологічних рішень.
Тип проєкту за характером — інформаційно-дослідницький, творчий, практикоорієнтований. Форма – групова; відкрита координація.
Збір інформації: підбір літератури, пошук в Інтернет; дослідження наукових передач; провести експеримент; спостереження.
Мета STEAM-дослідження: з’ясувати зв’язок хімії з фізикою, біологією, розглянути хімічні явища, пов’язані з листком рослин; дослідити корисні та негативні явища переробки опалого листя, його впливу на природу; сформулювати функції листка, поняття гальванічний елемент; ознайомитися зі способами утилізації населенням опалого листя; привернути увагу громадськості та місцевого керівництва до питання винаходу підтримки найкращого способу утилізації опалого листя — створення брикетів для опалення у зимовий період, синтез біогазу, компостування.
Завдання:
• сформулювати хіміко-біологічну будову листка;
• фізико-хімічні явища перетворення;
• охарактеризувати функції клітини листка;
• дати поняття «гальванічний елемент»; • дослідити альтернативні методи утилізації;
• розглянути екологічні властивості.
Об’єкт дослідження: листок.
Предмет дослідження: біогаз, компост, еко-дрова, гальванічний елемент. Актуальність проекту
• Екологічний метод утилізації опалого листя
• Добування цінних продуктів з листя
• Економічно вигідна альтернатива для населення
Задача творчого характеру
Вас призначили директором побудованого в нашому районі заводу переробки опалого листя. Організуйте роботу таких відділів: а) постачання, б) головного технолога, в) відділ кадрів, г) реалізація продукції, д) раціональне використання продуктів переробки з опалого листя.
Класи і теми уроків з хімії, на яких можна застосувати проведення STEAM-проекту


І група Біологи
Проблемне питання «Клітина листка — хімічна лабораторія» мета: з’ясувати хіміко-біологічну будову листка; розглянути функції листка. Основні поняття: будова клітини листка, фотосинтез як основна функція листка.
Практичні завдання групи
1. Дослідити ґрунтові екологічні фактори території села Кострино.
2. Створити біодобриво з опалого листя (реакція гниття).
3. З’ясувати природне перетворення опалого листя.
4. Визначити рівень екологічної свідомості обізнаності населення щодо способів утилізації опалого листя.
ІІ група хіміки
Проблемне питання «Клітина листка — хімічна енергія»
мета: з’ясувати процеси окиснення опалого листя: гниття, бродіння, горіння; вивчити методику добування енергії з опалого листя; розглянути позитивні та негативні наслідки реакцій окиснення опалого листя.
основні поняття: реакції окиснення, з’ясувати поняття «гальванічний елемент».
Хімічна термодинаміка вивчає взаємне перетворення різних видів енергії у формі теплоти або роботи під час перебігу хімічних реакцій у термодинамічних системах.
Практичні завдання групи
1. Провести реакцію бродіння опалого листя.
2. Дослідити позитивний та негативний вплив реакції горіння.
3. Клітина листка — гальванічний елемент (https://www.youtube.com/ watch?v=BkAqm7l7_Aw;
![]() «Селфі-листок» https://www.youtube.com/ watch?v=2JDaPLQ4rZU). ІІІ група Фізики
«Селфі-листок» https://www.youtube.com/ watch?v=2JDaPLQ4rZU). ІІІ група Фізики
Проблемне питання «Клітина листка — енергетичний реактор»
мета: сформулювати поняття «термодинамічні системи»; охарактеризувати джерела
електричного струму; з’ясувати поняття «акумулятори».
основні поняття: акумулятори; джерела енергії.
Практичні завдання групи
1. Сконструювати прилад для отримання біогазу.
2. Виготовити екодру — нову нішу на ринку біопалива. Біогаз із опалого листя (хімічне явище — Бродіння)
мета: використання опалого листя як відновлювального джерела енергії; засвоїти
хімічне явище метанового бродіння через гниття опалого листя. обладнання: колба, газовідвідна трубка, гумова рукавиця. матеріали: біомаса (опале листя з глиною), гаряча вода.
Теоретичний матеріал. Листя, - утворення перегною. Розклад листя. Згорання метану в каміні. Переваги утилізації листя методом буомаси.
Хід роботи
Методика синтезу біогазу
Утворення біогазу з листя проводили з використанням бактерій, що містяться частково у самому опаді, а також у гумусовому шарі ґрунту.
У колбу завантажували подрібнену біомасу опалого листя, пересипаючи ґрунтом та заливаючи теплою водою у співвідношенні 1:1, що має відповідати загальній концентрації твердих речовин 8-11 % за масою. Колба закривалася гумовим корком з відвідною трубкою, один кінець якої знаходився над водою, а на другий прикріплювалася повітряна кулька для збирання газу.

Склад камери для отримання біогазу: 1 — колба; 2 — біомаса, залита водою; 3 — корок; 4 — скляна трубка; 5 — гумова трубка із зRа тOиHскаxч+еСмО; 2 6 — розтягнутий балон для збирання газу.
Процес отримання біогазу з опалого листя - метанове бродіння; групи бактерій; метаноутворюючі бактерії.
Пам’ятка (хіміки)
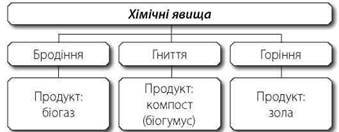
1. Біогаз — енергоносій, який є сумішшю метану (60–70 %), діоксиду Карбону (30–40 %), невеликої кількості сірководню, водню, амоніаку та оксиду Нітрогену (5 %).
Отримання біогазу з опалого листя спирається на процес метанового бродіння при гнитті.
Реакції бродіння
1) Сх(Н2О)у, білки, C3H5O3(COR)3 +Н2О = NH2R
3 +Н2О =NH2RCOOH,
R(COOH)x, R(CHO)x, R(OH)x — анаеробне зброжування шляхом біохімічного
розщеплення (гідролізу)
2) NH2RCOOH, R(COOH)x, R(CHO)x, R(OH)x + + кислотоутворюючі бактерії = (НCOO)x М, (СН3COO)xМ, СН3OH+СО2 +Н2 — реакція розкладу
3) NH2RCOOH, R(COOH)x, R(CHO)x, R(OH)x + + кислотоутворюючі бактерії = R(COOH)x,
(RCOO)xМ, R(OH)x +СО2 +Н2 +H2S+NH3 — реакція розкладу
4) R(COOH)x, (RCOO)xМ, R(OH)x+СО2+Н2 + + H2S + NH3 + метаноутворюючі бактерії =
= СО2+СН4
(СН3COO) М+ метаноутворюючі бактерії = = СО2+СН4+Мх+ СО2 +Н2+ (СН3COO )xМ +
+ бактерії = 3хСН4 + хН2О + Мх +
Хімічне явище — гниття
Компостування
Компост (біогумус) — суміш мінеральних сполук і органічних речовин «родючий ґрунт», що складається з макро- та мікроелементів, які необхідні для живлення рослин.
Реакція гниття
(C6H10O5) +О2 = солі + оксиди + + органічні речовини
Хімічне явище — горіння
Позитивні наслідки процесу горіння опалого листя («кремації» піддається листя, сильно уражене хворобами або заселене небезпечними шкідниками) Реакція горіння
(C6H10O5) +О2 = суміш деревного вугілля та золи + nН2О + nСО2
Гальванічний елемент — це хімічне джерело електричного струму, яке названо на честь Луїджі Гальвані. Принцип дії гальванічного елемента заснований на тісній взаємодії двох металів через електроліт, який призводить до виникнення в замкнутому ланцюгу електричного струму. Гальванічні елементи являють собою джерела струму, які не здатні відновлювати запас електричної енергії самостійно або взагалі. Наприклад, таким елементом є звичайні батарейки.
комПоСтування оПалоГо лиСтя (хімічне явище — Гниття)
мета: вивчити методику компостування речовин органічного походження та створити
біодо-бриво з опалого листя.
матеріали:
• ємність для компосту;• листя;
• гілочки дерев;
• ґрунт;
• пташиний послід;
• перфорована полімерна плівка; • вода.
![]() Хід заняття
Хід заняття
Теоретична частина (презентації учнів - «Компости та речовини для компостування», «Методи компостування»)
Правила виготовлення компостної ями
• Оберіть ділянку землі розміром 1x1,5 м неподалік від джерела води та у місці, куди не потрапляє пряме сонячне проміння.
• Вичистіть ділянку від дерну та трави.
• Поставте невелику огорожу навкруг своєї компостної ділянки, на кутках вбийте кілки. Залиште достатньо місця для того, щоб можна було без перешкод підійти до компостної купи.
• Ширина компостної купи — 2 м і висота — до 1,7 м.
• Компостування можна проводити в траншеях глибиною до 1 м і шириною 1,5 м. Траншейне компостування більш зручне з міркувань того, що при ньому компост рівномірно зволожується і не пересихає.
Шари компостної ями:
1. Велике та дрібне гілля — дренаж (5 см).
2. Листя і рослинні рештки (10 см). Шари листя перекладають шарами землі, щоб ґрунтоутво-рюючі бактерії могли швидше їх переробити.
3. Зволоження.
4. Ґрунт (10 см).
5. Листя і рослинні рештки (20 см).
6. Зволоження.
7. Ґрунт (15 см).
8. Листя і рослинні рештки (30 см).
9. Перфорована полімерна плівка.
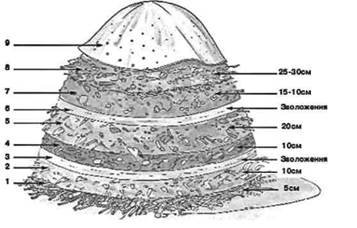
Схема компостної ями ПідГотовчий етаП
виготовлення штучної моделі компостної ями
Експериментальна частина
Створення біодобрива методом компостування опалого листя:
1. Вибрати ділянку землі на території школи.
2. ![]() Підготувати компостну яму.
Підготувати компостну яму.
3. Зібрати опале листя, дренаж.
4. Заповнити компостну яму її складовими. Рекомендації:
- Перевертання компосту 2-3 рази за 3 місяці.
- Дозрівання компосту в літній період триває 2–3 місяці, осінній —6–8 міс., збереження корисний властивостей компосту - 4 роки.
- Компост вважається готовим, якщо перетворився на однорідну темну розсипчасту масу.
Пам’ятка (біологи)
Пізнавальна хвилинка Хімічне явище — горіння
Тліюче листя

Позитивні наслідки процесу горіння опалого листя («кремації» піддається листя, сильно уражене хворобами або заселене небезпечними шкідниками).
Горіння як негативний наслідокЗгоряння
y CO2 (вуглекислий газ), спричинює парниковий ефект y CO — чадний газ y Порох утворює смог
y NO, NO2 (оксиди Нітрогену) утворюють кислотні дощі
y Cd, Hg, Pb, Bi (важкі метали) тощо провокують ракові пухлини та є
канцерогенамитління y C20H12 (бензопірен) — це поліциклічний вуглеводень або ароматична сполука, який
провокує виникнення онкологічних захворювань y Діоксини (2,3,7,8-тетрахлордибензо-p-діок-син) — це велика група хлорованих ароматичних вуглеводнів, іще називають «екологічним брудом», уражають печінку, центральну нервову систему, спричиняють стан депресії, канцерогени
y RCHO (альдегіди) є причиною відчуття, коли дим «їсть» очі Дим — суміш неорганічних та органічних сполук.
Доповідь про дим, згорання, вдихання диму, хвороби для людей.
Хімічне перетворення реакції горіння опалого листя
Опале листя → леткі органічні сполуки (ЛОС) → → вода, вуглекислий та чадний гази, вуглець.
Будівельним матеріалом для листків є сахариди (вуглеводи), тож формулу опалого листя відображають полісахаридом (біополімер): (C6H10O5 )n — загальна формула крохмалю або целюлози (клітковини). Під час горіння опалого листя утворюються леткі органічні сполуки (ЛОТ), деревне вугілля та газоподібна речовина формальдегід CH2O.
(C6H10O5 )n +О2 = деревне вугілля + nCH2O
Після того, як леткі гази досягають 260 °С, формальдегід вступає в реакцію під назвою газифікація, що відбувається за наявності кисню у атмосфері з утворенням води, вуглекислого газу та інших речовин. Ця реакція виділяє велику кількість теплової енергії (екзотермічна), яка провокує подальші хімічні реакції, тому вогонь — це самопоглинаюча реакція, допоки присутнє паливо та кисень.
6CH2O+3O2 = 6H2O+2CO2 +2CO +2C+тепло
(C6H10O5 )n +О2 = суміш деревного вугілля та золи + nН2О+nСО2
Визначення рівня екологічної свідомості обізнаності населення щодо способів утилізації опалого листя
Мета: через анкетування та опитування батьківського колективу учнів Червоненьского ліцею визначити рівень екологічної свідомості населення щодо способів утилізації опалого листя.
Хід заняття
1. Анкетування
![]() Оберіть варіанти відповідей на запитання серед запропонованих.
Оберіть варіанти відповідей на запитання серед запропонованих.
1) Що ви робите з опалим листям після його прибирання: а) спалюєте;
б) поміщаєте до компостної ями;
в) вивозите на смітник;
г) інше (вкажіть, що саме)? 2) Чи можна опале листя спалювати
а) так;
б) ні?
3) Чи відомо вам про шкідливі викиди в атмосферу під час спалювання листя: а) так;
б) ні?
4) Яка роль опалого листя в природі:
а) захищає коріння рослин узимку від морозів, а влітку — від спеки;
б) знижує температуру навколишнього середовища;
в) акумулює вологу;
г) очищує повітря навколишнього середовища;
д) розкладаючись, стає добривом для ґрунту?
5) Як впливає спалювання листя на навколишнє середовище: а) знищує життя на ділянці землі під вогнищем;
б) сприяє швидкому відновленню трави на місці згарища;
в) є одним із чинників парникового ефекту (глобальне потепління);
г) знищує шкідників на ділянці землі?
6) Чи використовуєте ви опале листя як добриво на присадибних ділянках: а) так;
б) ні?
Обробка результатів
Опитано було 80 батьків.
Відповідь на питання: Що ви робите з опалим листям після його прибирання?
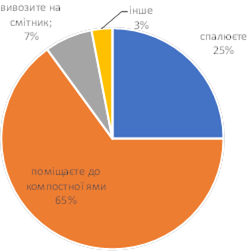
Інформаційна хвилинка Фізичний процес перетворення опалого листя
Пресування опалого листя — це фізичне явище, тобто процес обробки листя тиском (давленням) з метою ущільнення, зміни форми для виготовлення паливних брекетів, якими можна замінити традиційні енергетичні ресурси на альтернативно-екологічне джерело енергії.
Паливні брикети або спресоване опале листя називається екодрова, іншими словами, екологічно чисті дрова. Технологія виробництва таких екодров полягає не тільки в сушінні й ущільненні біомаси (на одне поліно йде приблизно один не-пресований «великий чорний сміттєвий мішок» з листям).
Брикети з біовідходів і відходів виробництва — перспективна й екологічна альтернатива газу, вугіллю, дереву і подібним традиційним видам палива для обігріву житла. Сьогодні ні для кого не секрет, що видобуток вугілля і газу,вирубка дерев завдають серйозної шкоди природі. Плюс до цього, під час горіння вугілля виділяє шкідливі для здоров’я речовини — аерозолі важких металів, радіоізотопи тощо. Під час спалювання бурого вугілля (містить багато сірки) виділяються сірчисті ангідриди, які, вступаючи в реакцію в повітрі з водою і водяною парою, утворюють пари сірчистої кислоти. Паливні брикети з біомаси набагато екологічніші. Їх можна виготовити із соломи, опалого листя дерев, макулатури, тирси і навіть водоростей. Загалом підійде будь-яка органіка. Паливні брикети можна виготовити самостійно, для чого не буде потрібно дорогого обладнання. Все, що для цього потрібно — це прес, який можна зробити своїми руками. Брикет з біопалива складається з основного і зв’язувального матеріалу. В якості основи можна взяти будь-які рослинні відходи: опале листя або листя зі стружкою дерева, гілки, кору, лозу, солому, макуху, бадилля, лушпиння насіння, водорості з пляжу. В якості зв’язувального матеріалу, необхідного для «склеювання» основи, можна взяти макулатуру. Її збирають, подрібнюють, замочують, з’єднують з основою (1:6 або 1:9), перемішують будівельним міксером і відправляють усе під прес. Якщо здаєте макулатуру на переробку, то в якості зв’язувального матеріалу для брикету можна використовувати крохмаль.
Листя дерев має досить високу теплотворну здатність (ТЗ). Як показали лабораторні дослідження, ТЗ листя каштана — 2300 ккал/кг, псев-доакації — 2440 ккал/кг, липи — 2850 ккал/кг. Дуже енергоефективні біовідходи тополі (2900 ккал/кг) і сосни (3700 ккал/кг). А ТЗ водоростей (2500 ккал/кг) всього на 30 % менше, ніж у деревини.
Наприклад, британці в кінцевий продукт додають віск у співвідношенні 70 % листя і 30 % воску, так що поліна з Бірмінгема на 70 % «вуглець-нейтральні». Незалежні випробування показали, що «дрова» Leaf Log дають 27,84 МДж енергії на кілограм, що відповідає високоякісному вугіллю і перевищує теплоту згоряння дерева. При цьому одне поліно горить безперервно 2–3 години, що втричі довше, ніж дерев’яна колода тієї ж ваги. І шкідливий «вихлоп» від такого поліна невеликий. У Краматорську для опалення однієї лікарні використовують опале листя. Листя не вивозять на смітник, а складають у спеціальні мішки, які потім поміщають у котли.
Опале листя — цінний матеріал, який щоосені збирається і вивозиться на сміттєзвалища. Так чому ж не використовувати його з користю? Паливні брикети з біомаси — це енергоефективний матеріал, спалювання якого не шкодить природі й людям, тобто екодрова з опалого листя як цінне джерело енергії — нова ніша на ринку біопалива.
Хімічний склад листка деяких рослин
Клен
Молоде листя. Хімічний склад рослини вивчено недостатньо. Відомо, що сік містить цукор (1,4 %) і каучук (1,1 %), а листя — дубильні речовини, каучук, алкалоїди, каротин (провітамін А) (до 13,2 %) та аскорбінову кислоту (вітамін С) (до 270 мг %).
Каштан кінський (звичайний гіркокаштан звичайний)
Листя містить флавоноїди, каротиноїди, крохмаль. Сировина для виготовлення медичних препаратів.
Калина
Містить салікозид, кумаринові похідні (скополетин, ескулетин), амантофлавон, живицю, вібур-нін, дубильні речовини, валеріанову й інші органічні кислоти.
Дуб черешковий (звичайний)
Кора та листя містять дубильні речовини.
Горіх волоський
![]() Молоде листя має такий хімічний склад — альдегіди, ефірна олія, алкалоїди, вітаміни С, РР, каротин, фенол-карбонові кислоти, дубильні речовини, кумарин, флавоноїди, барвна речовина юглон, яка має бактерицидну властивість, високі ароматичні вуглеводні, антоціани, хінони.
Молоде листя має такий хімічний склад — альдегіди, ефірна олія, алкалоїди, вітаміни С, РР, каротин, фенол-карбонові кислоти, дубильні речовини, кумарин, флавоноїди, барвна речовина юглон, яка має бактерицидну властивість, високі ароматичні вуглеводні, антоціани, хінони.
Осика звичайна або тополя тремтяча
Молоде листя має такий хімічний склад: вуглеводи, органічні кислоти, каротиноїди, вітамін C, каротин, флавоноїди, фенолглікозиди, антоціани, дубильні речовини, має протимікробні властивості. Завдання для учнів
1. Назвати хімічне явище перетворення листя. (Реакції окиснення)
2. Як називається продукт реакції бродіння опалого листя? (Метан — біогаз)
3. Як називається продукт реакції гниття опалого листя? (Компост — біогумус)
4. Як називається продукт реакції горіння опалого листя? (Зола)
5. Хімічне джерело електричного струму, що утворюється за допомогою фотосинтезу, називається... (Гальванічним елементом)
6. Назвати побічний продукт фотосинтезу, який потім вступає в реакцію окиснення, в результаті якої утворюються вільні електрони, що можна використати для отримання електроенергії. (Вуглевод — цукор)
7. Назвати два види реакції горіння та речовину, що утворюється. (Згорання, тління, дим) ДЖЕРЕЛА
1. Білик О.М. Хімія у визначених таблицях и схемах 7-11 клас. Рятівник. К.: «Ранок», 2018.
32 с.
2. Березан О. Хімія: Збірник задач для учнів ЗЗСО. Підручник, 2021. 368 с.
3. Гога С. Т., Ісаєнко Ю. В. Хімія. Практичний довідник. К.: Весна, 2020. 28 с.
4. Гриньова М. В., Шиян Н. І., Пустовіт С. В., Джурко Г. Ф. Хімія. Довідник для абітурієнтів и школярів. К.: Літера, 2018.
5. Євсєєв Р. Хімія в таблицях. Посібник. К.: Ранок, 2020. 32 с.
6. Ярошенко О. Збірник вправ і задач з хімії 7-11 класи. Підручник. К.: «УОВЦ
«Оріон», 2021. 272 с.
7. ![]() Опорні схеми на уроках хімії 7 клас URL: https://naurok.com.ua/mini-pidruchnik-opornishemi-na-urokah-himi-254742.html
Опорні схеми на уроках хімії 7 клас URL: https://naurok.com.ua/mini-pidruchnik-opornishemi-na-urokah-himi-254742.html
8. Островерхова Н. І.Довідник у таблицях - Хімія. 7-11 класи. К.: Ула, 2022. 34 с.
9. Підручники з хімії онлайн URL: https://znohimbio.jimdofree.com/ підготовка-до-зно-з-хімії/
10. Семеняк В.А. Авторський канал IOK з Хімії для учнів URL: https://t.me/+DSQUUQ7Ayd9hZWQy
11. Схема хімічної реакції. Хімічні рівняння URL: https://lms.e-school.net.ua/assetv1:UIED+Chemistry-7th-
grade+2020+type@asset+block@%D0%BA%D0%BE%D0%BD%D1%81%D0%BF%D0%B 5%D0%BA%D1%82__39_.pdf
12. Приклади задач ЗНО з хімії URL: https://vstup.chem.knu.ua/zno-tasks
13. ЗНО-онлайн. Завдання за темою хімії URL: https://zno.osvita.ua/chemistry/tagrozvjazuvannja_zadach_za_rivnjannjamy_reakcij__kombinovani_zadachi/


про публікацію авторської розробки
Додати розробку