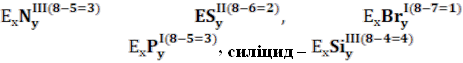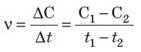Практичний порадник "Інтерактивні опорні конспекти з хімії в схемах та таблицях" (для учнів 7-8 класів)

Семеняк В.А.
Інтерактивні опорні конспекти з хімії в схемах та таблицях (для учнів 7-8 класів). Практичний порадник. Червоне. 2024.
Матеріали запропонованого практичного порадника адаптовано до вимог навчальних програм для 7-8 класів. У зручній формі (у вигляді формул, схем та таблиць) викладено базисні поняття хімії, що полегшує розуміння складних концепцій, використання інтерактивних елементів сприяє активній участі учнів та поглибленню знань. QR коди в посібнику впроваджуються для забезпечення інтерактивності та зручності навчання: містять зашифровані схеми та таблиці, сприяють груповій та колективній активності, формуванню не лише хімічних знань, але і розвитку критичного мислення та лабораторних навичок учнів. Загалом використання QR кодів урізноманітнює навчальний процес, підвищуючи інтерес та залучення учнів до вивчення хімії.
Практичний порадник дозволяє застосовувати отримані знання у реальних ситуаціях, що робить вивчення предмету «Хімія» більш ефективним. QR коди на основі інтерактиву можуть слугувати для організації пошукової роботи в межах уроку або певного заходу, надаючи цікавий спосіб активізації пізнавальної діяльності, формування та розвитку предметних компетентностей учасників освітнього процесу.
© В.А. Семеняк, Червоне. 2024.
ЗМІСТ
ВСТУП ...................................................................................................................... 3
7 КЛАС ..................................................................................................................... 5 1. Початкові хімічні поняття ............................................................................. 5
2. Прості речовини ........................................................................................... 13
3. Вода ............................................................................................................... 19 4. Фізичні величини в шкільному курсі хімії ................................................. 22
8 КЛАС ................................................................................................................... 24
1. Складні речовини ......................................................................................... 24
2. Періодичний закон, періодична система, будова атома ............................. 33 СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ ................................................... 38
7 КЛАС 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ
Хімія – наука про речовини та їхні властивості, будову, застосування, перетворення та явища, які супроводжують ці перетворення.
Завдання хімії:
1) вивчити властивості речовини та правильно їх використовувати;
2) синтезувати нові речовини і застосовувати їх у народному господарстві.
ФІЗИЧНІ ТІЛА, РЕЧОВИНИ, МАТЕРІАЛИ
Фізичні тіла Речовина Матеріали
це все те, що нас це те, з чого це речовини або суміші речовин, із
оточує (мають складаються яких людина виготовляє фізичні тіла
форму та об’єм) фізичні тіла
Традиційні Сучасні
Книга, крапля Дерево, камінь
Залізо, вода,
води, крижинка, залізо, глина, Пластмаси,
алюміній, мідь
стіл, цвях кістки, кермети,
норпласти...
сухожилля…
Властивості речовин
Властивості речовин – ознаки речовин, за якими вони схожі або відрізняються між собою
Фізичні Хімічні
1) колір; 2) блиск; визначають під час
3) запах; 4) смак; хімічних реакцій
5) густина; 6) температура кипіння;
7) температура плавлення; 8) теплопровідність; 9) електропровідність; 10) розчинність у воді; 11) пластичність.
!!! Агрегатний стан не є фізичною властивістю – це стан речовин за певних умов
 Чиста речовина – це речовина, яка не містить домішок і має сталі фізичні властивості
Чиста речовина – це речовина, яка не містить домішок і має сталі фізичні властивості
 |
СУМІШІ
|
Суміші – це сукупність декількох речовин, у яких вони зберігають свої фізичні властивості |
|
|
Однорідні (гомогенні) – це суміші, в яких навіть під мікроскопом не можна побачити часточок речовин |
Неоднорідні (гетерогенні) – це суміші, в яких неозброєним оком можна побачити часточки речовин |
|
Сіль і вода, цукор і вода, спирт і вода |
Глина і вода, крейда і вода, бензин і вода, повітря, граніт |

Методи розділення сумішей
|
Методи розділення сумішей (ґрунтуються на їх фізичних властивостях) |
|
|
|
|
|
Однорідні |
Неоднорідні |
|
1) Випарювання (сіль і вода) 2) Кристалізація (цукор і вода) 3) Дистиляція – перегонка (спирт і вода) Грунтуються на різних температурах кипіння речовин! |
1) Відстоювання (пісок і вода) 2) Флотація (сірка і вода, папір і вода) 3) Декантація – переливання (пісок і вода) 4) Фільтрування (пісок і вода) 5) Ділильна лійка (олія і вода, бензин і вода) 6) Дія магнітом (Fe, Co, Ni – мають магнітні властивості) |
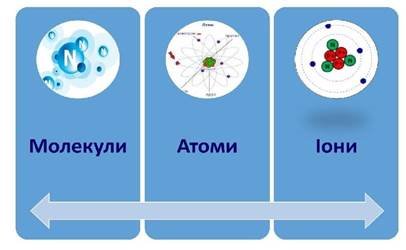
СТРУКТУРНІ ЧАСТИНКИ РЕЧОВИНИ
|
Структурні частинки речовини |
||
|
|
|
|
|
молекула |
атом «неподільний» |
йон |
|
Це найменша частинка речовини, яка володіє її хімічними властивостями і здатна до самоіснування |
1) Атом – це найменша хімічно неподільна частинка речовини. 2) Атом складається з позитивного ядра і негативних електронів, які рухаються навколо нього. (1911 р., Резерфорд) 3) Сучасне визначення атома. Атом – це електронейтральна частинка речовини, бо кількість протонів та електронів однакова |
Заряджена частинка речовини, на яку перетворюється атом, віддаючи або приєднуючи електрони.
Катіон – це позитивний йон (E+) Аніон – це негативний йон (E-) |
|
Хімічний елемент – це атоми з однаковим зарядом ядра (див. № х. ел. в періодичній системі). Наприклад, усі атоми Всесвіту із зарядом ядра +2 – це один хімічний елемент – Гелій. (Чого більше – атомів чи хімічних елементів?) |
||
|
Усі відомі людству хімічні елементи розміщені в періодичній системі Д.І. Менделєєва. Сучасні символи хімічних елементів запропонував Я. Берцеліус у XIX ст. Назва хімічного елемента пишеться з великої літери |
||
|
Найпоширеніші хімічні елементи у земній корі: O, Si, Al, Fe, Ca, Na, K, Mg. Найпоширеніші хімічні елементи Всесвіту: H (75 %), He (24 %) |
||
|
Хімічні елементи поділяють на метали та неметали (див. періодичну систему хімічних елементів). Метали пластичні, тепло- та електропровідні, мають металевий блиск. Неметали крихкі, більшість діелектрики (тільки графіт добре проводить електричний струм, тому з нього виготовляють електроди) |
||

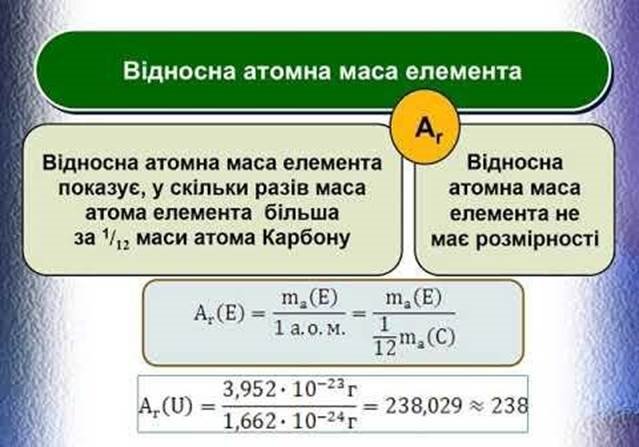
ВІДНОСНА АТОМНА МАСА ХІМІЧНИХ ЕЛЕМЕНТІВ
|
|
|
|
Відносна атомна маса хімічних елементів (Ar) – це фізична величина, яка дорівнює відношенню маси атома x. ел. до 1/12 маси атома Карбону. Наприклад, Ar(K) = 39 а.о.м.; Ar(Cu) = 64 а.о.м.; Ar (Cl) = 35,5 а.о.м. |
|
|
Фізичний зміст відносної атомної маси хімічних елементів. Вона показує у скільки разів маса атома хімічного елемента більша за 1/12 маси атома Карбону (тому це безрозмірна величина). |
|
|
|
маса атома х. ел. (г) = Ar 1/12 маси атома С (г) |
|
1/12 маси атома C – це 1 а.о.м. (атомна одиниця маси), яка дорівнює 1,66 |
|

 БУДОВА РЕЧОВИН
БУДОВА РЕЧОВИН
|
|
|
|
Молекулярна (Heме-Неме) – дальтоніди |
Немолекулярна (Ме-Неме) – бертоліди |
|
Молекулярна будова речовин у газів, рідин та деяких твердих речовин: летких, із запахом, з низькою температурою плавлення (до 200 °С), тому що зв’язки між молекулами слабкі і легко руйнуються: H2↑, H2O, H2SO4... |
Це речовини, які складаються з атомі, йонів або інших частинок. Зв’язки між такими частинками сильні, важко руйнуються, тому за н. у. – це, як правило, тверді речовини з високою температурою плавлення: KCl, NaOH, CaO, MgSO4... |
|
Закон сталості складу (1799 р. французький учений Ж. Пруст). Кожна чиста речовина молекулярної будови має постійний (сталий) склад, що не залежить від місця та способу її одержання |
|
|
План характеристики речовин за хімічною формулою: 1) якісний склад (скільки хімічних елементів); 2) кількісний склад (скільки атомів); 3) класифікація; 4) будова; 5) фізичні властивості та агрегатний стан за н. у. |
|
|
Валентність – це властивість атомів хімічних елементів утворювати певну кількість зв’язків з іншими атомами |
|||
|
|
|
||
|
Стала |
Змінна |
||
|
O(II), H(I) |
хім. ел. ІV групи головної підгрупи – (II, ІV) |
||
|
хім. ел. І групи головної підгрупи – (І) |
хім. ел. V групи головної підгрупи – (IIІ, V), викл. N(I-V) |
||
|
хім. ел. ІІ групи головної підгрупи – (ІІ) |
хім. ел. VІ групи головної підгрупи – (II, ІV,VІ), викл. O(II) |
||
|
хім. ел. ІІІ групи головної підгрупи – (ІІІ) |
хім. ел. VІІ групи головної підгрупи – (I, ІІІ,V, VІІ), викл. F(I) |
||
|
|
|||
|
|
Запам’ятай! |
|
|
|
Zn(II), Cu(I, II), Fe, Co, Ni(II, III). |
|||
|
2) Неметали, як правило, мають вищу валентність, яка дорівнює номеру групи, та нижчу валентність (див. наст. пункт). 3) |
|||
 ВАЛЕНТНІСТЬ
ВАЛЕНТНІСТЬ
ВІДНОСНА МОЛЕКУЛЯРНА МАСА РЕЧОВИНИ
|
|
||
|
Відносна молекулярна маса речовини (Mr ) – це фізична величина, яка дорівнює відношенню маси молекули до 1/12 маси атома Карбону. Наприклад, Mr(H2SO4) = 1 |
||
|
Фізичний зміст відносної молекулярної маси речовини. Вона показує у скільки разів маса молекули більша за 1/12 маси атома Карбону (безрозмірна величина). |
||
|
Маса молекули (г)
|
Маса молекули (г) = M r (речoвини) |
|
|
1/12 маси атома C – це 1 а.о.м. (атомна одиниця маси), яка дорівнює 1,6610-2 (г) або 1,6610-2 (кг) |
||
|
|
||
|
|
|
|
Явища – це будь-які зміни |
|
|
Фізичні Під час фізичних явищ не утворюються нові речовини (плавлення, замерзання, фільтрування, дистиляція, кування...) Ознаки: 1) зміна форми; 2) зміна агрегатного стану |
Хімічні – хімічні реакції Під час хімічних явищ утворюються нові речовини (горіння, гниття, нейтралізація кислоти...) Ознаки: зміна кольору; 2) поява запаху; 3) поява осаду; 4) виділення тепла – екзотермічні; 5) поглинання тепла – ендотермічні; 6) виділення світла |
|
Умови виникнення і припинення хімічних реакцій (виникнення та гасіння пожеж) |
|
|
1) нагрівання речовин до певної температури; 1) охолодження речовин; 2) дотик речовин (подрібнення і перемішування) 2) роз’єднання речовин |
|
|
|
|
|
Закон збереження маси речовин (1748 М. В. Ломоносов прожарював метали у закритих ретортах) Маса речовин, які вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції. |
|
|
Пояснення закону 1) Під час хімічної реакції молекули руйнуються на атоми. 2) Атоми не руйнуються, бо хімічно неподільні, а перегруповуються у нові молекули. 3) Кількість атомів до реакції дорівнює кількості атомів після реакції. |
|
|
|
|
|
Значення закону – дозволяє записувати рівняння хімічних реакцій і проводити розрахунки за ними. |
|
|
Хімічне рівняння – це умовний запис хімічної реакції за допомогою хімічних формул та математичних знаків (коефіцієнтів). |
|
|
Атомно-молекулярне вчення – це вчення про будову речовин. (Основоположник – Дж. Дальтон і М. Ломоносов середина 18 ст.) |
|
 ЯВИЩА
ЯВИЩА
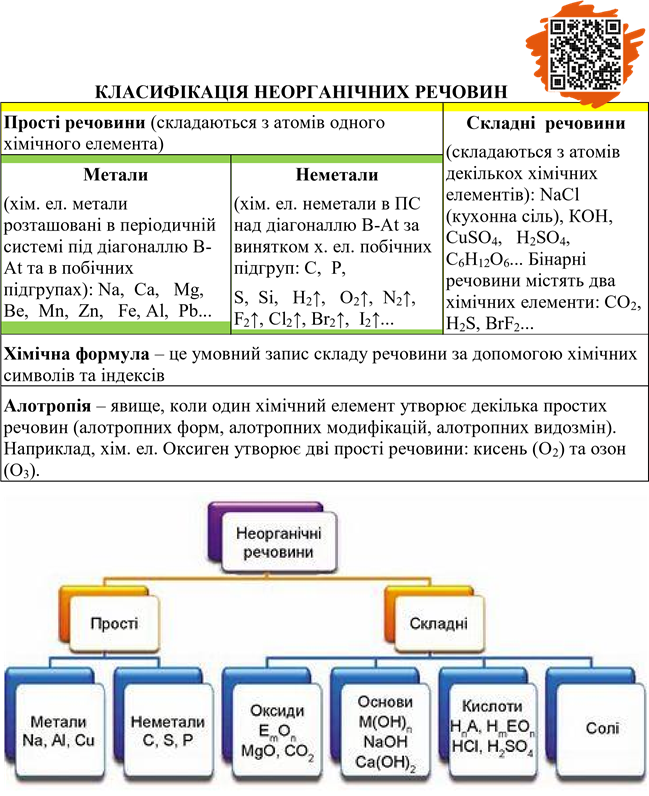
 2. ПРОСТІ РЕЧОВИНИ
2. ПРОСТІ РЕЧОВИНИ
Прості речовини – складаються з атомів одного хімічного елемента (з атомів одного виду). Назва деяких простих речовин не співпадає з назвою хімічних елементів, які їх утворили. Назва хімічного елемента пишеться з великої букви, а простої речовини – з малої.
|
Хімічний елемент |
Назва хімічного елемента |
Формула та назва простої речовини |
|
N |
Нітроген |
N2↑ азот |
|
H |
Гідроген |
H2↑ водень |
|
C |
Карбон |
C вуглець, вугілля, сажа, графіт, кокс, алмаз |
|
O |
Оксиген |
O2↑ кисень |
|
S |
Сульфур |
S сірка |
|
F |
Флуор |
F2↑ фтор |
|
Cl |
Хлор |
Cl2↑ хлор |
|
I |
Іод |
I2 йод |
|
Fe |
Ферум |
Fe залізо |
|
Au |
Аурум |
Au золото |
|
Ag |
Аргентум |
Ag срібло |
|
As |
Арсен |
As миш’як |
|
Hg |
Меркурій |
Hg ртуть |
|
Cu |
Купрум |
Cu мідь |
|
Ni |
Нікол |
Ni нікель |
|
Sn |
Станум |
Sn олово |
|
Sb |
Стибій |
Sb сурма |
|
Pb |
Плюмбум |
Pb свинець |

КИСЕНЬ
|
Поширення у природі 1) Найпоширеніший хімічний елемент на Землі – Оксиген. 2) Кисень міститься у повітрі.
|
Фізіологічна дія кисню: 1) бере участь у процесі дихання; 2) у клітинах забезпечує реакції окиснення.
|
Фізичні властивості За стандартних умов це безбарвний газ, без запаху, малорозчинний у воді, важчий за повітря. У зрідженому стані кисень – рідина блакитного кольору.
|
|
Повітря – це суміш газів, де кисню 21 % за об’ємом (23 % за масою), 78 % азоту, 1 % – решта газів: інертні гази, вуглекислий газ, водяна пара, та інші.
|
Одержання кисню в лабораторії (кисень у лабораторії одержують розкладом деяких оксигеновмісних речовин)
|
|
|
Якісна реакція на кисень – спалахування тліючої скіпки, бо кисень підтримує горіння.
|
Збирання кисню в лабораторії: 1) витискуванням води, бо кисень погано розчиняється у воді; 2) витискуванням повітря, бо кисень важчий за повітря M( M(пов.) = 29 г/моль).
|
|
|
Одержання кисню в промисловості Кисень одержують із зрідженого повітря. Зберігають кисень у кисневих танках – стальних балонах синього кольору, із подвійними стінками, між якими немає повітря (посудина Дьюара).
|
||


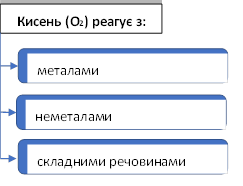 Хімічні властивості кисню
Хімічні властивості кисню
|
1) Під час реакції складної речовини з киснем утворюється |
оксид кожного |
|
|||
|
|
Оксиди – це складні речовини, які містять два хімічних елементи, один з яких Оксиген (пишеться на другому |
||||
|
2) Кисень – |
|||||
місці).
Реакція сполучення – це реакція, в результаті якої з двох або більше вихідних речовин утворюється одна нова складна речовина.
Реакція розкладу – це реакція, в результаті якої з однієї складної речовини утворюється декілька простіших речовин.
Каталітична реакція – це реакція за участі каталізатора. Каталізатори – це речовини, які змінюють швидкість реакції, але не входять до складу її продуктів.
Горіння – це реакція з виділенням теплоти і світла, при цьому відбувається окиснення речовин.
Окиснення (повільне окиснення) – це реакція з виділенням теплоти, при цьому відбувається окиснення речовин.
Екзотермічна – це реакція з виділенням теплоти.
Ендотермічна – це реакція з поглинанням теплоти. Кругообіг оксигену в природі

дихання, гниття)


ФІЗИЧНІ ВЕЛИЧИНИ ТА ЇХ ОДИНИЦІ ВИМІРЮВАННЯ
|
Фізичні величини |
Одиниці вимірювання |
|
1) маса |
m [кг,г] |
|
2) об’єм |
V [м3, л ] |
|
3) густина |
ρ [кг/м , г/см , г/мл] для газів [г/л] |
|
4) відносна атомна маса |
|
|
5) відносна молекулярна маса |
M r [безрозмiрна], (рази) 1 а.о.м. = 1,6610-24 (г) = 1,66 10-27 (кг) |
|
6) масова частка |
ω [%] |
|
7) кількість речовини |
n [моль] |
|
8) молярна маса |
M [г/моль] |
|
9) молярний об’єм |
Vm =22,4 л/моль |
|
10) число Авогадро |
NA =6,021023 частинок/моль |
|
11) відносна густина газів |
D(↑) [безрозмiрна величина] |
• tпл =0°C,
• tкип. =100 °C
Хімічні властивості води
1. Вода реагує з кислотними оксидами з утворенням відповідних кислот (пісок SiO2 з водою не реагує).
|
|
|
|
Кислотні оксиди реагують з водою з утворенням відповідної кислоти – кислотного гідрату Пісок (SiO2 ) з водою не реагує |
|
|
CO2 +H2O→H2CO3 (карбонатна кислота) |
N2O5 +H2O→HNO3 (нітратна кислота) |
|
SO2 ↑ + H2O -> H2SO3 (сульфітна кислота) |
N2O3 +H2O→HNO2 (нітритна кислота) |
|
SO3 +H2O→H2SO4 (сульфатна кислота) |
NO2 ↑ + H2O → HNO2 + HNO3 (нітритна та нітратна кислоти) |
|
P2O5+H2O(гар.)→H3PO4 (ортофосфатна кислота) |
P2O5 + H2O(хол.) → HPO3 (метафосфатна кислота) |
2. Вода реагує з основними оксидами активних металів з утворенням розчинних основ – лугів (див. таблицю розчинності кислот, основ і солей у воді).
Активні метали у витискувальному ряду стоять до магнію.
|
|
|
З водою реагують тільки оксиди активних металів (у витискувальному ряду стоять до магнію) |
|
1) Na2O+H2O → NaOH (натрій гідроксид), реакція можлива, бо утворюється луг – розчинна основа |
|
2) MgO + H2O→ реакція не відбувається, бо MgO відповідає нерозчинна основа Mg(OH2) ↓ (магній гідроксид) |
|
3) CaO + H2O→ Ca(OH) (кальцій гідроксид), реакція можлива, бо утворюється луг – розчинна основа |

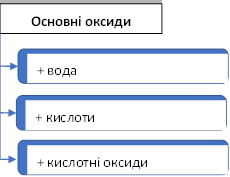
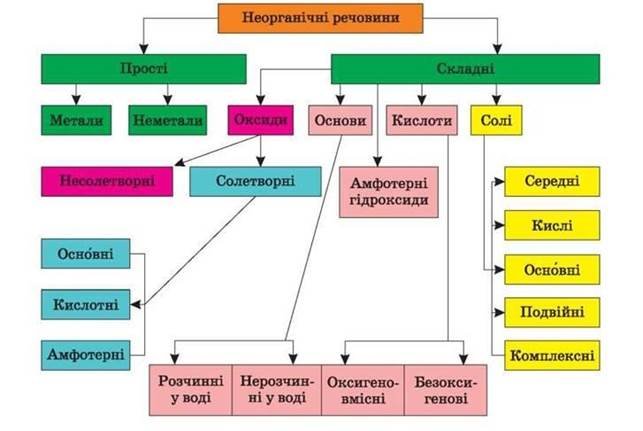
КЛАСИФІКАЦІЯ ОКСИДІВ
|
|
|||
|
Оксиди – це складні речовини, які містять два хімічних елементи, одним з яких є Оксиген (пишеться на другому місці) |
|||
|
Несолетворні оксиди |
Солетворні оксиди (утворюють солі) |
||
|
«байдужі» HeмехОy не взаємодіють з водою, кислотами, лугами. Реагують з киснем |
Кислотні оксиди (ангідриди) HeмехОy – це оксиди, яким відповідають кислоти. Вони виявляють кислотні властивості |
Основні оксиди MехОy – це оксиди, яким відповідають основи. Вони виявляють основні властивості |
Амфотерні оксиди МехОy – це оксиди, яким відповідають амфотерні гідроксиди. Вони виявляють подвійні властивості: кислотні та основні |
|
NO ↑, N2O ↑, CO ↑ |
CO2↑→H2CO3 |
Na2O→NaOH |
BeO→Be(OH)2↓ |
|
|
SO2↑→H2SO3 |
К20 –» КОН |
ZnO→Zn(OH)2↓ |
|
2CO+O2 = 2CO2 |
SO3 →H2SO4 |
Li2O→LiOH |
SnO→Sn(OH)2↓ |
|
2NO+O2 =2NO2 |
N2O5 →HNO3 |
CaO→Ca(OH)2 |
PbO→Pb(OH)2↓ |
|
|
N2O3 →HNO2 |
BaO→Ba(OH)2 |
|
|
|
P2O5 →H3PO4 |
MgO→Mg(OH)2↓ |
Al2O3→Al(OH)3↓ |
|
|
SiO2 -> H2SiO3l |
CuO→Cu(OH)2↓ |
Cr2O3 → Cr (OH) ↓ |
|
|
NO2↑ суміш HNO2 і HNO3 |
FeO→Fe(OH)2↓ |
Fe2O3→Fe(OH)3↓ |
|
Неметали утворюють кислотні оксиди та кислоти Неме →НемехОy →НхКЗ, наприклад C→CO2 →H2CO3 |
|||
|
Метали утворюють основні оксиди та основи Me → MeхOу → Me (OH), наприклад Na →Na2O → NaOH |
|||
Склад розчинів
|
Розчини – це однорідні суміші, які складаються з розчинника і розчиненої речовини |
|
|
Розчинник – це компонент розчину, який перебуває у тому самому агрегатному стані, що й розчин |
Розчинена речовина – може перебувати у будь-якому агрегатному стані. У розчині може міститися кілька речовин |
Масова частка розчиненої речовини (процентний вміст розчину) (ω, ω %) – це фізична величина, яка визначається відношенням маси розчиненої речовини до маси розчину.
ω= маса розчиненої речовини/маса розчину
Її фізичний зміст – вона показує скільки грамів речовини розчинено в 100 грамах розчину.

4. ФІЗИЧНІ ВЕЛИЧИНИ В ШКІЛЬНОМУ КУРСІ ХІМІЇ
|
Фізичні величини |
Одиниці вимірювання |
|
Маса |
(кг, г, т, ц) 1кг =1000 г =1 |
|
Об’єм |
(м3, л, дм3, см3, мл) 1 л = 1 дм ; 1л = 1000мл ( cм3 ) = 1 |
|
Густина для рідин та твердих речовин дорівнює відношенню маси речовини до її об’єму |
ρ (кг/м3, г/см3, г/мл) ρ= m/V |
|
Густина для газів дорівнює відношенню молярної маси речовини до молярного об’єму |
ρ (г/л)
|
|
Відносна атомна маса дорівнює відношенню маси атома хімічного елемента до 1/12 маси атома Карбону |
A r (безрозмірна), (рази), а.о.м. – атомні одиниці маси фізичний зміст. Ця величина показує у скільки разів маса атома більша за 1/12 маси атома Карбону (1/12 маси атома С – це 1 а.о.м. (атомна одиниця маси), яка дорівнює 1,66 1024(г), або 1,66 10-27(кг)???) |
|
Відносна молекулярна маса речовини дорівнює відношенню маси молекули до 1/12 маси атома Карбону |
r (безрозмірна), (рази), а.о.м. – атомні одиниці маси Фізичний зміст. Ця величина показує у скільки разів маса молекули більша за 1/12 маси атома Карбону (1/12 маси атома С – це 1 а.о.м. (атомна одиниця маси), яка дорівнює 1,66 1024(г), або 1,66 10-27(кг)???) |
|
Масова частка показує частку від загальної маси |
ω (%, або в частках) |
|
Об’ємна частка показує частку газу від загального об’єму суміші |
(%, або в частках, яка співпадає з мольною часткою газів у суміші) |
|
Мольна частка показує частку речовини в 1 моль суміші |
χ(моль)??? M(сумiшi) = χ1M1 + χ2M2 + χ3M3 ??? (χ – каппа з грецьк. абетки ) |
|
Кількість речовини показує кількість частинок у речовині |
n(моль) або ν(моль)??? |
|
Молярна маса – це маса 1 моль речовини |
M(г/моль) ??? Запам’ятай! M(пов) = 29 г/моль ??? |
|
Молярний об’єм – це об’єм 1 моль газу за н. у. |
Vm = 22,4 л/моль за н. у., або Vm = 22,4 дм /моль ??? Нормальні умови: температура 0 °С, або 273 °К; тиск 1 атмосфера, 101,3 кПа, 1 |
|
Число (стала) Авогадро – стала |
NA =6,02 1023 моль л/моль |
 Фізичні величини в шкільному курсі хімії
Фізичні величини в шкільному курсі хімії
|
Фізичні величини |
Одиниці вимірювання |
|
величина |
Фізичний зміст. Показує кількість молекул в 1 моль речовини. |
|
13) Відносна густина газів – це відношення молярної маси одного газу до молярної маси іншого газу
|
D(↑) (безрозмірна величина) (рази)
Фізичний зміст. Ця величина показує у скільки разів один газ важчий за інший |
|
Закон авогадро |
|
|
В однакових об’ємах газів за однакови |
х умов міститься однакове число молекул. |
|
Закон об’ємних відношень |
газів (закон Гей-Люссака) |
|
Об’єми газів у хімічних реакціях відно рівняннях хімічних реакцій) |
сяться між собою як невеликі цілі числа (див. коефіцієнти у |
|
Взаємозв’язок фізичних величин
|
|
|
14) Розчинність речовини у воді |
г/л Фізичний зміст. Скільки грамів речовини розчиняється в 1 л води при t = 20 °C |
|
15) Масова частка розчиненої речовини (процентна концентрація розчину) – це відношення маси речовини до маси розчину |
ω (%, або частках) ω(%)= m (речовини) / m(розчину) Ця величина показує скільки грамів речовини у 100 г розчину |
|
|
|
|
16) Молярна концентрація розчину – це відношення кількості речовини до об’єму розчину |
C (моль/л) C =n(речовини) / V (розчину) ??? Фізичний зміст. Ця величина показує скільки моль речовини в 1 л розчину |
|
17) Ступінь дисоціації – відношення кількості продисоційованих молекул до загальної кількості молекул |
α (%, або частках)
|
|
18) Швидкість хімічної реакції – відношення зміни молярної концентрації речовини до зміни часу |
v (моль/л ∙ сек)
|
|
19) Масова частка практичного виходу речовини – відношення практичної маси до теоретичної |
|
|
20) Об’ємна частка практичного виходу речовини – відношення практичного об’єму до теоретичного |
|
8 КЛАС

1. СКЛАДНІ РЕЧОВИНИ
|
|
||||||
|
Прості речовини (містять 1 хім. елем.) |
||||||
|
Метали в періодичній системі (ПС) під діагоналлю B-At та в побічних підгрупах |
Неметали в ПС над діаг. B-At викл. х. ел. поб. підгр. |
|||||
|
Типові (в ряду акт. металів до Al) |
Нетипові – амфотерні (в ряду акт. металів після Mg) |
C, P, S, Si, H2↑ (безбн.), O3↑ (блаки), Cl2↑ (ж-зел.), I2 (фiол. кр) |
O2↑ (безбн.), N2↑ (безбн.), F2↑ (бл. жов), Br(т-черн.),
|
|||
|
Na, Ca, Mg... |
Be, Mn, Zn, Fe, Al, Pb... |
|
||||
|
|
||||||
|
Складні речовини (сполуки) (містять 2 та > хім. елем.) |
||||||
|
Оксиди EхO CO2, Na2O вик. OF2, H2O2 |
Кислоти HхКЗ Н2СО3 HCl Н3РО4 |
Основи Me(OH)х NaOH Ва(OH)2 АІ(OH)3↓ |
солі Meх(КЗ)у
|
|||
|
Несолетворні «байдужі» солетворні: •кислотні, •основні, амфотерні |
за основністю: •одноосновні, •двохосновні, •трьохосновні |
за розчинністю у воді: •розчинні (луги), • нерозчинні |
|
|||
|
|
за складом: • безоксигенові, •оксигеновміс ні |
за кислотністю • однокислотні, •двокислотні, •трикислотні |
|
|||
 КЛАСИФІКАЦІЯ ОКСИДІВ
КЛАСИФІКАЦІЯ ОКСИДІВ
|
Оксиди – це складні речовини, які містять два хімічних елементи, одним з яких є оксиген (пишеться на другому місці) |
|||
|
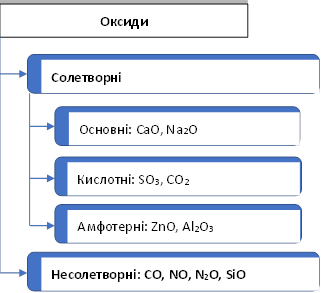
несолетворні оксиди «байдужі» НемехO 1) Не утворюють солі. 2) Не взаємодіють з водою, кислотами, лугами. 3) Реагують з киснем, доокиснюючись до кислотних оксидів |
солетворні оксиди (утворюють солі) |
Амфотерні оксиди неMехOy – це оксиди, яким відповідають амфотерні гідроксиди. Вони виявляють подвійні властивості: кислотні та основні (див. схему та табл.) |
|
|
Кислотні оксиди (ангідриди) НемехOy – це оксиди, яким відповідають кислоти. Вони виявляють кислотні властивості (див. схему та таблицю) |
Основні оксиди MехOy – це оксиди, яким відповідають основи. Вони виявляють основні властивості (див. схему та таблицю) |
||
|
NO ↑, N2O ↑, CO↑ |
CO2↑→H2CO3 |
Na2O→NaOH |
BeO→Be(OH)2↓ |
|
2CO+O2 =2CO2 |
SO2↑→H2SO3 |
К2О → КОН |
ZnO→Zn(OH)2↓ |
|
2NO+O2 = 2NO2 |
SO3 →H2SO4 |
Li2O→LiOH |
SnO→Sn(OH)2↓ |
|
|
N2O5 →HNO3 |
CaO→Ca(OH)2 |
PbO→Pb(OH)2↓ |
|
|
N2O3 →HNO2 |
BaO→Ba(OH)2 |
Al2O3→Al(OH)3↓ |
|
|
P2O5 →H3PO4 |
MgO→Mg(OH)2↓ |
Cr2O3 →Cr(OH)3 ↓ |
|
|
SiO2 -> H2SiO3l |
CuO→Cu(OH)2↓ |
Fe2O3→Fe(OH)3↓ |
|
|
NO2↑ суміш HNO2 і HNO3 |
FeO→Fe(OH)2↓ |
|
|
Неметали утворюють кислотні оксиди та кислоти Неме →НемехОy →НхКЗ, наприклад C→CO2 →H2CO3 |
|||
|
Метали утворюють основні оксиди та основи Me → MeхOу → Me (OH)х , наприклад Na →Na2O→NaOH |
|||
Класифікація оксидів
 ХІМІЧНІ ВЛАСТИВОСТІ ОКСИДІВ
ХІМІЧНІ ВЛАСТИВОСТІ ОКСИДІВ
|
|
|
|
||||||
|
|
основні оксиди |
|
|
кислотні оксиди |
|
|
амфотерні оксиди |
|
|
|
||||||||
|
|
|
|
||||||
|
Утворюються луги (тільки для елементів ІА та ІІА підгруп) CaO+H2O =Ca(OH)2 K2O+H2O =2KOH Na2O+H2O =2NaOH FeO + H2O ≠ |
Взаємодіють з утворенням кислот |
Не реагують |
||||||
|
S2O +H2O=H2SO3 |
|
|||||||
|
N2O5 +H2O=2HNO3 SO3 +H2O = H2SO4 |
|
|||||||
|
SiO2+H2O ≠ (виняток) |
|
|||||||
|
|
||||||||
|
|
|
|
||||||
|
CaO+H2SO4 = CaSO4 +H2O |
Не реагують |
ZnO+2HCl = ZnCl2 +H2O |
||||||
|
NgO+2HNO3 = Mg(NO3)2 +H2O |
|
BeO+H2SO4 = BeSO4 +H2O |
||||||
|
FeO+2HCl = FeCl2 +H2O |
|
Al2O3 +3H2SO4 = Al2(SO4)3 +H2O |
||||||
|
|
||||||||
|
|
|
|
||||||
|
Не реагують |
SO2 +Ca(OH)2 = CaSO4 +H2O |
ZnO+2NaOH = Na2ZnO2 +H2O |
||||||
|
|
P2O5 +6NaOH =2Na3PO4 +3H2O |
BeO+NaOH =Na2BeO2 +H2O |
||||||
|
|
SO3 +2KOH = K2SO4 +H2O SO3 +2NaOH =Na2SO4 +H2O |
Al2O3 +NaOH = NaAlO2 +3H2O |
||||||
|
|
||||||||
|
взаємодія з кислотними оксидами |
||||||||
|
Взаємодіють з утворенням солей |
Не реагують |
Взаємодіють з утворенням солей |
||||||
|
CaO+CO2 =CaCO3 |
ZnO+CO2 = ZnCO3 |
|||||||
|
MgO+SO2 = MgSO3 |
ZnO+SO3 = ZnSO4 |
|||||||
|
CaO+SO3 = CaSO4 |
BeO+CO2 =BeCO3 |
|||||||
|
|
||||||||
|
взаємодія з основними оксидами |
||||||||
|
Не реагують |
Взаємодіють з утворенням солей |
Взаємодіють з утворенням солей |
||||||
|
|
CaO+SO3 = CaSO4 |
ZnO+CO2 = ZnCO3 |
||||||
|
|
BaO+SO2 = BaSO3 |
ZnO+SO3 = ZnSO4 |
||||||
|
|
CuO+CO2 = CuCO3 |
BeO+CO2 =BeCO3 |
||||||
 ХІМІЧНІ ВЛАСТИВОСТІ НЕОРГАНІЧНИХ РЕЧОВИН
ХІМІЧНІ ВЛАСТИВОСТІ НЕОРГАНІЧНИХ РЕЧОВИН
|
|
||||
|
Основні оксиди |
||||
|
|
|
1) З водою реагують тільки оксиди лужних та лужноземельних металів з утворенням лугу – розчинної основи Na2O + H2O→NaOH; CaO + H2O→Ca(OH)2 |
||
|
2) Луги можна одержати при взаємодії з водою лужних та лужноземельних металів та їх оксидів Na +H2O → NaOH +H2; Na2O + H2O → NaOH |
||||
|
3) Нерозчинну основу можна одержати тільки в один спосіб – взаємодією розчинної солі з лугом CuSO4 + NAOH →Cu (OH) ↓+ H2O |
||||
|
4) Для одержання нерозчинної основи з оксиду треба «піти у два кроки»: спочатку додати до оксиду кислоту й одержати розчинну сіль, а потім до цієї солі додати луг, наприклад: MgO + HNO3 → Mg (NO3)2 + H2O, Mg(NO3)2 + NaOH → Mg(OH)2↓+ NaNO3 |
||||
|
|
|
|||
|
|
Кислотні оксиди |
|||
|
|
|
Кислотні оксиди реагують з водою з утворенням відповідної кислоти. Пісок (SiO2) з водою не реагує |
||
|
CO2↑ + H2O → H2CO3 |
N2O5+H2O→HNO3 |
|||
|
SO2↑ + H2O → H2SO3 |
N2O3 +H2O→HNO2 |
|||
|
SO3 +H2O→H2SO4 |
NO2↑ + H2O → HNO2 + HNO3 |
|||
|
P2O5+H2O(гар.)→H3PO4 ортофосфатна |
P2O5 + H2O (холодна) → HPO3 метафосфатна |
|||
|
|
||||
|
!!!У рівняннях хімічних реакцій під кислотним оксидом записуй «допоміжну» формулу відповідної кислоти, для того щоб |
||||
|
правильно написати формулу солі |
|
|||
|
|
|
|||
|
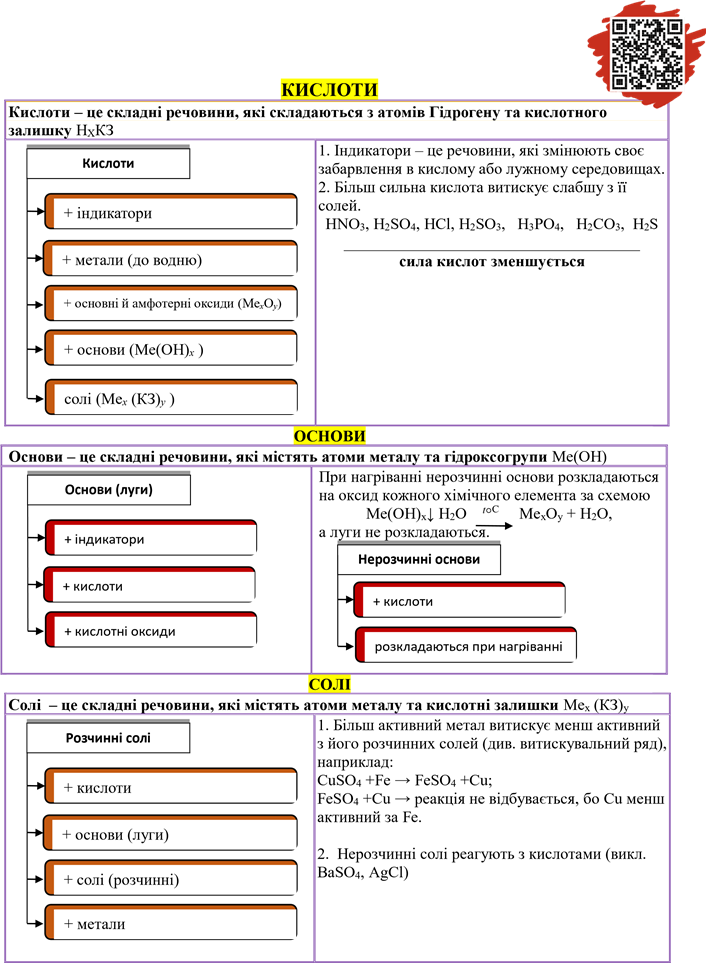
|
Амфотерні оксиди |
|||
|
|
|
Амфотерні оксиди, залежно від умов, поводять себе або як основні, або як кислотні оксиди |
||
|
ZnO+H2SO4 → ZnSO4 +H2O |
ZnO реагує, як основний оксид |
|||
|
ZnO + NaOH → Na2ZnO2 + H2O Zn(OH)2↓ H2ZnO2 |
ZnO реагує як кислотний оксид (під час сплавляння), тому під його формулою запишемо «допоміжну формулу» відповідного гідроксиду у вигляді кислоти |
|||
|
ZnO + NaOH + H2O→ Na2[Zn(OH)4], тетракомплекс утворюється у водних розчинах лугів |
||||
 |
|
|
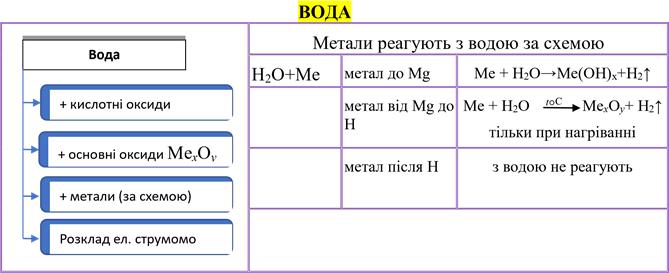
АМФОТЕРНІ ГІДРООКСИДИ |
|
|
|
Амфотерні гідроксиди + кислоти + основи (луги) розклад при нагріванні |
Амфотерні гідрооксиди, залежно від умов, поводять себе або як кислоти, або як основи, наприклад: 1) цинк гідроксид з кислотою виявляє основні властивості: |
||
|
|
Zn(OH)2↓ + 2HCl = ZnCl2 + 2H2O 2) цинк гідроксид з лугом виявляє кислотні властивості: а) під час сплавляння: Zn(OH)2↓ + 2NaOH = Na2ZnO2 + 2H2O (H2ZnO2) натрій цинкат б) у розчинах: Zn(OH)2↓ + 2NaOH = Na2[ Zn(OH)4 ] утворюється комплексна сіль натрій тетрагідроксоцинкат |
||
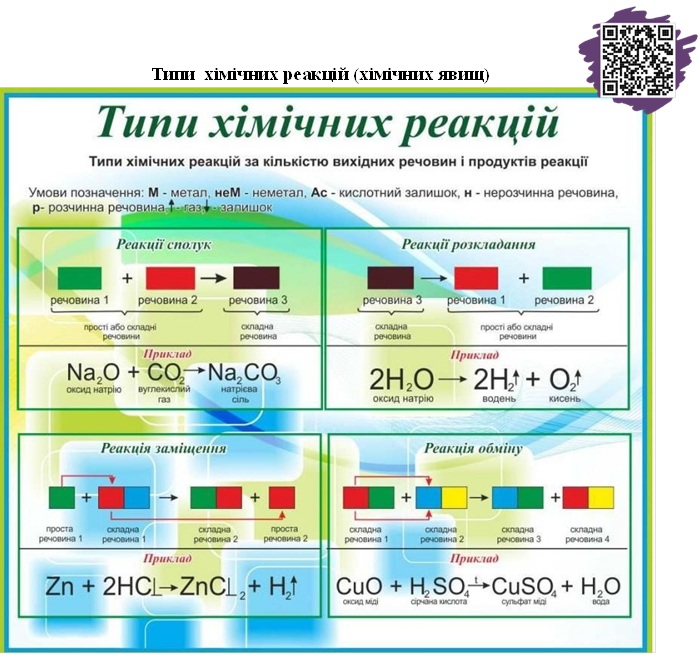 |
Реакція сполучення – це реакція, в результаті якої з двох або більше вихідних речовин (реагентів) утворюється одна нова складна речовина (продукт).
Реакція розкладу – це реакція, в результаті якої з однієї складної речовини утворюється декілька простіших речовин.
Реакція заміщення (AВ + С→СВ + A) – це реакція між простою та складною речовинами, під час якої атоми простої речовини заміщують атоми складної речовини й утворюється одна нова проста й одна нова складна речовини. Реакція обміну (AB + CD →AD + CB) – це реакція між двома складними речовинами, під час якої вони обмінюються складовими частинами й утворюються дві нові складні речовини.
Реакція нейтралізації – це реакція обміну основи з кислотою, в результаті якої утворюються сіль і вода.
Необоротні реакції (можливі, ті, що перебігають до кінця) – це реакції з утворенням газу, осаду або води.
Запам’ятай! У момент утворення дві кислоти (H2SO3, H2CO3) розкладаються на воду і відповідний оксид.
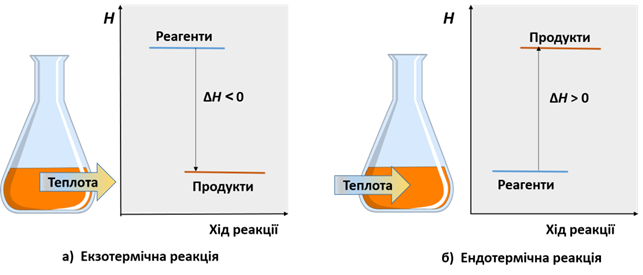
Горіння – це реакція з виділенням теплоти і світла, при цьому відбувається окиснення речовин. окиснення (повільне окиснення) – це реакція з виділенням теплоти, при цьому відбувається окиснення речовин.
Екзотермічна – це реакція з виділенням теплоти.
Ендотермічна – це реакція з поглинанням теплоти.
2. ПЕРІОДИЧНИЙ ЗАКОН, ПЕРІОДИЧНА СИСТЕМА, БУДОВА АТОМА
СПРОБИ КЛАСИФІКАЦІЇ ХІМІЧНИХ ЕЛЕМЕНТІВ
|
1. Класифікація на метали та неметали (базувалася на фізичних властивостях речовин). Недолік – не враховувала амфотерні елементи, які виявляють подвійні властивості. |
|
2. Класифікація на групи подібних елементів (базувалася на фізичних та хімічних властивостях речовин). Недолік – не враховувала всі хімічні елементи. |

|
Лужні метали (взаємодіють з водою з утворенням лугів – розчинних основ) |
Галогени («солеродні», бо безпосередньо реагують з металами з утворенням солей) |
|
Елементи І групи, головної підгрупи (виняток H) |
Елементи VІІ групи, головної підгрупи |
|
|
|
|
Валентність І |
Валентність І, ІІІ, V, VІІ (виняток F1 ) |
|
Фізичні властивості: металічний блиск, м’які (легко ріжуться ножем), пластичні, легкоплавкі, невелика густина (легші за воду) |
Фізичні властивості: газоподібні (F2↑, Cl2↑), рідкі (Br2 – темно-червона рідина), тверді (I2 – фіолетові кристали, At2 радіоактивний). Леткі, молекули двохатомні |
|
Хімічні властивості (висока хімічна активність):
1) Окиснюються киснем повітря Me+O2 → Me2O 2) Реагують з водою за схемою Me+H2O→MeOH+H2 тому лужні метали зберігають під шаром гасу. 3) Реагують з неметалами за схемою Me+Heме →МехНеме |
Хімічні властивості (висока хімічна активність):
1) Реагують майже з усіма простими речовинами, особливо з металами: а) з металами за схемою Г2+Me→MeГх б) з воднем за схемою
в) з киснем утворюють оксиди Г2+O2→ГхOу 2) Більш активний галоген витискує менш активний галоген із його розчинних солей (одержання йоду з бурих водоростей) KI + Cl2↑ → KCl + I2 |
|
У вільному стані у природі не трапляються, бо хімічно дуже активні |
У вільному стані у природі не трапляються, бо хімічно дуже активні |
|
Інші групи подібних елементів |
|
1. Халькогени – елементи VІ групи, головної підгрупи (валентність ІІ, IV, VІ (виняток OII ) ) |
|
2 |
|
3. Підгрупа Карбону – елементи ІV групи, головної підгрупи (валентність ІІ, IV) |
|
4. Землі – елементи ІІІ групи, головної підгрупи (валентність ІІІ) |
|
5. Лужноземельні метали – елементи ІІ групи, головної підгрупи (валентність ІІ) |
|
6. Інертні (благородні гази) – елементи VІІІ групи, головної підгрупи (валентність 0). Хімічно пасивні, існують у природі (у повітрі), молекули одноатомні |
Класифікація Д. І. Менделєєва
![]() (базувалась на величинах атомних мас хімічних елементів).
(базувалась на величинах атомних мас хімічних елементів).
Д. І. Менделєєв побачив періодичну залежність між властивостями хімічних елементів та їх сполук і сформулював періодичний закон (1869 р.).
|
Періодичний закон (класичне визначення) |
|
Властивості хімічних елементів і властивості утворених ними простих і складних речовин перебувають у періодичній залежності від атомних мас елементів |
Періодична система хімічних елементів
Періодична система хімічних елементів – це графічне зображення періодичного закону.
|
Структура періодичної системи |
|
|
періоди: • малі (1, 2, 3); • великі (4, 5, 6); • незавершений (7) |
горизонтальні ряди хімічних елементів, які починаються лужними металами і закінчуються інертними газами (виняток 1, 7 періоди) |
|
Групи |
це вертикальні ряди хімічних елементів, які складаються з двох підгруп: головної та побічної |
|
Головна підгрупа |
включає хімічні елементи малих та великих періодів, які дуже схожі між собою за властивостями |
|
Побічна підгрупа |
включає хімічні елементи тільки великих періодів |
|
Значення періодичного закону |
|
|
1. Класифікував усі відомі хімічні елементи (на той час було відомо 63 хімічних елемента). 2. Передбачив існування ще невідомих хімічних елементів, їх положення в періодичній системі та їх властивості. 3. Виправив атомні маси деяких відомих хімічних елементів. 4. Передбачив синтез зауранових хімічних елементів. 5. Створив наукову основу для відкриття будови атома. |
|
|
Відкривши і сформулювавши періодичний закон, Д. І. Менделєєв писав: «Ми не розуміємо причини періодичності». (Бо шість елементів у періодичній системі розміщено всупереч періодичному закону: див. Ar і K, Co і Ni, Te і І.) Ця причина стала зрозумілою після відкриття будови атома |
|
ІСТОРІЯ ВІДКРИТТЯ БУДОВИ АТОМА
|
1 |
Атом «неподільний» |
Найменша частинка речовини, неподільна (така думка виникла за 500 р. до н. е. і панувала до 20 ст. н. е.) |
|
|
2 |
А. Беккерель – французький фізик |
Досліджував солі Урану і виявив, що елемент Уран випромінює не видимі для ока промені. Його дослідами зацікавились інші вчені |
|
|
3 |
Марія СклодовськаКюрі |
Разом зі своїм чоловіком П’єром Кюрі відкрила два нові подібні елементи (Полоній, Радій). Ввела в науку поняття радіоактивність – здатність деяких хімічних елементів випромінювати не видимі для ока промені (радіоактивні) |
|
|
4 |
Е. Резерфорд – англійський фізик |
1. Вивчав природу радіоактивних променів (пропускав через магнітне поле) і встановив, що вони неоднорідні і складаються із трьох пучків: у – «гама», промені нейтральні; а – «альфа», промені – це потік позитивно заряджених частинок (ядер гелію); ß – «бета», промені – це потік негативно заряджених частинок (електронів). 2. Вивчав розсіювання а -частинок, які проходять через тонкі металеві пластинки, запропонував схему будови атома – ядерну модель атома |
|
|
5 |
Атом (1911 р., Резерфорд) |
Це частинка речовини, яка складається з позитивно зарядженого ядра та негативно заряджених електронів, які обертаються навколо нього |
|
|
6 |
Г. Мозлі, е. Резерфорд |
Дослідили, що заряд ядра атома дорівнює номеру хімічного елемента в періодичній системі – це фізичний зміст порядкового номера хімічного елемента в періодичній системі |
|
|
7 |
Хімічний елемент |
Це атоми з однаковим зарядом ядра |
|
|
8 |
Сучасне визначення атома |
Атом – це електронейтральна частинка речовини, бо кількість протонів дорівнює кількості електронів |
|
|
9 |
Нукліди |
Це атоми хімічних елементів з однаковим зарядом ядра та однаковою масою, бо мають однакову кількість протонів та нейтронів |
|
|
10 |
Ізотопи – це нукліди одного хімічного елемента |
Це атоми з однаковим зарядом ядра, але різною масою, бо мають однакове число протонів і різну кількість нейтронів. Наприклад, у природі є три ізотопи Гідрогену: |
|
|
Протій (z = +1 m =1); Дейтерій (z = +1 m =2); (Тритій (z = +1 m =3) |
|
||
|
11 |
Стабільні ізотопи |
Це всі «парні» елементи і більшість «непарних» з № ≤ 83 |
|
|
12 |
Радіоактивні ізотопи (радіонукліди) |
Нестійкі ізотопи, що спонтанно перетворюються на інші нукліди, виділяючи енергію. (Всі хімічні елементи, розміщені в періодичній системі після Бісмуту.) |
|
|
13 |
Ядерні реакції |
Процес радіоактивного розпаду, під час якого відбувається перетворення одних хімічних елементів на інші |
|
|
14 |
Період напіврозпаду |
Інтервал часу, протягом якого кількість радіоактивних атомів даного елемента зменшується вдвічі |
|
![]()
|
Сучасне визначення періодичного закону |
|
(XX ст., після відкриття будови атома) |
|
Властивості хімічних елементів і властивості утворених ними простих і складних речовин |
|
Перебувають у періодичній залежності від заряду ядра атома.
|
![]()
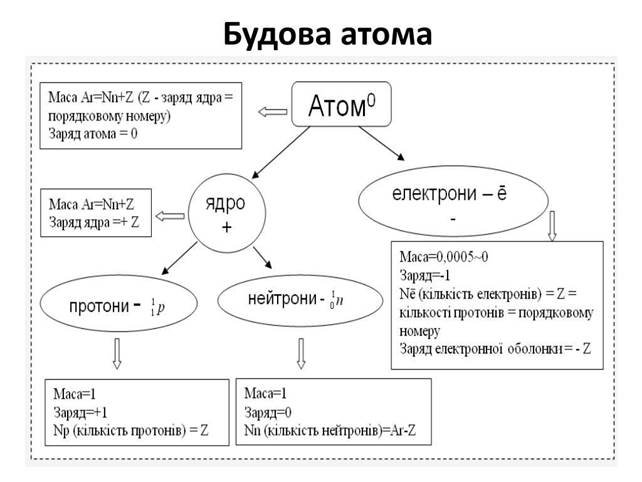
|
Періодична система |
Будова атома |
|
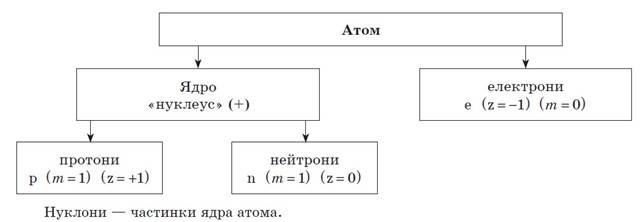
1. Номер хімічного елемента – протонне число |
Показує: а) заряд ядра атома; б) кількість протонів, в) кількість електронів |
|
2. Відносна атомна маса хімічного елемента (Ar ) – нуклонне число |
Показує: а) кількість нуклонів (сума протонів та нейтронів – частинок ядра атома); б) Ar – дробове число пояснюється наявністю природних ізотопів; в) Ar – [ціле число] означає, що хімічний елемент отримано штучно |
|
3. Номер періоду |
Показує кількість енергетичних рівнів, по яких рухаються електрони |
|
4. Номер групи (головної підгрупи) |
Показує кількість електронів на зовнішньому рівні атома хімічного елемента: а) у металів валентними є всі електрони зовнішнього енергетичного рівня; б) у неметалів валентними є тільки неспарені електрони зовнішнього енергетичного рівня |
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
1. Білик О.М. Хімія у визначених таблицях и схемах 7-11 клас. Рятівник. К.: «Ранок», 2018. 32 с.
2. Гога С. Т., Ісаєнко Ю. В. Хімія. Практичний довідник. К.: Весна, 2020. 28 с.
3. Гриньова М. В., Шиян Н. І., Пустовіт С. В., Джурко Г. Ф. Хімія. Довідник для абітурієнтів и школярів. К.: Літера, 2018. 4. Євсєєв Р. Хімія в таблицях. Посібник. К.: Ранок, 2020. 32 с.
5. Опорні схеми на уроках хімії 7 клас URL: https://naurok.com.ua/minipidruchnik-oporni-shemi-na-urokah-himi-254742.html 6. Островерхова Н. І.Довідник у таблицях - Хімія. 7-11 класи. К.: Ула, 2022.
34 с.
7. Підручники з хімії онлайн URL: https://znohimbio.jimdofree.com/ підготовкадо-зно-з-хімії/
8. Семеняк В.А. Авторський канал IOK з Хімії для учнів URL: https://t.me/+DSQUUQ7Ayd9hZWQy
9. Схема хімічної реакції. Хімічні рівняння URL: https://lms.eschool.net.ua/asset-v1:UIED+Chemistry-7th-
grade+2020+type@asset+block@%D0%BA%D0%BE%D0%BD%D1%81%D0
%BF%D0%B5%D0%BA%D1%82__39_.pdf
![]()

про публікацію авторської розробки
Додати розробку