Презентація. Виявлення йонів у розчинах. Поняття про якісні реакції.












План заняття.1. Повторення навчальної інформації за § 12. «Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій.». Підручник з Хімії. 9 клас. Григорович - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/14.php 2. Ознайомлення з навчальною інформацією за § 13. «Виявлення йонів у розчинах». Підручник з Хімії. 9 клас. Григорович - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/17.php 3. Ознайомлення з умовами домашнього завдання. Домашнє завдання.1. Повторити навчальну інформацію за § 12. «Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій.». Підручник з Хімії. 9 клас. Григорович - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/14.php 2. Вивчити навчальну інформацію за § 13. «Виявлення йонів у розчинах». Підручник з Хімії. 9 клас. Григорович - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/17.php 3. Ознайомлення з умовами домашнього завдання.
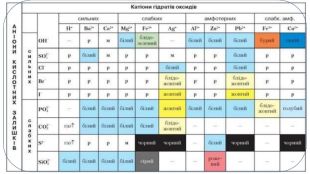
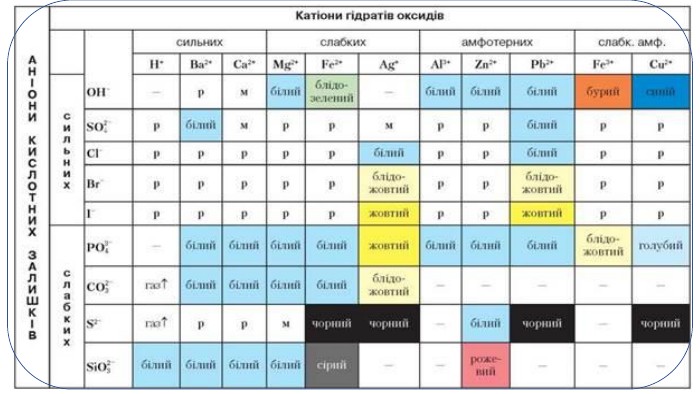
Пригадайте: Речовини, які належать до електролітів, здебільшого дисоціюють з утворенням таких йонів: катіони Гідрогену й аніони кислотних залишків (кислоти); катіони металічних елементів і гідроксид – іонів (основи); катіони металічних елементів та аніони кислотних залишків (солі). Кислотність середовища. Поняття про p. H розчину. Індикатори. Види індикаторів. Забарвлення, яке набувають індикатори в різних середовищах. Значення інформації з таблиці розчинності кислот, основ, солей. Реакції обміну. Реакції йонного обміну. Умови перебігу реакцій йонного обміну між електролітами в розчинах. Йонно-молекулярні рівняння реакцій. Повне йонно-молекулярне рівняння реакції. Скорочене йонно-молекулярне рівняння реакції. Особливості складання йонно-молекулярних рівнянь. Реакції нейтралізації. Хімічна суть реакцій йонного обміну.
Для розпізнавання речовин використовують різноманітні тести. Інколи для цього ще потрібне складне обладнання, а інколи проводять доволі прості лабораторні досліди. Всі вони відомі під назвою якісного аналізу. Якісний аналіз - це сукупність хімічних, фізико-хімічних і фізичних методів, що їх застосовують для виявлення хімічних елементів, йонів і сполук, що входять до складу сумішей. В якісному аналізі використовують характерні реакції, під час яких спостерігаються поява або зникнення забарвлення, випадання осаду або його розчинення, виділення газу, поява запаху тощо. Ці реакції мають бути специфічними (селективними) і легко виконуваними. Якісний аналіз неорганічних сполук буває двох типів: «сухий» і «мокрий». «Мокрий» аналіз - такий, що його здійснюють у водних розчинах, оскільки він ґрунтується на йонних реакціях і дає змогу виявляти наявні в розчинах катіони або аніони. Так, наявність у розчинах йонів Гідрогену Н+ можна виявити за допомогою індикаторів.
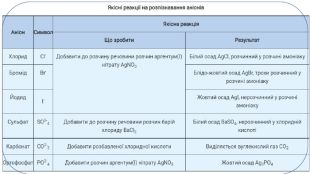
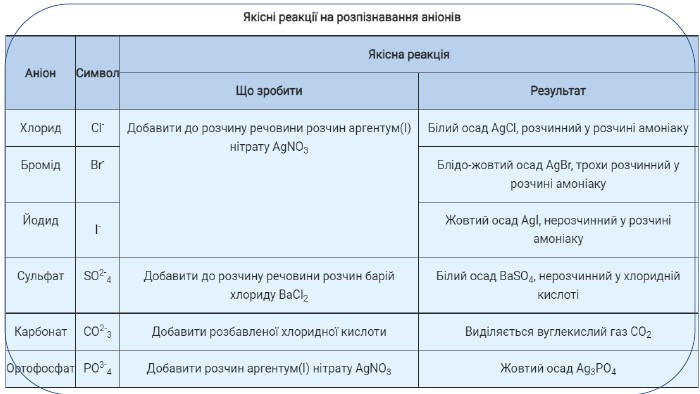
Серед реакцій обміну є низка реакцій, які дають змогу виявляти йони в розчинах. Реакції, характерні для певних йонів, називають якісними. Речовину, яку використовують для якісного виявлення того чи іншого йона, називають реактивом на цей йон. Так, реактивом на йони Сl-, Вr-, I- є одна й та сама речовина - розчинна сіль Аргентуму(І) -аргентум(І) нітрат Ag. NO3. Під час додавання розчину Ag. NO3 до налитих у різні пробірки розчинів калій хлориду КСl, калій броміду КВr і калій йодиду КI спостерігається утворення характерних осадів. Складаємо відповідні молекулярні та йонно-молекулярні рівняння реакцій. У першій склянці випадає білий сирнистий осад, який не взаємодіє з кислотами: КСl + Ag. NO3 = Ag. Cl↓ + KNO3;К+ + Cl- + Ag+ + NO-3 = Ag. Cl↓ + K+ + NO-3. Вилучивши однакові йони в лівій та правій частинах рівняння, отримаємо: Cl- + Ag+ = Ag. Cl↓. У другій склянці, де міститься розчин калій броміду, спостерігаємо також випадання осаду, але жовтуватого кольору: КВr + Ag. NO3 = Ag. Br↓ + KNO3. Аргентум(І) бромід також не взаємодіє з кислотами: К+ + Вr- + Ag+ + NO-3 = Ag. Br↓ + К+ + NO-3. Вr- + Ag+ = Ag. Br↓.
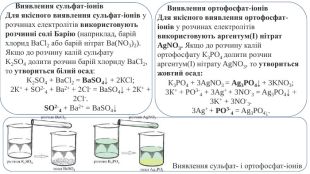
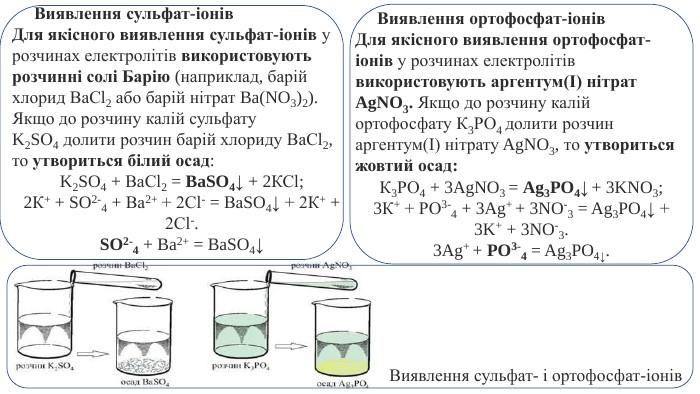
Виявлення сульфат-іонів. Для якісного виявлення сульфат-іонів у розчинах електролітів використовують розчинні солі Барію (наприклад, барій хлорид Ва. Сl2 або барій нітрат Ba(NO3)2). Якщо до розчину калій сульфату K2 SО4 долити розчин барій хлориду Ва. Сl2, то утвориться білий осад: K2 SO4 + Ва. Сl2 = Ba. SO4↓ + 2 КСl;2 К+ + SO2-4 + Ва2+ + 2 Сl- = Ва. SO4↓ + 2 К+ + 2 Сl-. SO2-4 + Ba2+ = Ba. SO4↓ Виявлення ортофосфат-іонів. Для якісного виявлення ортофосфат-іонів у розчинах електролітів використовують аргентум(І) нітрат Ag. NO3. Якщо до розчину калій ортофосфату К3 РО4 долити розчин аргентум(І) нітрату Ag. NO3, то утвориться жовтий осад: К3 РО4 + 3 Ag. NO3 = Ag3 PO4↓ + 3 KNO3;3 К+ + РО3-4 + 3 Ag+ + 3 NO-3 = Ag3 PO4↓ + 3 K+ + 3 NO-3.3 Ag+ + PO3-4 = Ag3 PO4↓. Виявлення сульфат- і ортофосфат-іонів
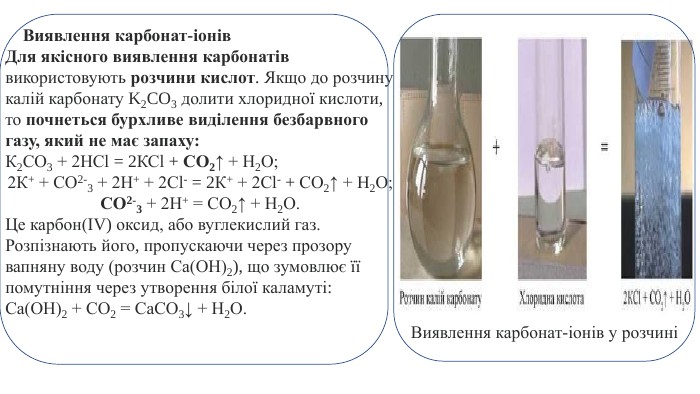
Виявлення карбонат-іонів. Для якісного виявлення карбонатів використовують розчини кислот. Якщо до розчину калій карбонату K2 CO3 долити хлоридної кислоти, то почнеться бурхливе виділення безбарвного газу, який не має запаху: К2 СО3 + 2 НСl = 2 КСl + СО2↑ + Н2 О;2 К+ + СО2-3 + 2 Н+ + 2 Сl- = 2 К+ + 2 Сl- + СО2↑ + H2 О;СО2-3 + 2 Н+ = СО2↑ + Н2 О. Це карбон(ІV) оксид, або вуглекислий газ. Розпізнають його, пропускаючи через прозору вапняну воду (розчин Са(ОН)2), що зумовлює її помутніння через утворення білої каламуті: Са(ОН)2 + СО2 = Са. СО3↓ + Н2 О. Виявлення карбонат-іонів у розчині
Одне з найважливіших завдань хімії - аналіз складу речовин. Це поняття в 1654 р. увів у науку англійський хімік Роберт Бойль. Важливо вміти ідентифікувати речовину та встановити, чи є в ній ті або інші домішки. Якісні реакції - це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом1.1 У цьому контексті реагент - речовина відомого складу, яку використовують для виявлення йонів у складі аналізованої речовини. Якісні (характерні) реакції супроводжуються добре помітними змінами, як-от: утворення або розчинення осаду, поява інтенсивного забарвлення або знебарвлення розчину, виділення або поглинання газу, утворення кристалів характерної форми тощо. Якісний аналіз у водних розчинах ґрунтується на йонних реакціях і дає змогу виявити катіони або аніони. Видатний український хімік С. М. Реформатський зі своїм учнем Я. І. Михайленком у 1899 р. уперше спробували систематизувати, розділити та характеризувати елементи за відношенням їхніх йонів до різних реагентів. Результатом їхнього дослідження стала монографія «Таблиці якісного хімічного аналізу», у якій найбільшу групу становили йони металічних елементів. Вони у свою чергу поділялися на підгрупи за відношенням водних розчинів їхніх солей до певних груп реагентів.
Для тих, хто хоче знати хімію глибше. Доволі цікавими експериментальними задачами є задачі на дослідження невідомої речовини з метою встановлення її складу. Дано: розчин солі Калію. Дослідити: які аніони містить ця сіль, коли відомо, що це не сульфат. До розчину, який досліджують, доливають розчин Ag. NO3, що дає змогу виявляти йони S2-, Сl-, Вr-, I- та РО3-4. (Зауважмо, що Ag2 S - осад чорного кольору.)Випадає білий осад. Робимо попередній висновок: розчин не містив йонів S2-, Вr-, I- та РО3-4, оскільки вони утворюють з катіоном Ag+ кольорові осади. Але білий осад утворює також Ag2 CO3 (дивимось таблицю розчинності). До розчину, який досліджують, доливають розчин Ag. NO3, що дає змогу виявляти йони S2-, Сl-, Вr-, I- та РО3-4. (Зауважмо, що Ag2 S -осад чорного кольору.)Випадає білий осад. Робимо попередній висновок: розчин не містив йонів S2-, Вr-, I- та РО3-4, оскільки вони утворюють з катіоном Ag+ кольорові осади. Але білий осад утворює також Ag2 CO3 (дивимось таблицю розчинності). Робимо попередній висновок: це аргентум(І) карбонат або аргентум(І) хлорид. Ми знаємо, що карбонати скипають під дією кислот, а аргентум(І) хлорид з кислотою не взаємодіє. Додаємо розчин нітратної кислоти. Осад не розчиняється. Отже, у пробірці міститься аргентум(І) хлорид, а досліджуваний розчин спочатку містив калій хлорид.
ЗАСТОСУВАННЯ ЯКІСНИХ РЕАКЦІЙ. З якісними реакціями мають справу учні та студенти у процесі вивчення хімії. Їх використовують у багатьох наукових дослідженнях з хімії, біології, медицини тощо. Сформувалась і розвивається окрема наукова галузь - аналітична хімія, предметом досліджень якої є якісний аналіз складу речовин і матеріалів. Уміння проводити якісний аналіз внесено до переліку професійних умінь провізорів, експертів з якості харчової продукції та фахівців багатьох інших спеціальностей. Застосування методів аналітичної хімії важливе для багатьох галузей науки, техніки й виробництва. Їх широко використовують у хімічних, біохімічних, санітарно-гігієнічних і контрольно-аналітичних лабораторіях для визначення якості харчових продуктів, косметичної продукції, води, чистоти повітря та хімічного складу ґрунту. У клінічних лабораторіях здійснюють аналізи крові, шлункового соку, сечі тощо для діагностування стану організму, виявлення захворювань. Свідченням важливого значення застосування якісних реакцій для захисту довкілля від забруднення є те, що контроль за якістю води та ґрунту здійснюють з їхнім використанням. Виконуючи лабораторні досліди, учні у процесі вивчення хімії проводять тільки візуальні спостереження за якісними реакціями. У промисловості чи довкіллі це роблять за допомогою спеціальних приладів, які дають змогу виявляти малі кількості речовин.
ПІДСУМОВУЄМО ВИВЧЕНЕ• Якісний та кількісний склад речовин вивчає аналітична хімія.• Якісні реакції - реакції, за допомогою яких можна виявити катіони й аніони в складі речовини.• Йони Гідрогену й гідроксид-іони в розчинах електролітів виявляють за допомогою індикаторів.• Реактивом для виявлення хлорид-іонів є розчин солі Ag. NO3, що містить катіони Арґентуму Аg+. Унаслідок відповідних реакцій утворюється нерозчинна сполука арґентум(І) хлорид.• Реактивом для виявлення сульфат-іонів є розчини лугу та солей, що містять катіони Барію Ва2+. Утворюється нерозчинна сполука барій сульфат, яка не взаємодіє з нітратною кислотою.• Реактивом для виявлення карбонат-іонів у розчинах є кислоти, що містять катіони Гідрогену Н+.


про публікацію авторської розробки
Додати розробку