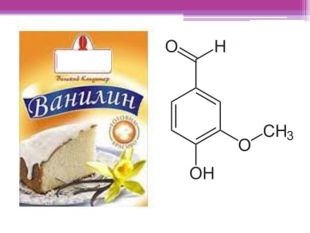
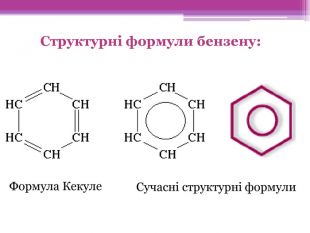
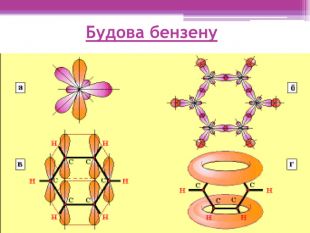
Презентація "Ароматичні вуглеводні. Бензол"
Презентація до уроку хімії в 10 класі на тему "Ароматичні вуглеводні. Бензол". Презентація містить експрес-тест для актуалізації опорних знань, основний та додатковий матеріал з теми, історичні відомості, міжпредметні зв'язки, цікаві факти, завдання для закріплення, домашнє завдання, задачі для самостійного розв'язання.



















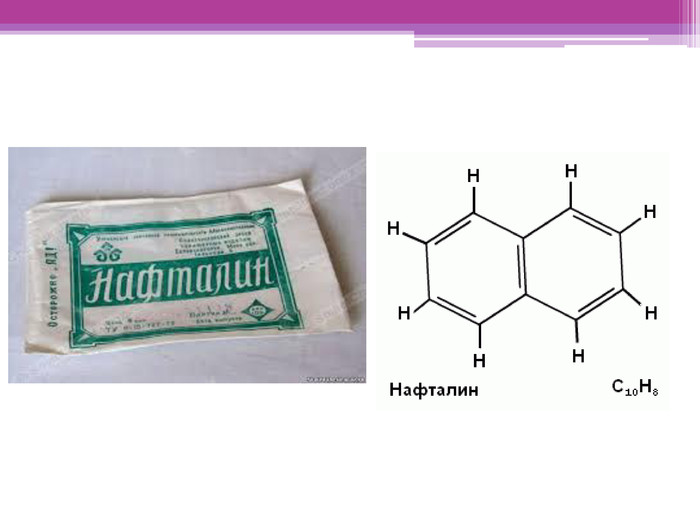
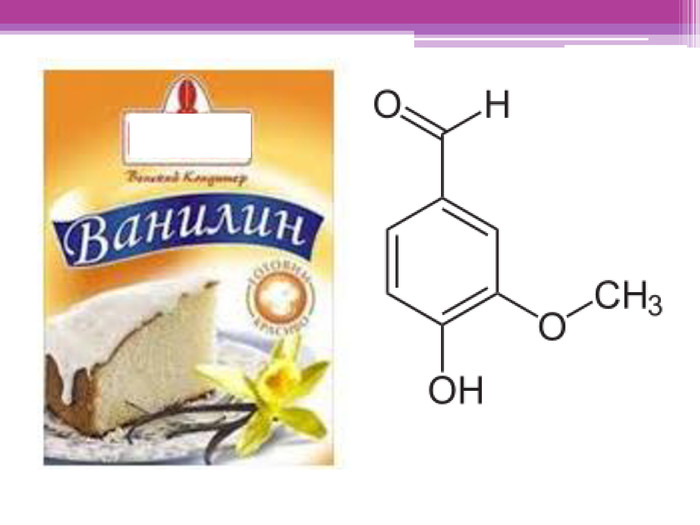






























Майкл Фарадей. Майкл Фарадей народився в 1791 році в родині коваля. До 12 років він навчався в школі, по тим часам це було дуже довго, як правило, діти починали працювати у 8-9 років. В 13 років почав працювати в книжному магазині й друкарській майстерні при ньому. Мав змогу читати книги й міг вчитися самостійно.
Майкл Фарадей. Старший брат давав йому щотижня по шилінгу, який Фарадей витрачав на те, щоб слухати лекції. Якось йому пощастило прослухати лекції Гемфрі Деві. Фарадей записав їх, переплів у книгу та відіслав вченому. Деві зробив Фарадея своїм секретарем, а згодом і помічником. Продовження за посиланням: Майкл Фарадей


про публікацію авторської розробки
Додати розробку



















































-

Осіпчук Валентина
11.11.2023 в 23:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крсек Алла Геннадіївна
04.11.2019 в 22:26
Гарна робота!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шахманцир Оксана
16.12.2018 в 22:21
Дякую за підбірку відеоматеріалів
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Клапків Оксана
21.11.2018 в 19:06
Дякую за змістовний та цікавий матеріал. Бажаю авторові натхнення для подальшої продуктивної роботи
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 1 відгук