Презентація"Білки:склад, структура, властивості"
Про матеріал
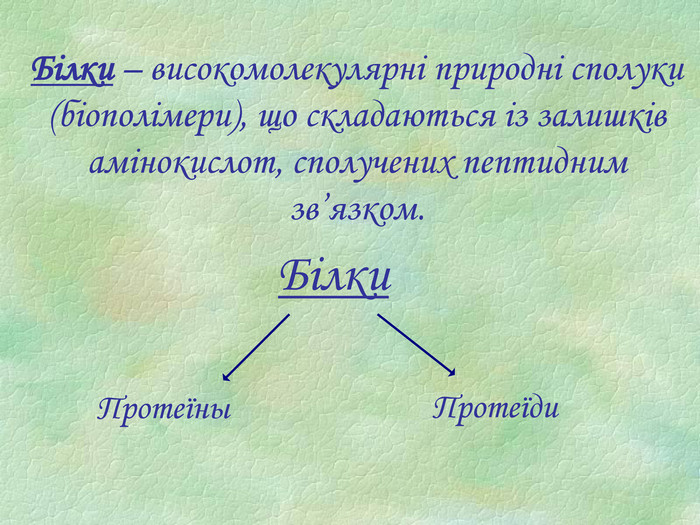
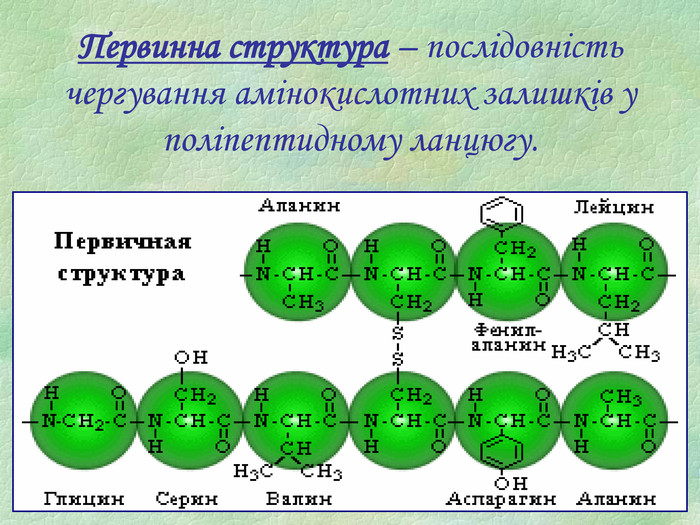
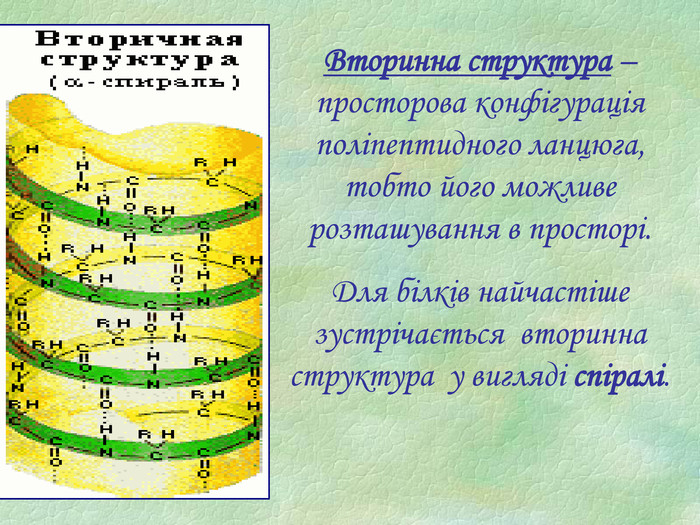
Презентація є допоміжним матеріалом при вивченні білків. У ній представлені малюнки із структурами білків, вказано склад та основні біологічні функції білків, а також наведені основні хімічні властивості цих речовин
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




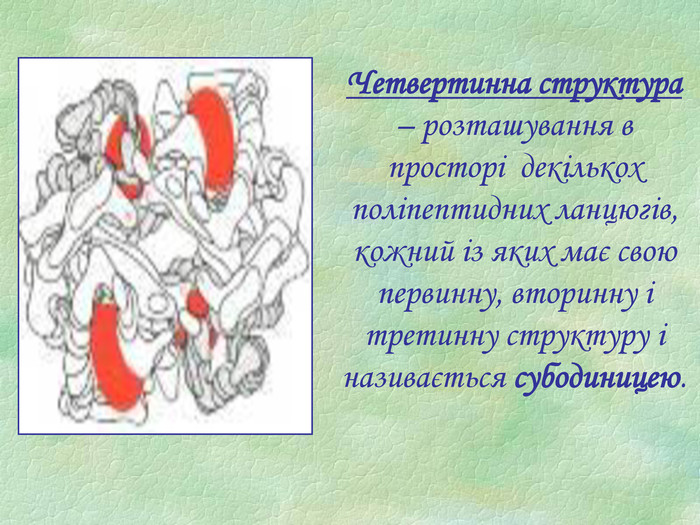




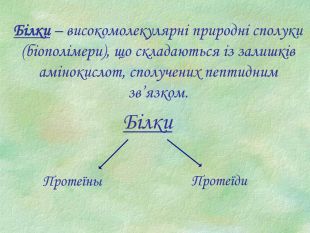

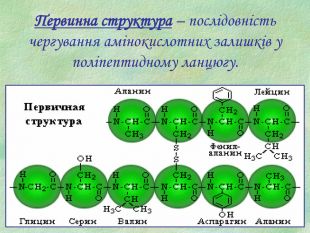
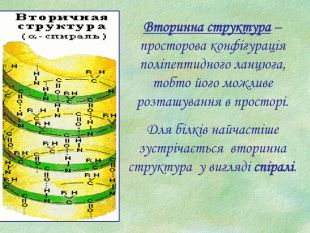
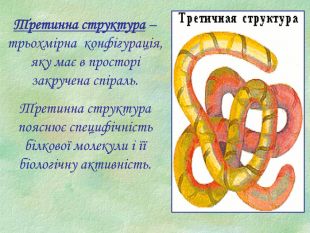
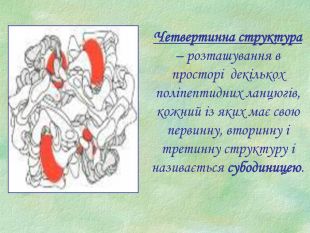



-

Юсин Надія Улянівна
25.09.2022 в 12:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
07.04.2021 в 09:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тутова Наталія Олексіївна
16.11.2020 в 14:11
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Туровець Олександр Антонович
15.05.2018 в 12:58
Гарна робота
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук