Презентація «Будова електронних оболонок і характер хімічних елементів» 8 клас
| Презентація допоможе учням та вчителю при проведенні уроків на теми: «Розподіл електронів в електронній оболонці атомів» та «Будова електронних оболонок і характер хімічних елементів». Радіус атома. Причина інертності інертних елементів. |


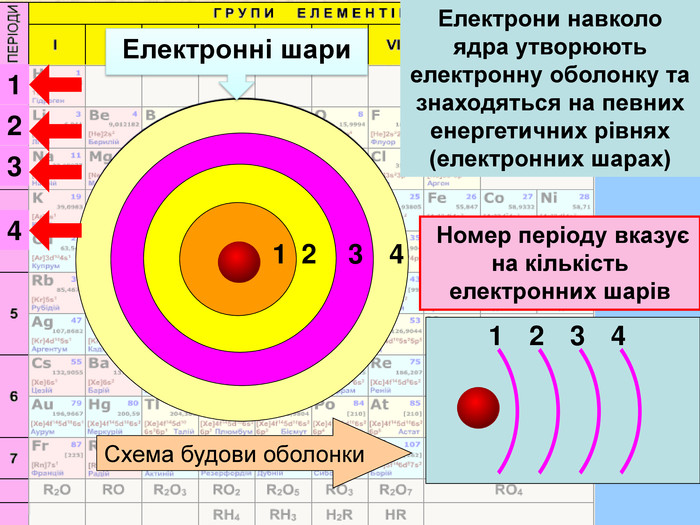

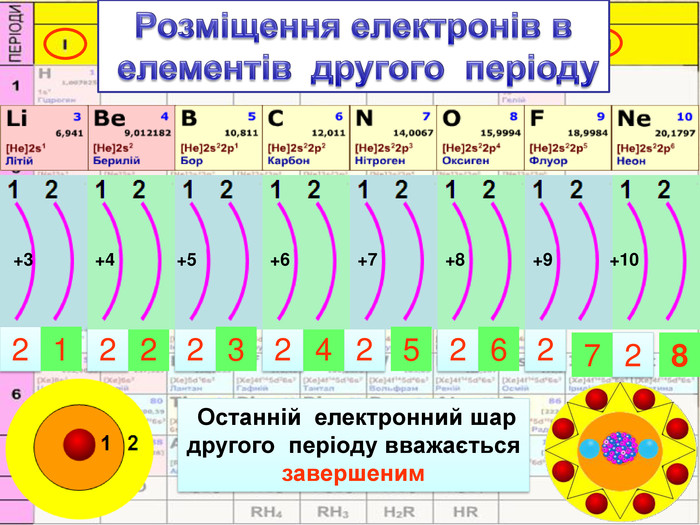
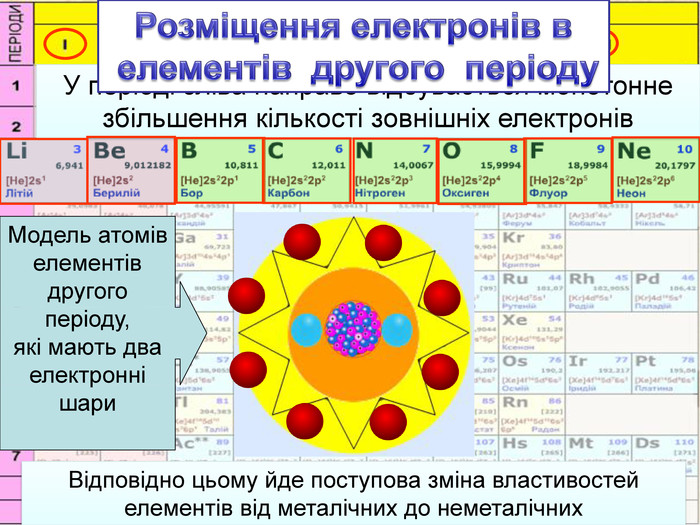

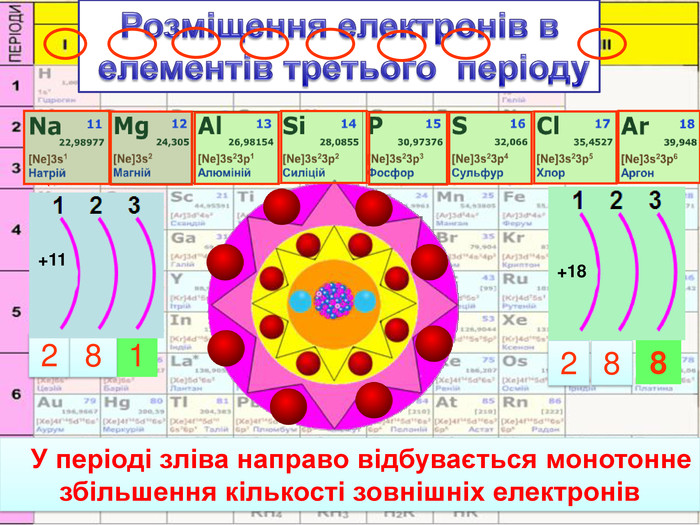
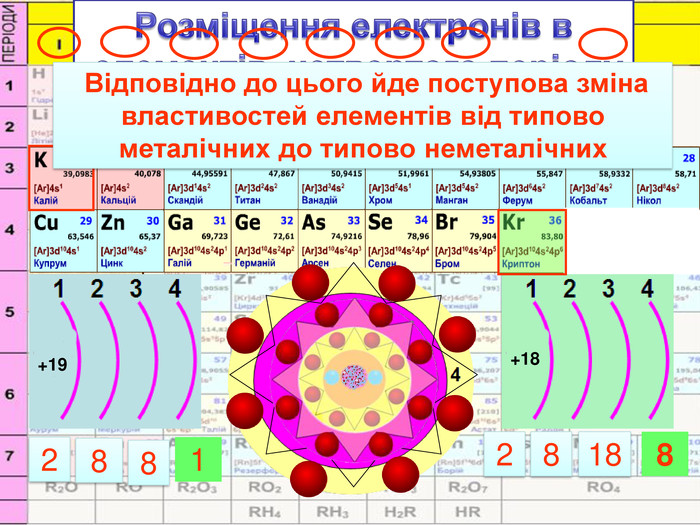
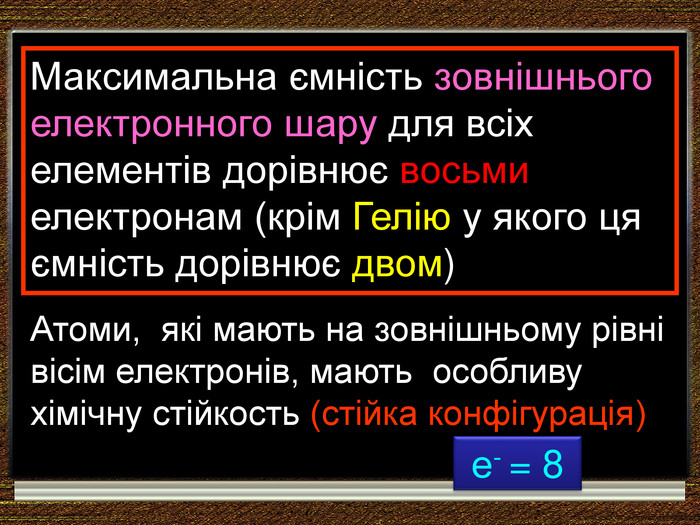




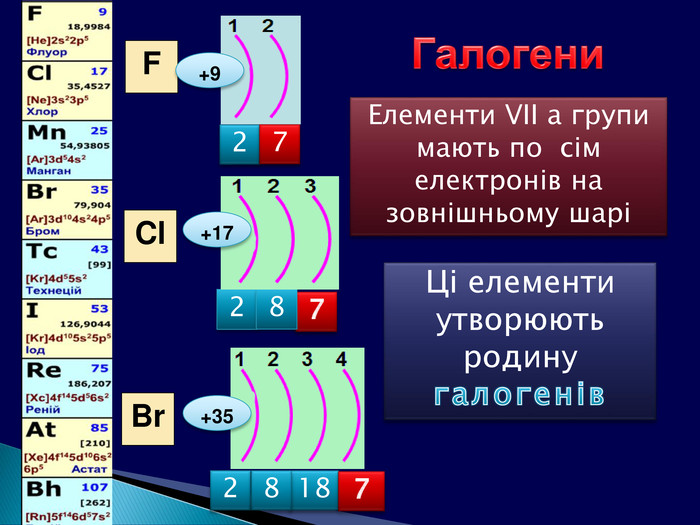
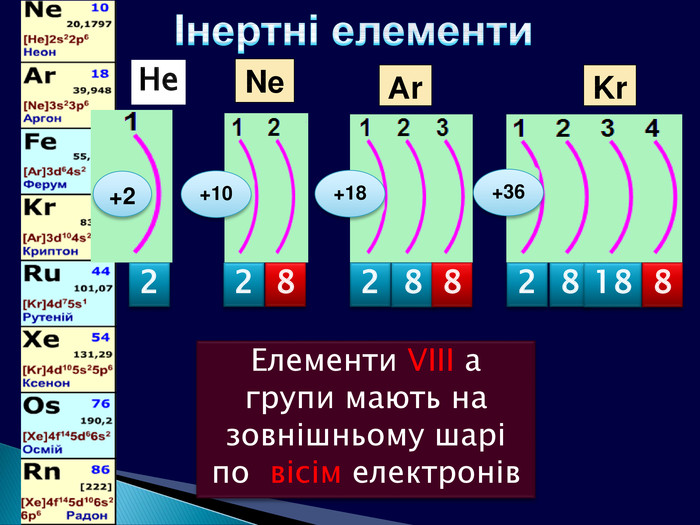
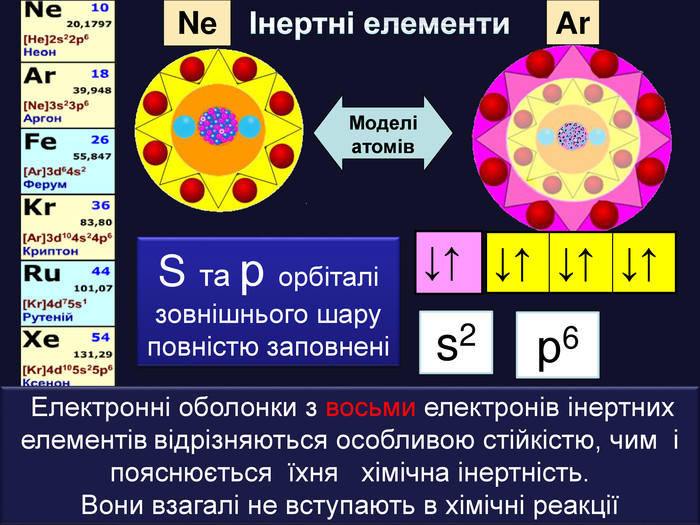

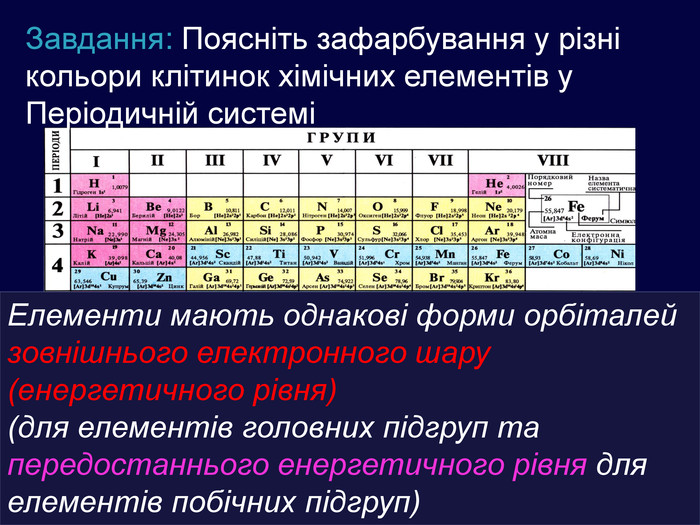
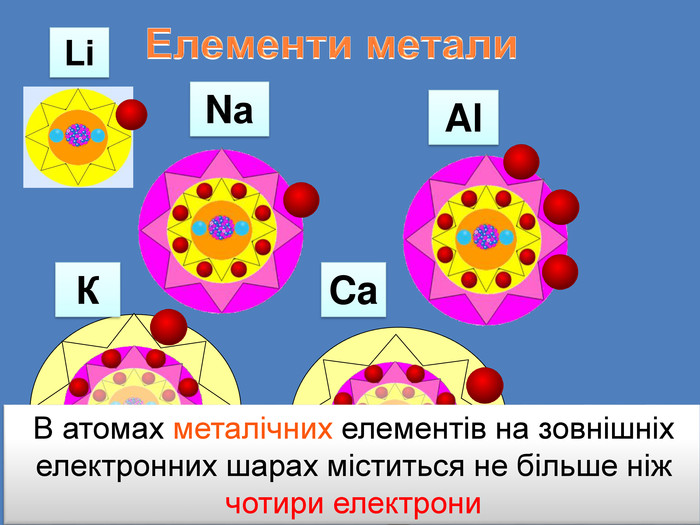
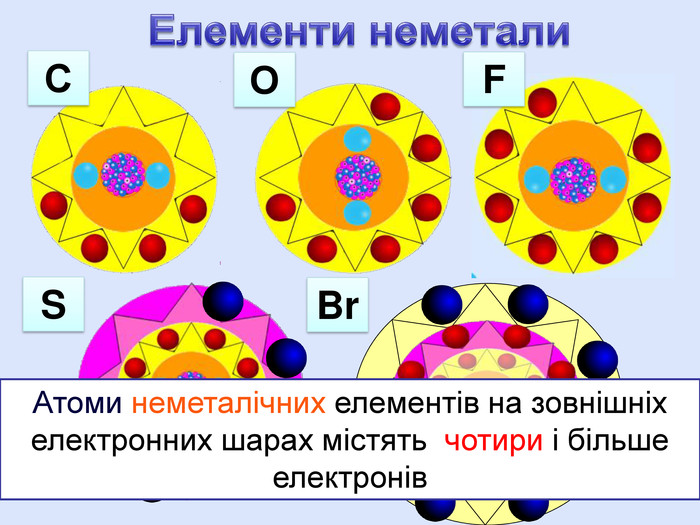

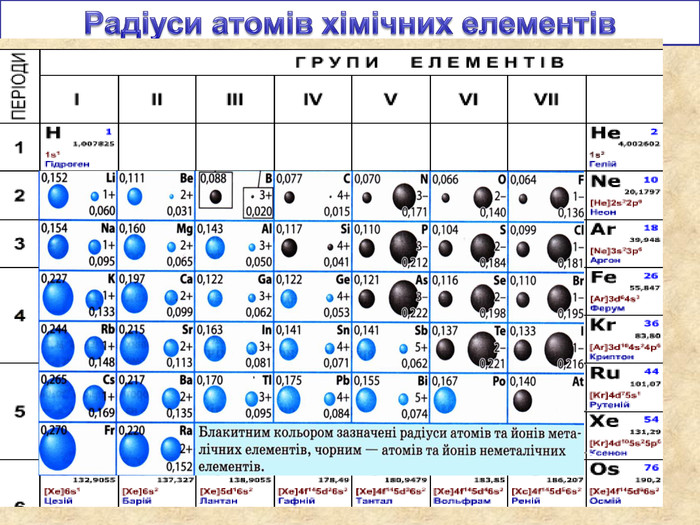
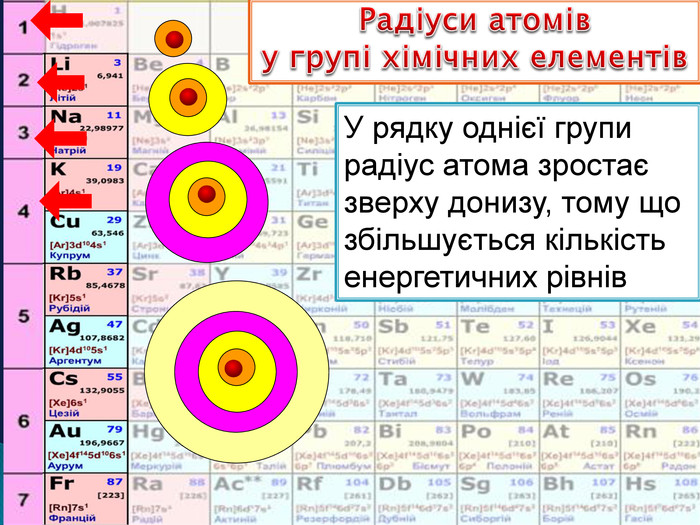







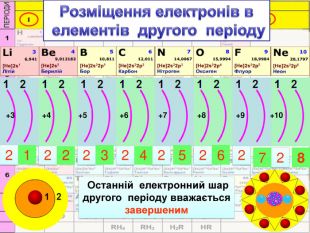
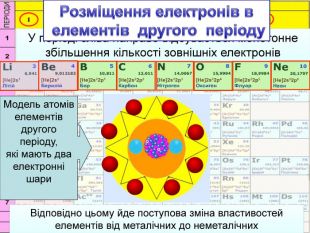
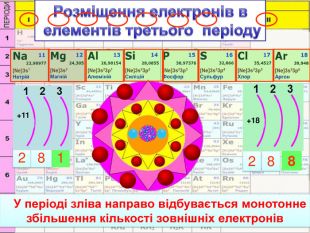
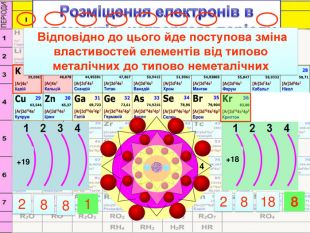
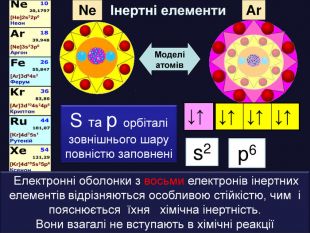
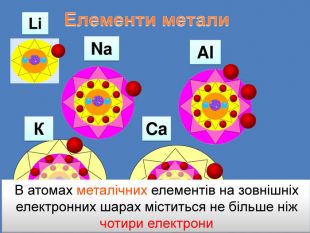
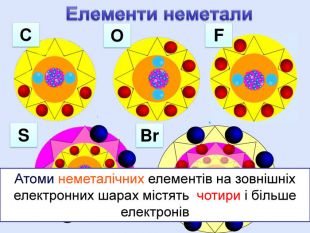
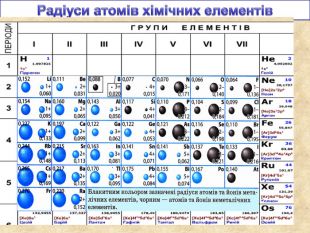
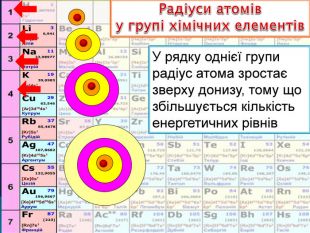
У періоді зліва направо відбувається монотонне збільшення кількості зовнішніх електронів. Відповідно цьому йде поступова зміна властивостей елементів від металічних до неметалічних. Модель атомів елементів другого періоду, які мають два електронні шари. Розміщення електронів в елементів другого періоду
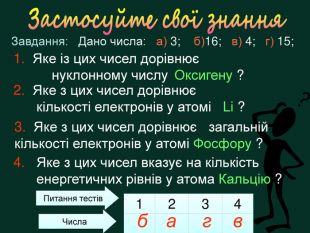
Застосуйте свої знання. Завдання: Дано числа: а) 3; б)16; в) 4; г) 15;1. Яке із цих чисел дорівнює нуклонному числу Оксигену ?3. Яке з цих чисел дорівнює загальній кількості електронів у атомі Фосфору ?2. Яке з цих чисел дорівнює кількості електронів у атомі Li ? 4. Яке з цих чисел вказує на кількість енергетичних рівнів у атома Кальцію ?{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}1234авгб. Питання тестів Числа
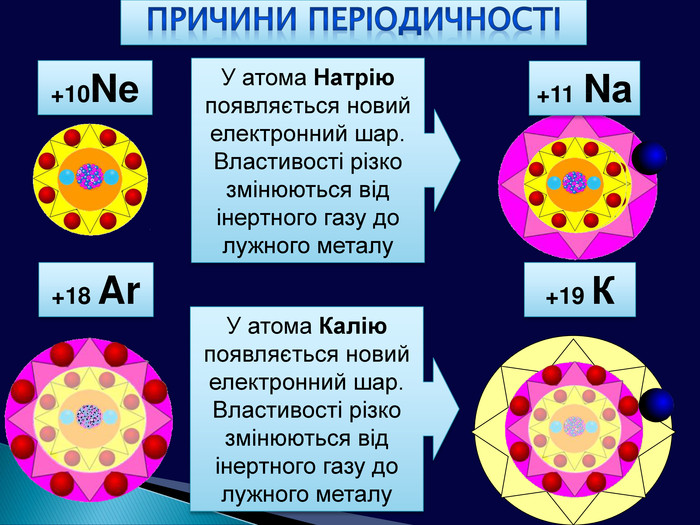
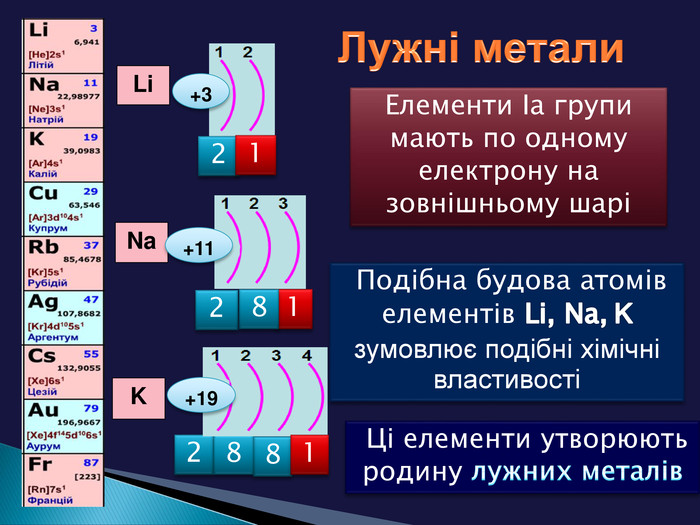
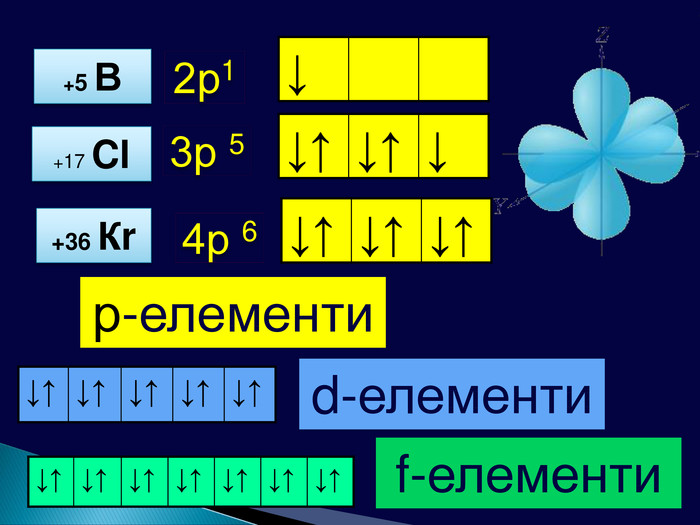
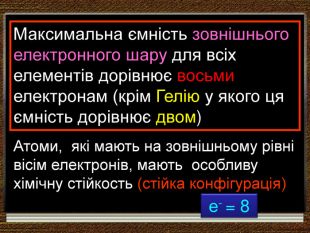
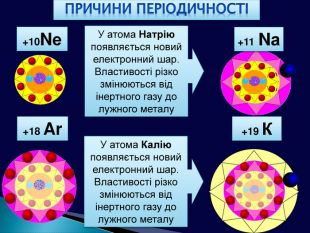
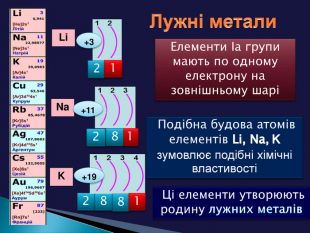
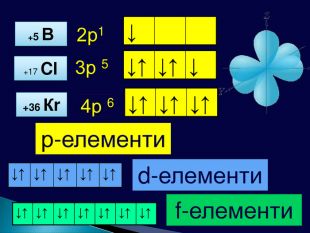
Причиною повторюваності властивостей хімічних елементів та утворених ними сполук є поява елементів з однаковими формами орбіталей зовнішнього електронного шару (енергетичного рівня) (для елементів головних підгруп та передостаннього енергетичного рівня (для елементів побічних підгруп)+11 Nа +3 Li +19 К 1s2 2s 11s2 2s2 2р6 3s1 1s2 2s2 2р6 3s2 3р2 4s2 S-елементи
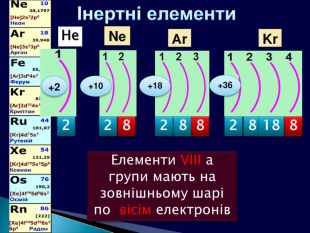
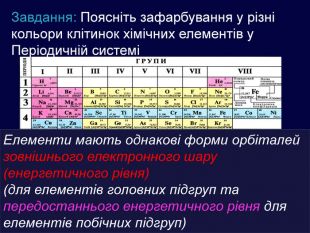
Завдання: Поясніть зафарбування у різні кольори клітинок хімічних елементів у Періодичній системіЕлементи мають однакові форми орбіталей зовнішнього електронного шару (енергетичного рівня) (для елементів головних підгруп та передостаннього енергетичного рівня для елементів побічних підгруп)
Григорович О. В. Хімія: підруч. для 8 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2016 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с. Джерела


про публікацію авторської розробки
Додати розробку

















-

Копаниця Оксана Іванівна
07.11.2024 в 21:53
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бузницька Ольга Миколаївна
30.06.2024 в 23:56
Дякую, колего! Чудова робота!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юсин Надія Улянівна
07.11.2023 в 18:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лабунская Настюша
05.10.2022 в 11:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Топал Елла Іллівна
03.10.2022 в 14:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сердюк Ольга
28.09.2022 в 06:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коротницкий Владимир
16.10.2021 в 23:34
Спасибі за гарну презентацію
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гунбіна Ірина
12.11.2020 в 09:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Радченко Тетяна Василівна
22.10.2020 в 19:44
Дякую автору!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Павленко Тетяна Віталіївна
06.08.2020 в 22:59
Дуже гарно для узагальнення, повторення.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дьяченко Анна Вікторівна
24.10.2018 в 19:54
Дуже добре.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тітенко Катя
22.10.2018 в 19:34
дякую за розробку!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 9 відгуків