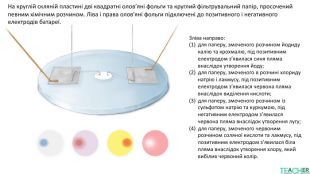
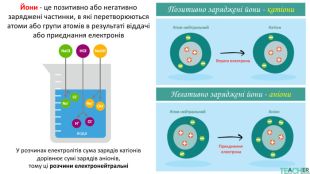
Презентація до уроку: "Електроліти та неелектроліти. Електролітична дисоціація"
Про матеріал
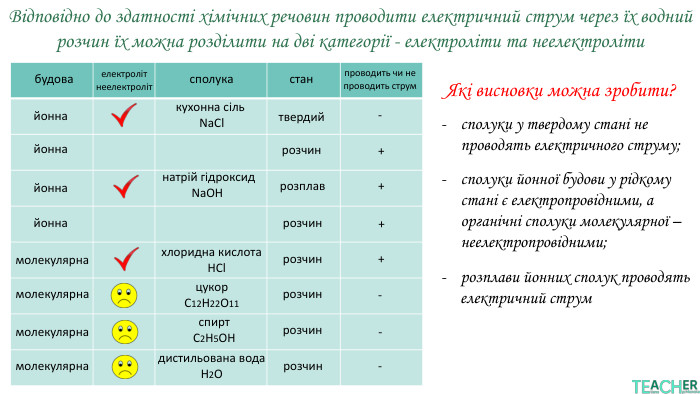
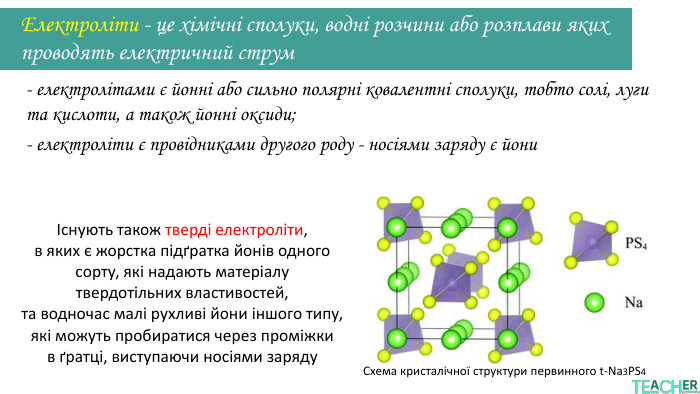
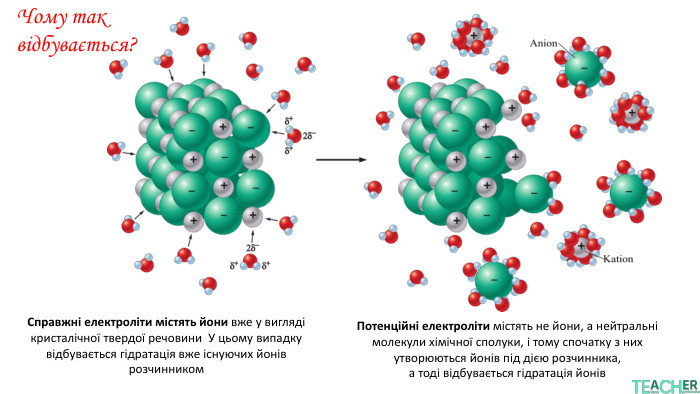
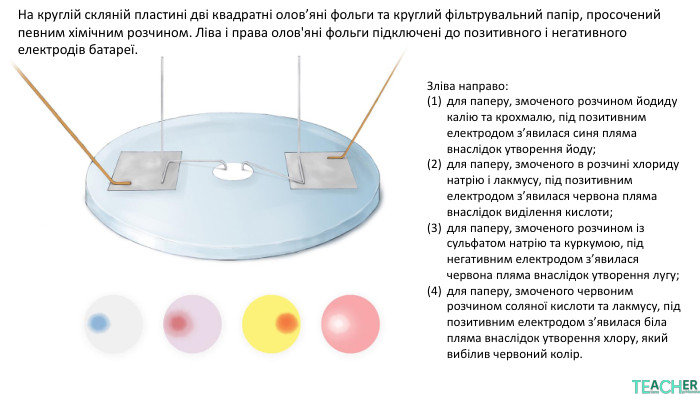
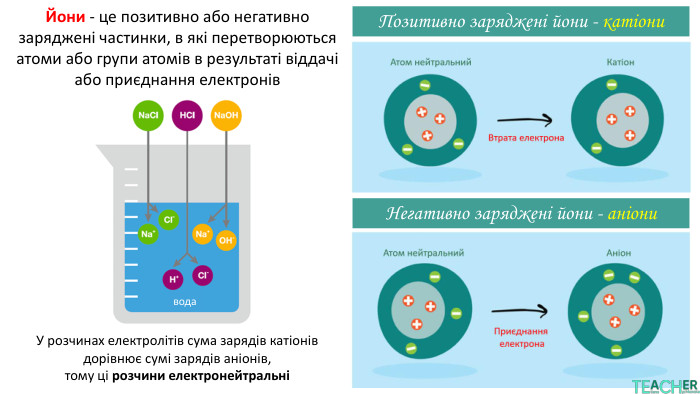
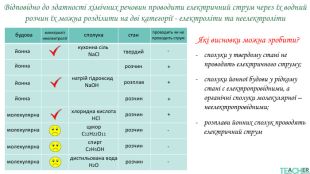
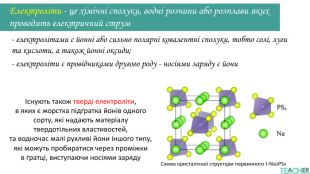
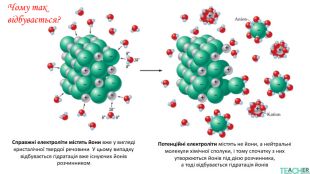
У презентації подано поняття електролітів та неелектролітів, електролітичної дисоціації. Тему проілюстровано світлинами, схемами, таблицями. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Змістовний матеріал. Дякую
-
Як завжди, дуже цікава і якісна робота. Велика подяка автору за її плідну працю. Завжди із задоволенням знайомлюсь з її новими наробками з хімії та біології.
-
Дякую дуже!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку