Презентація до уроку хімії "Фізичні та хімічні властивості кислот"
Про матеріал
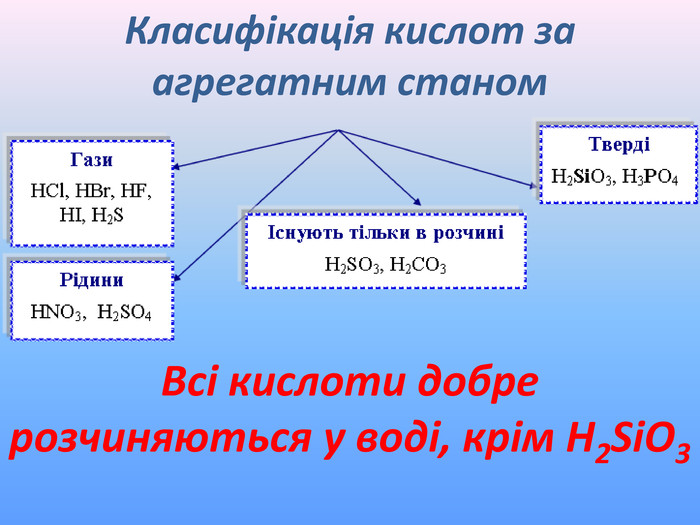
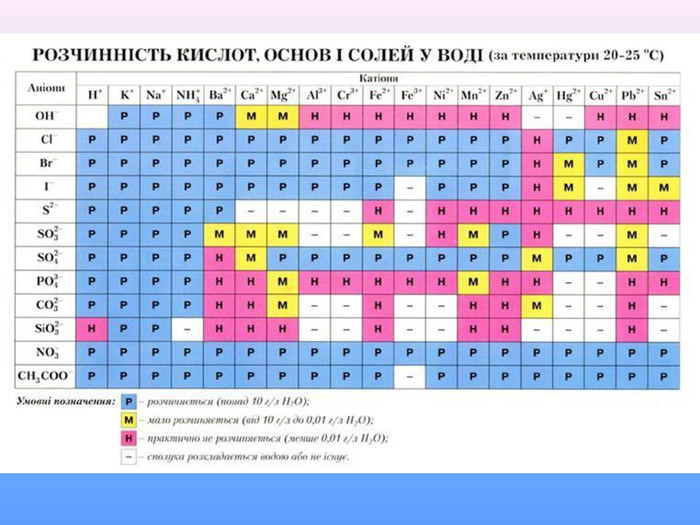
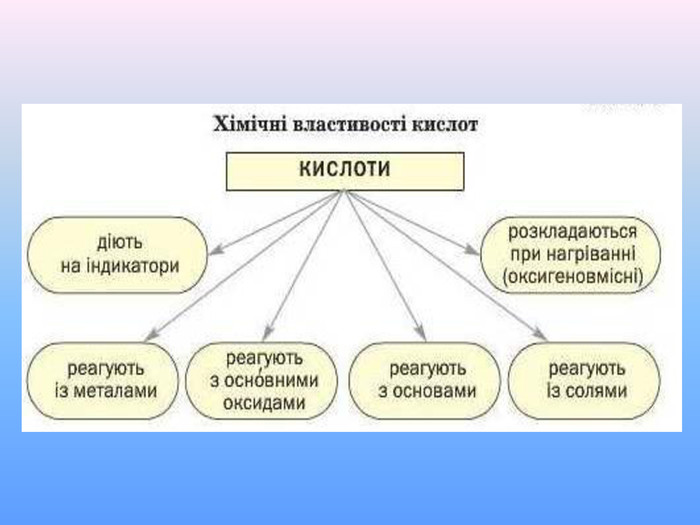
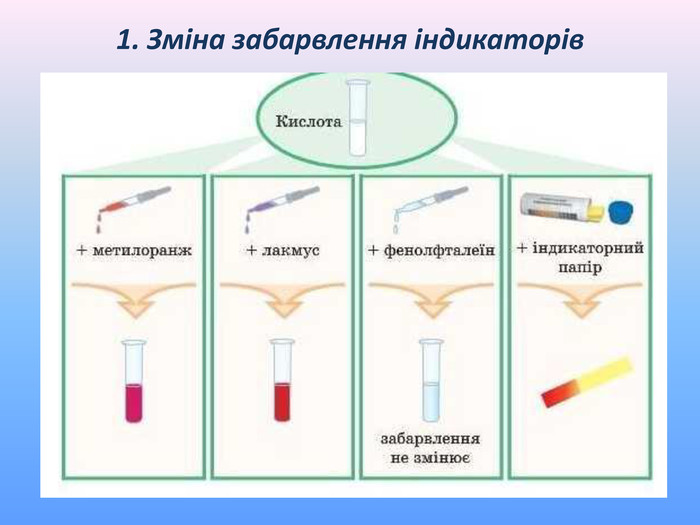
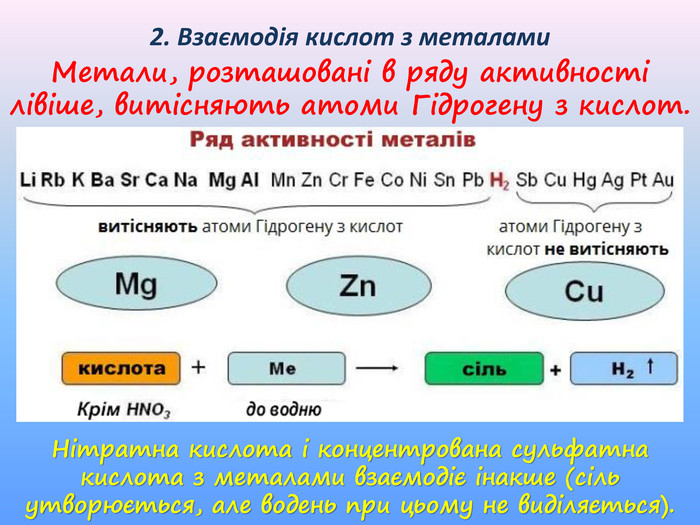
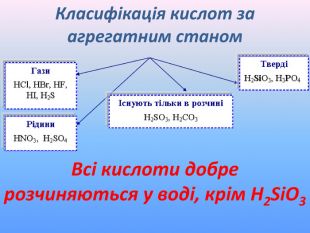
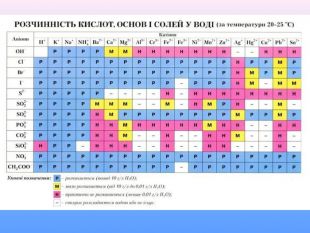
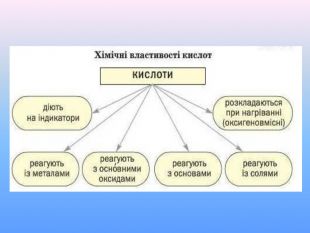
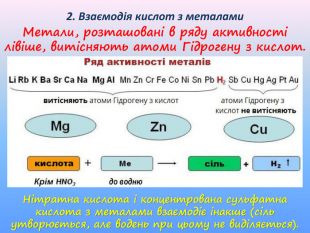
Презентація до уроку хімії "Фізичні та хімічні властивості кислот" приначена для самостійного опрацювання. Опанувавши матеріал діти зможуть розрізняти фізичні властивості кислот; визначати зміну забарвлення індикаторів у кислому середовищі; характеризувати хімічні властивості кислот і наводити приклади рівнянь реакцій, що характеризують хімічні властивості кислот; прогнозувати перебіг реакцій взаємодії кислот з металами. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку