Презентація до уроку хімії з теми "Кислоти" для учнів 8 класу
Про матеріал
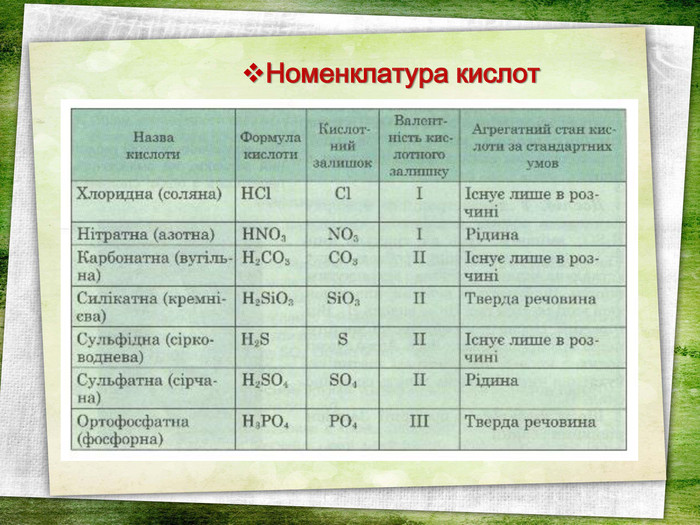
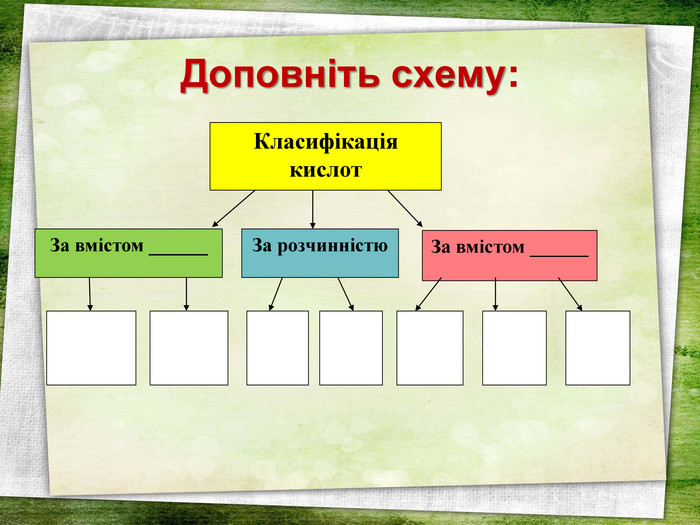
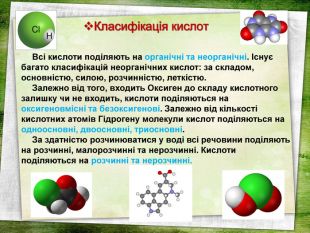
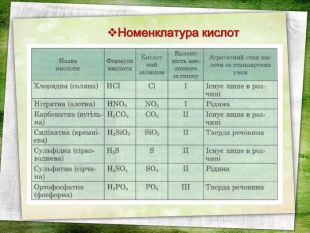
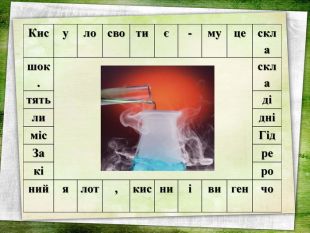
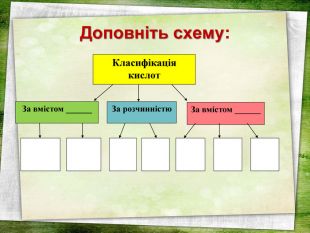
Дану презентацію можна використати на уроці хімії з теми "Кислоти" у 8 класі. На слайдах є всі хімічні формули кислот, всі хімічні формули (молекулярні) та їх назви, також структурні формули кислот, кросворд, синквейн.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку