Презентація до уроку на тему " Електролітична дисоціація"
Про матеріал
Презентація до уроку на тему " Електролітична дисоціація" допомагає учням зрозуміти сутність електролітичної дисоціації,розпізнавати
електроліти та неелектроліти, знайомить з ТЕД(теорія електролітичної дисоціації), навчає записувати рівняння
електролітичної дисоціації кислот, основ, солей у водних розчинах; дає поняття ступінь дисоціації та сильні й слабкі електроліти
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


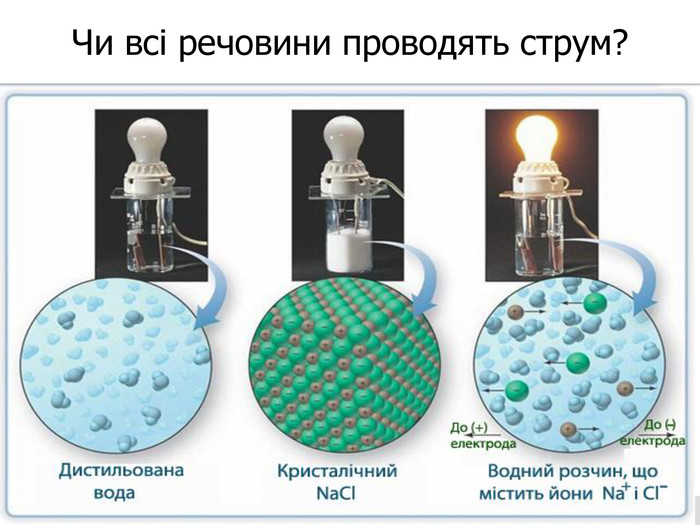







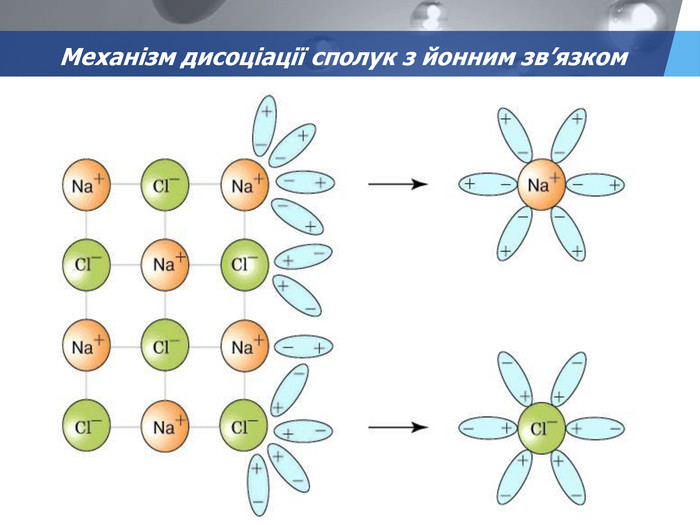







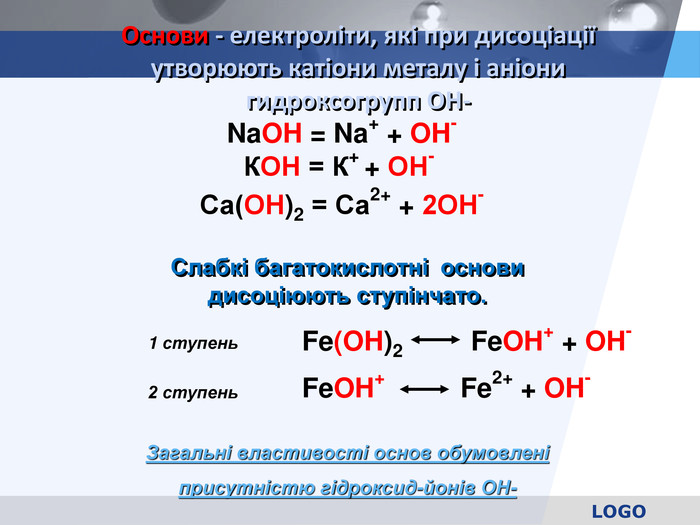





























-

Зінченко Наталія Миколаївна
03.10.2024 в 22:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кальчик Ірина Вікторівна
13.10.2023 в 15:46
Дякую! Дуже гарна презентація. Успіхів у роботі.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Панасюк Марія
13.10.2022 в 10:23
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лаптєва Інна
07.10.2022 в 10:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Матрунчик Ніна
29.05.2022 в 17:18
Дякую !
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Бугор Валентина
19.10.2021 в 14:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайленко Лариса Анатоліївна
09.10.2021 в 14:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Корнієнко Ліана Олександрівна
06.10.2021 в 09:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лобань Світлана Миколаївна
11.01.2021 в 19:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мігунова Олена Ігорівна
20.11.2019 в 00:04
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Біденко Ніна Дмитрівна
30.09.2018 в 20:43
Презентація відповідає сучасним вимогам медіауроків.
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
4.0
Показати ще 8 відгуків