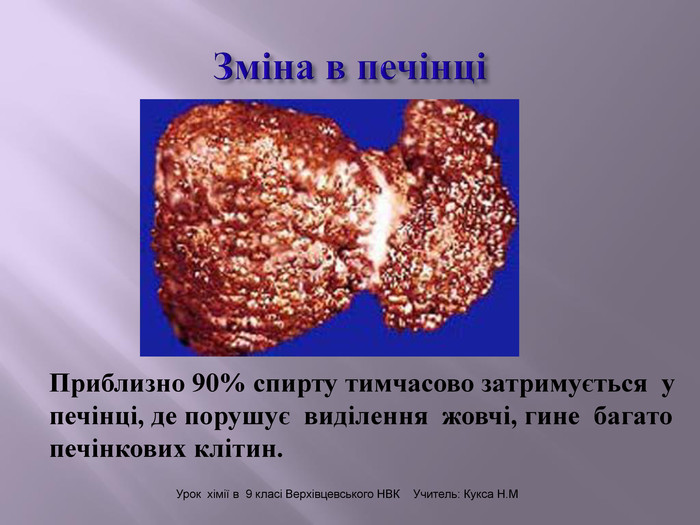
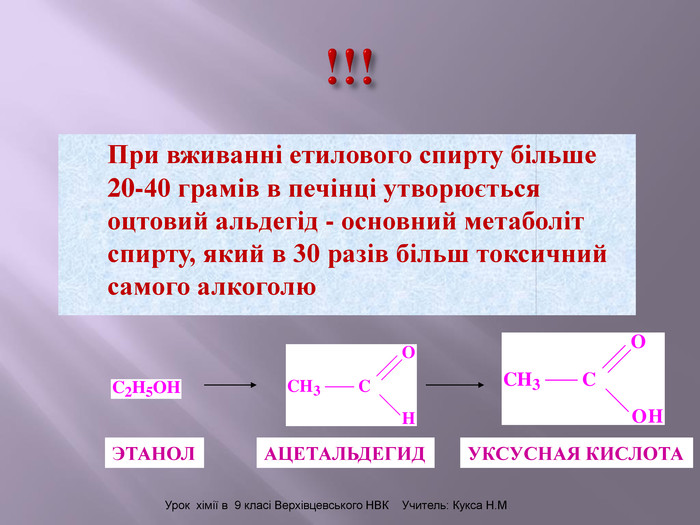
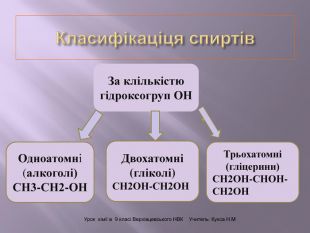
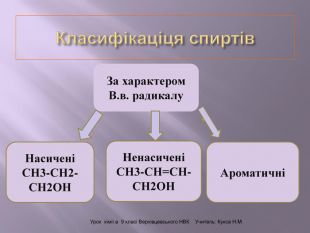
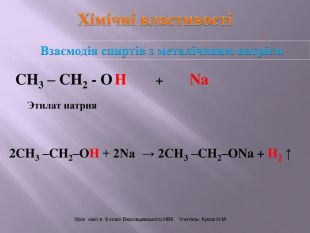
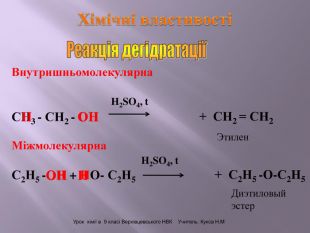
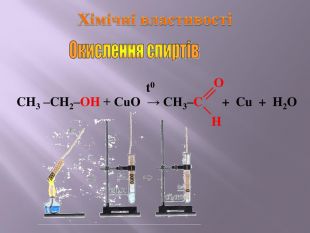
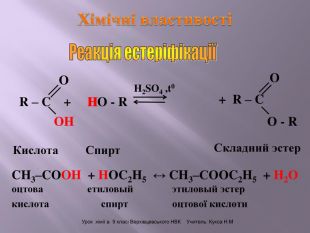
Презентація до уроку "Спирти"
Про матеріал
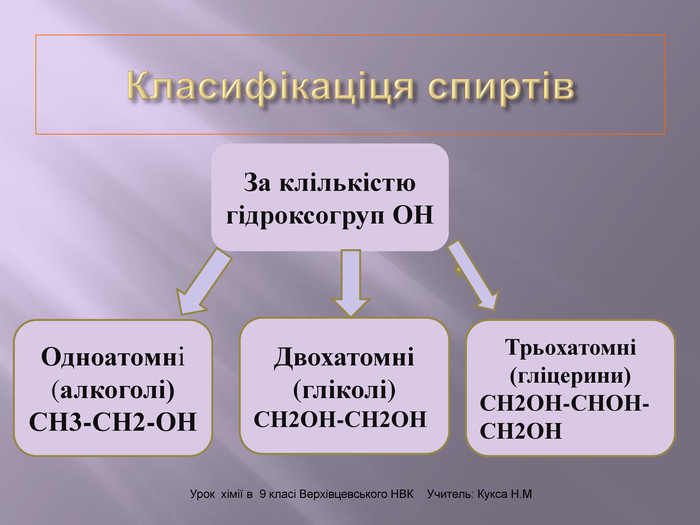
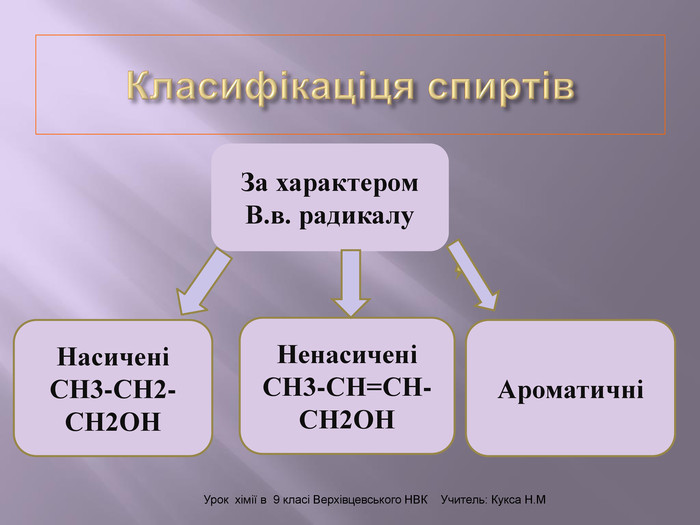
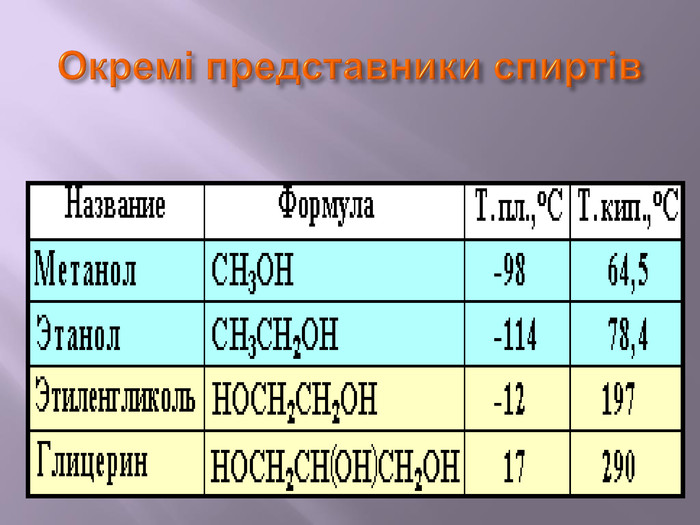
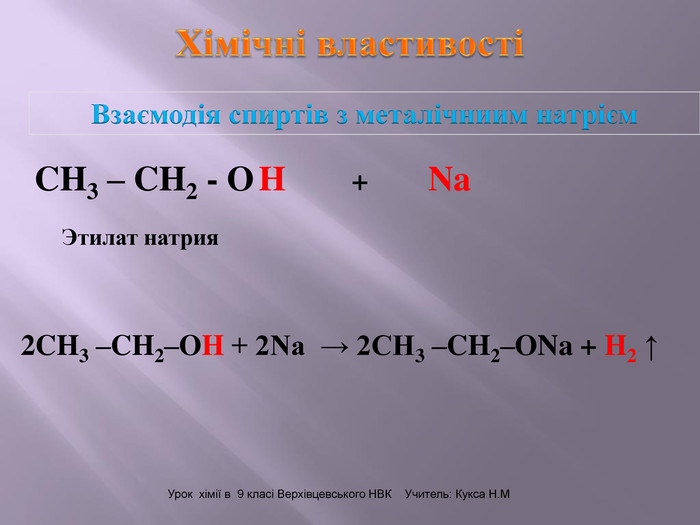
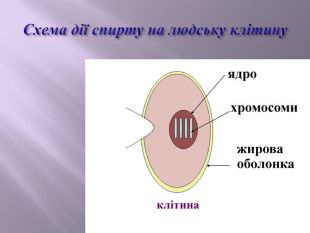
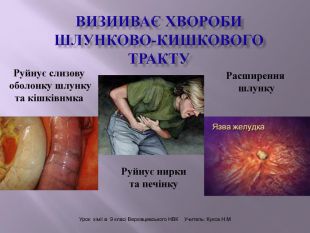
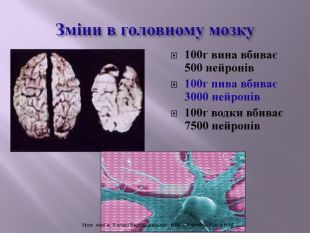
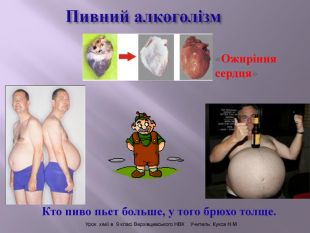
Презентація до уроку "Спирти"дає можливість учням отримати інформацію,щодо класифікації ,будови, назви стиртів.А також властивостів та дії на організм людини.
Перегляд файлу
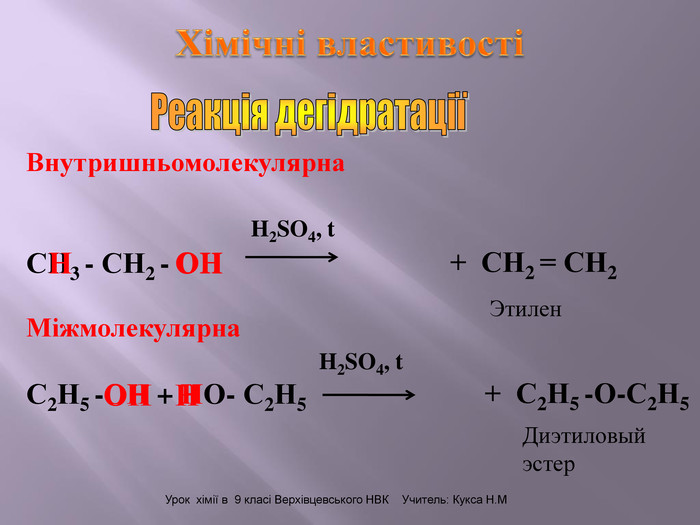
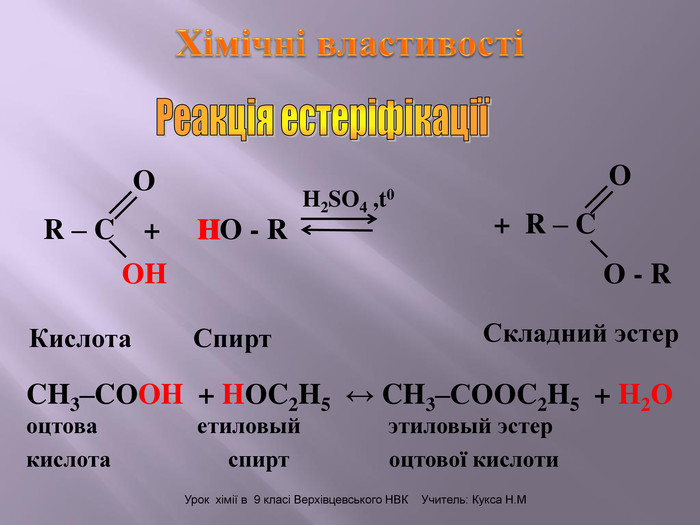
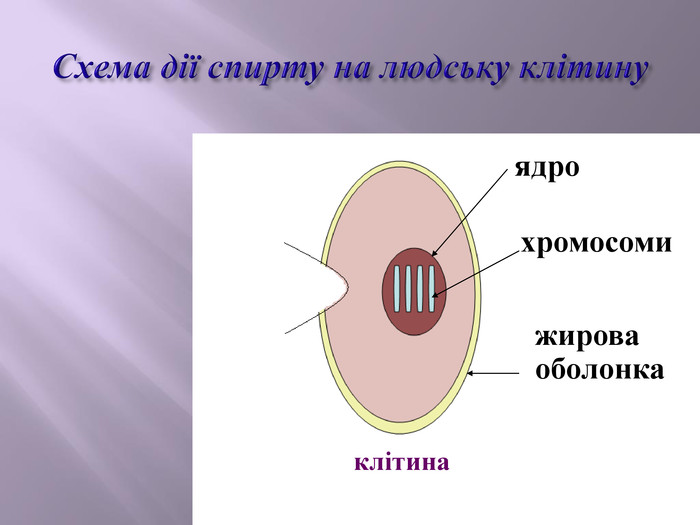
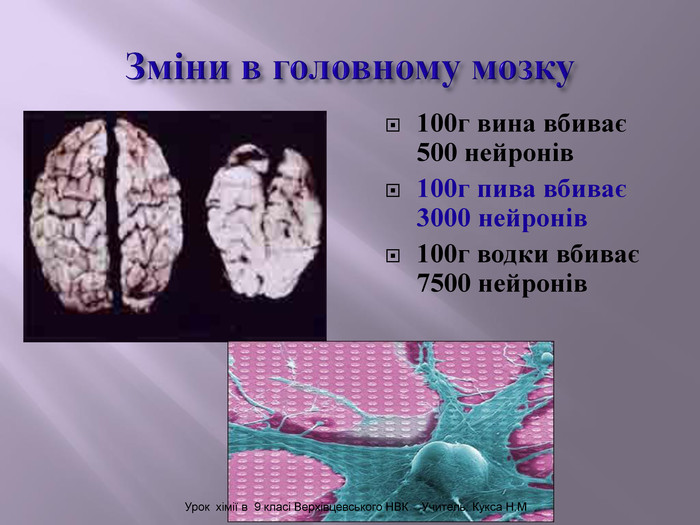
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку