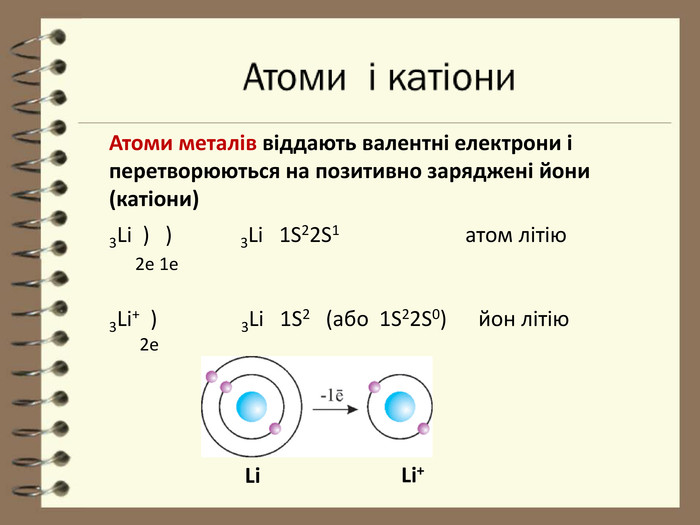
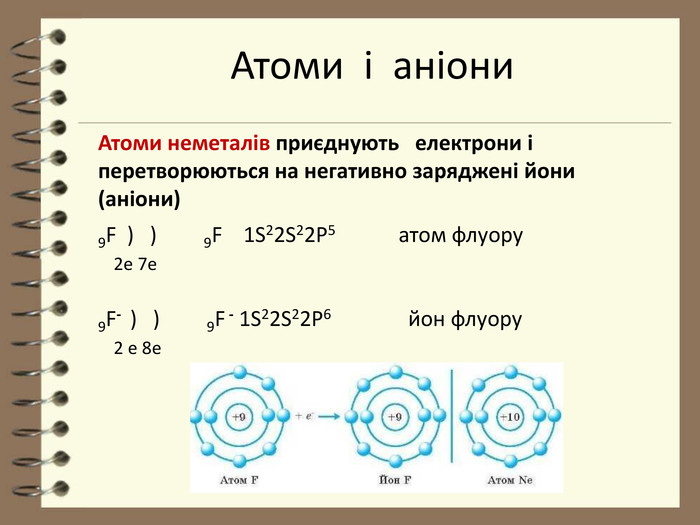
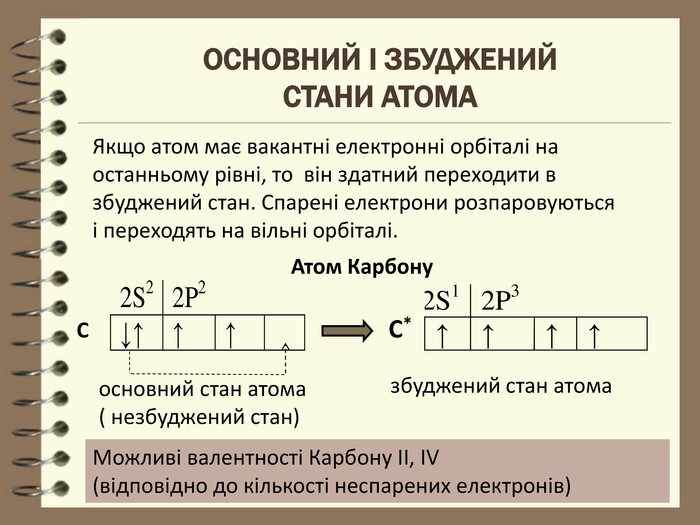
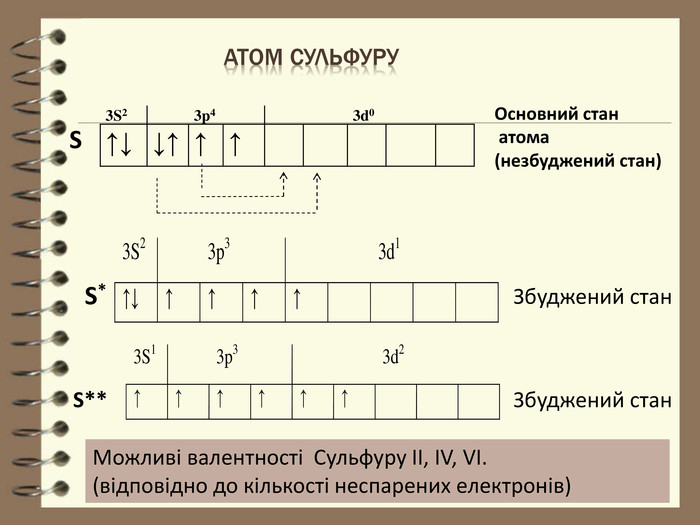
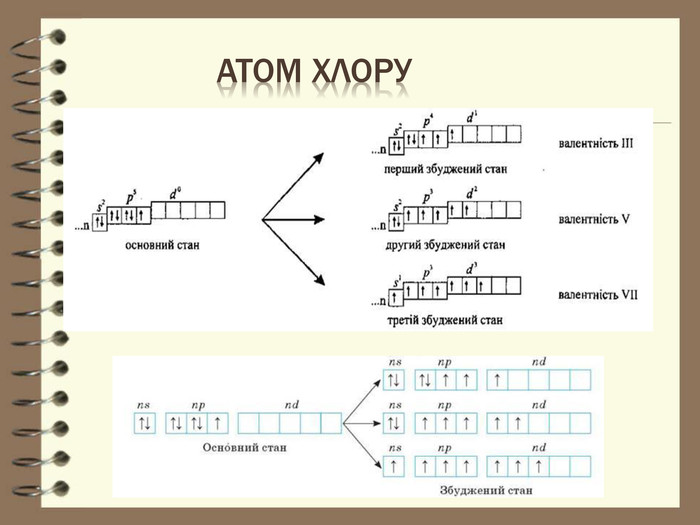
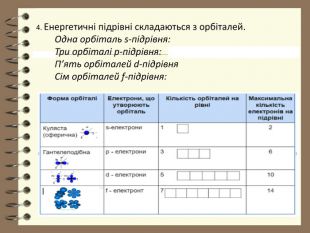
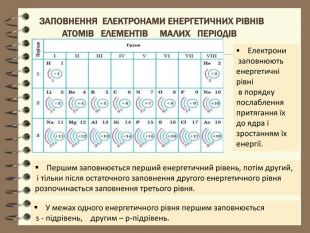
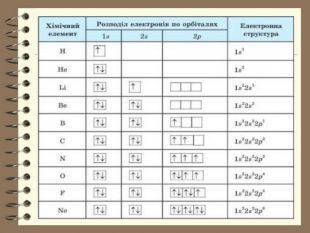
Презентація до уроку з хімії для 8 класу " Будова електронних оболонок атомів та йонів. Основний та збуджений стан атома"
Про матеріал
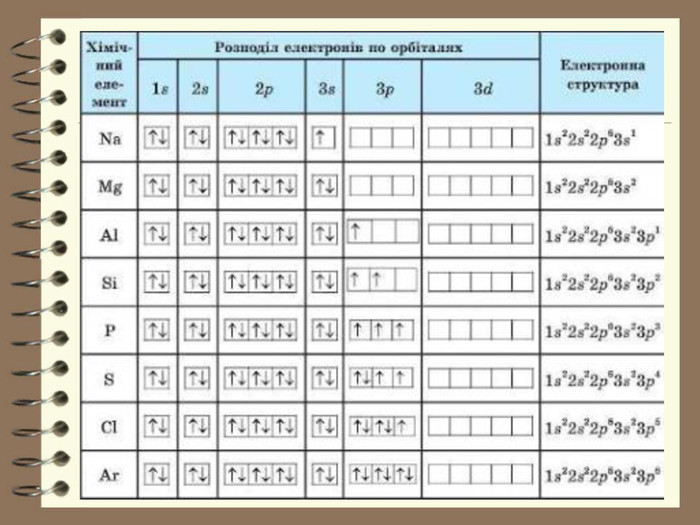
Презентація до уроку з хімії для 8 класу " Будова електронних оболонок атомів та йонів. Основний та збуджений стан атома". Розглядаються особливості заповнення електронних оболонок йонів, атомів , що перебувають в основному та збудженому стані. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
Щиро дякую за розробку уроку та презентацію. Допомогла в підготовці.
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




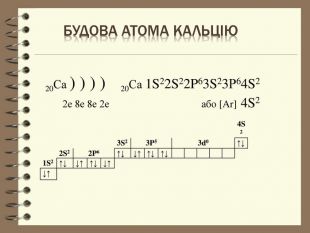
![Заповнення електронами енергетичних рівнів атомів елементів великих періодів. У елементів 4 періоду спочатку заповнюється 4 S-підрівень ( у К та Са), а потім 3d – підрівень. Причина такої послідовності полягає у тому, що, підрівень 4s характеризується більш низькою енергією, ніж підрівень 3d. Тому такий стан зовнішніх електронів Калія і Кальція більш стійкий.19 К ) ) ) ) 19 К 1 S22 S22 P63 S23 Р64 S1 або 2е 8е 8е 1е [Ar] 4 S1 4 S1 3 S23 P63d0↑ 2 S22 P6↑↓↓↑↑↓↑↓ 1 S2↑↓↓↑↑↓↓↑ ↓↑ Заповнення електронами енергетичних рівнів атомів елементів великих періодів. У елементів 4 періоду спочатку заповнюється 4 S-підрівень ( у К та Са), а потім 3d – підрівень. Причина такої послідовності полягає у тому, що, підрівень 4s характеризується більш низькою енергією, ніж підрівень 3d. Тому такий стан зовнішніх електронів Калія і Кальція більш стійкий.19 К ) ) ) ) 19 К 1 S22 S22 P63 S23 Р64 S1 або 2е 8е 8е 1е [Ar] 4 S1 4 S1 3 S23 P63d0↑ 2 S22 P6↑↓↓↑↑↓↑↓ 1 S2↑↓↓↑↑↓↓↑ ↓↑](/uploads/files/96066/194036/209658_images/7.jpg)
![Будова атома Кальцію20 Са ) ) ) ) 20 Са 1 S22 S22 P63 S23 Р64 S2 2е 8е 8е 2е або [Ar] 4 S2 4 S2 3 S23 P53d0↑↓ 2 S22 P6↑↓↓↑↑↓↑↓ 1 S2↑↓↓↑↑↓↓↑ ↓↑ Будова атома Кальцію20 Са ) ) ) ) 20 Са 1 S22 S22 P63 S23 Р64 S2 2е 8е 8е 2е або [Ar] 4 S2 4 S2 3 S23 P53d0↑↓ 2 S22 P6↑↓↓↑↑↓↑↓ 1 S2↑↓↓↑↑↓↓↑ ↓↑](/uploads/files/96066/194036/209658_images/8.jpg)