Презентація до уроку з хімії для 8 класу "Поняття про лужні, інертні елементи, галогени."
Про матеріал
Презентація до уроку з хімії для 8 класу "Поняття про лужні, інертні елементи, галогени."
Перегляд файлу
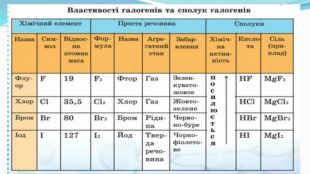
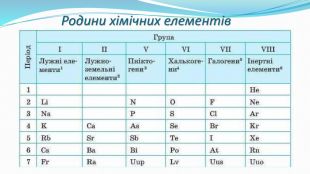
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




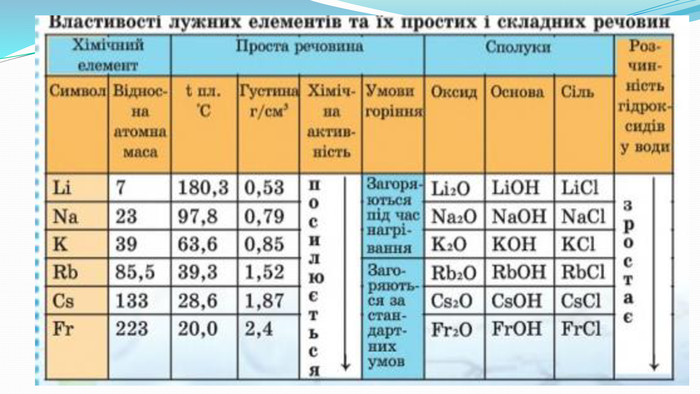






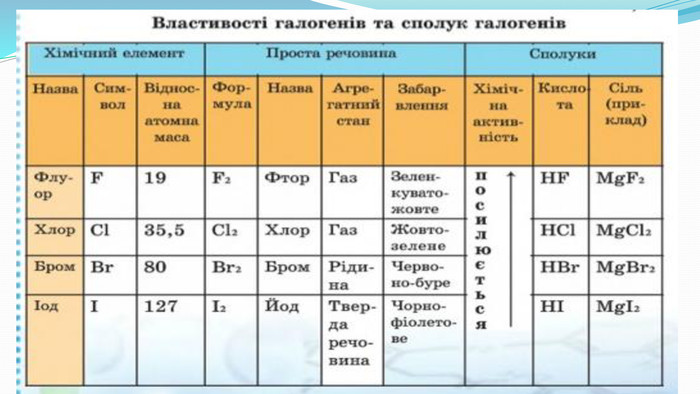




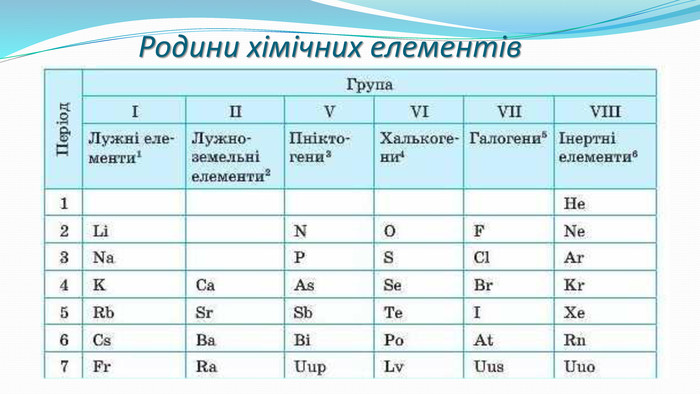













-

Грищенко Ірина Володимирівна
08.10.2023 в 12:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
28.09.2023 в 23:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фесенко Надежда
21.09.2023 в 12:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гнатюк Віра Олексіївна
19.09.2023 в 06:47
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

сусь надія
19.02.2023 в 16:48
Щиро дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Инна
22.09.2022 в 20:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полуда Тетяна Олександрівна
18.09.2022 в 17:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грейцер Ірина Миколаївна
18.09.2022 в 15:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Міщенко Галина Миколаївна
15.09.2022 в 10:16
Дякую, чудова презентація!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Носова Антоніна Анатоліївна
14.09.2022 в 09:39
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гонтар Валентина
11.09.2022 в 18:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
08.09.2022 в 20:21
Чудова презентація. Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
15.09.2021 в 22:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 10 відгуків