Презентація "Електролітична дисоціація. Електроліти і неелектроліти."




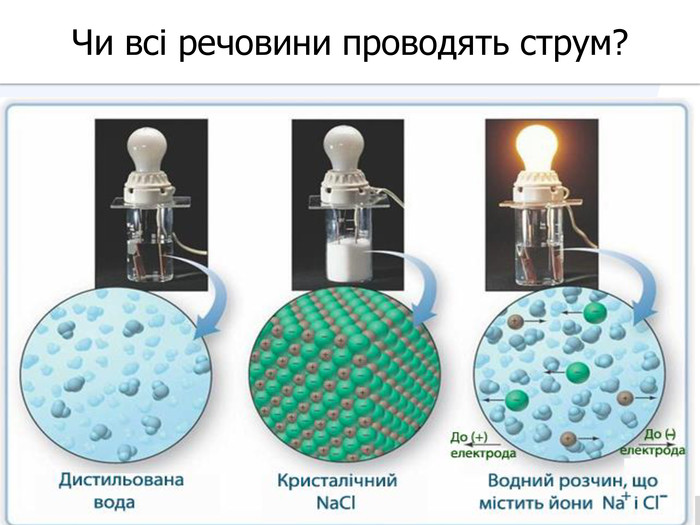
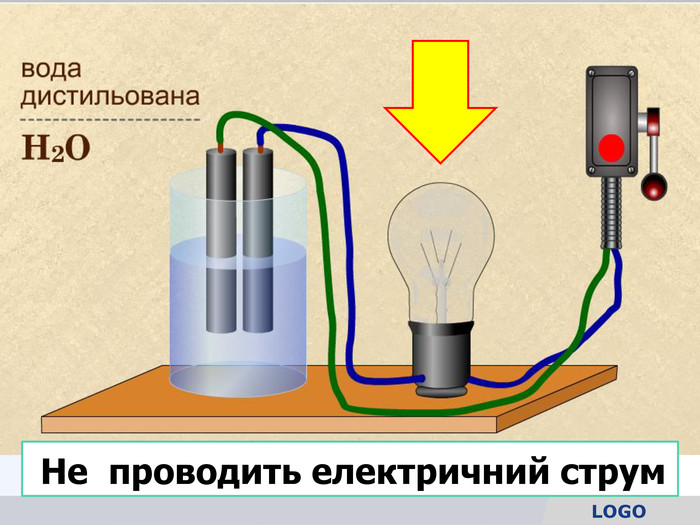
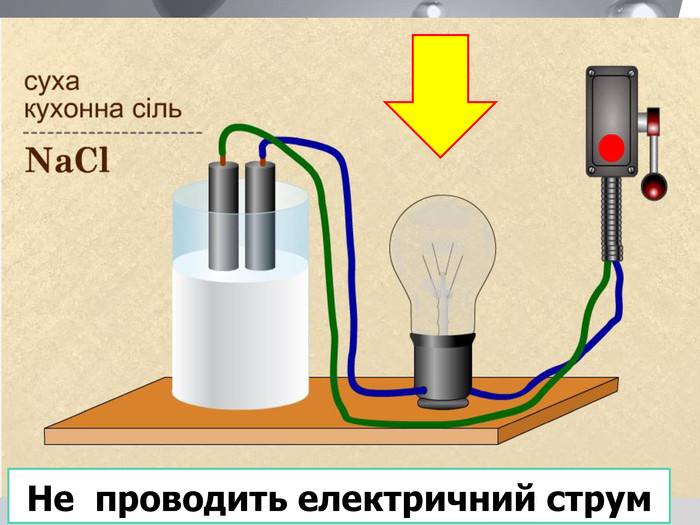
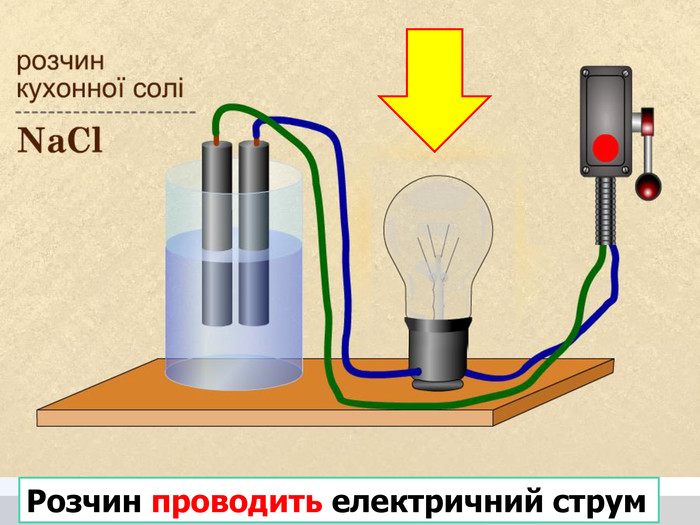

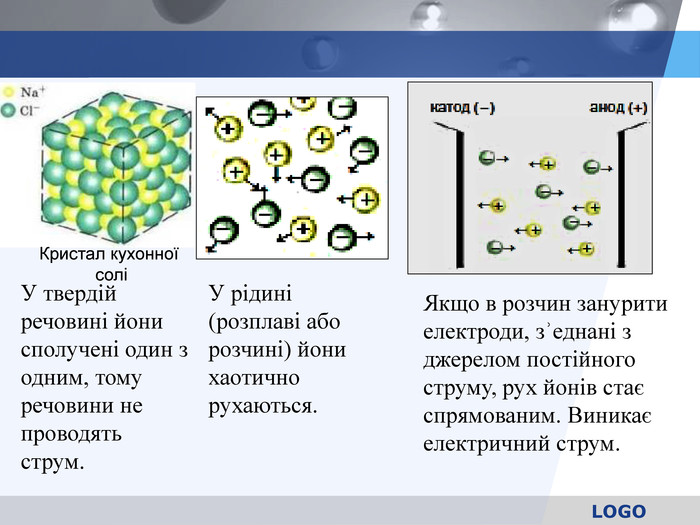


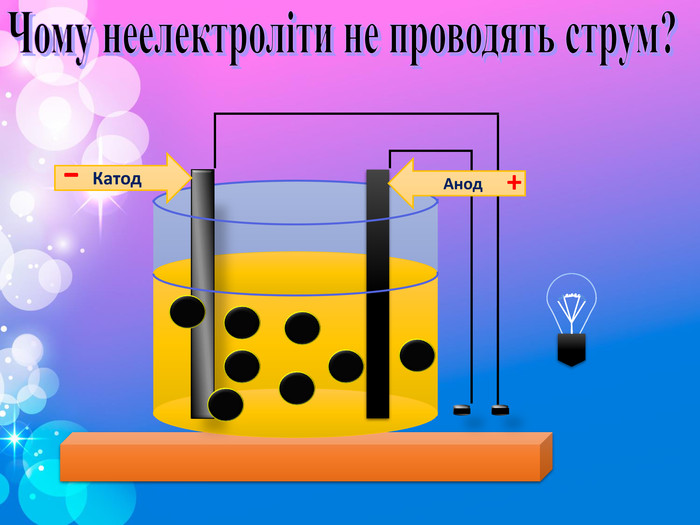












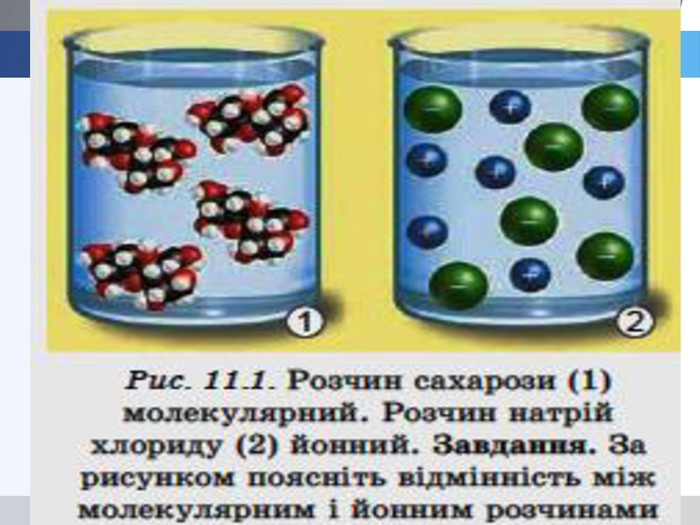


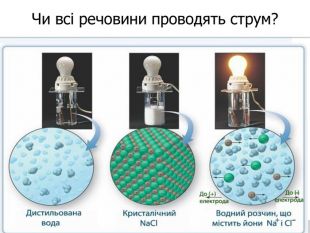
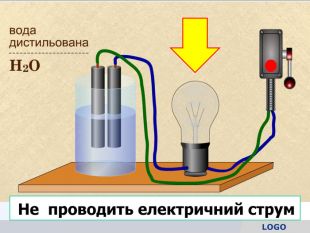
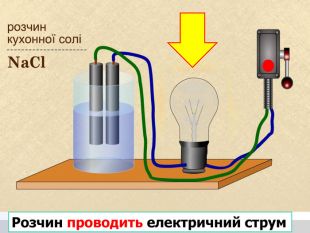
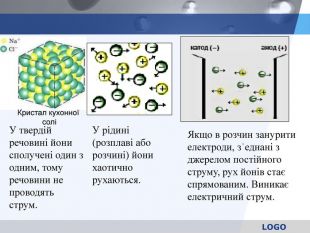
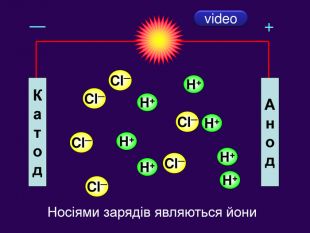
У твердій речовині йони сполучені один з одним, тому речовини не проводять струм. Якщо в розчин занурити електроди, зʾеднані з джерелом постійного струму, рух йонів стає спрямованим. Виникає електричний струм. Кристал кухонної солі У рідині (розплаві або розчині) йони хаотично рухаються.
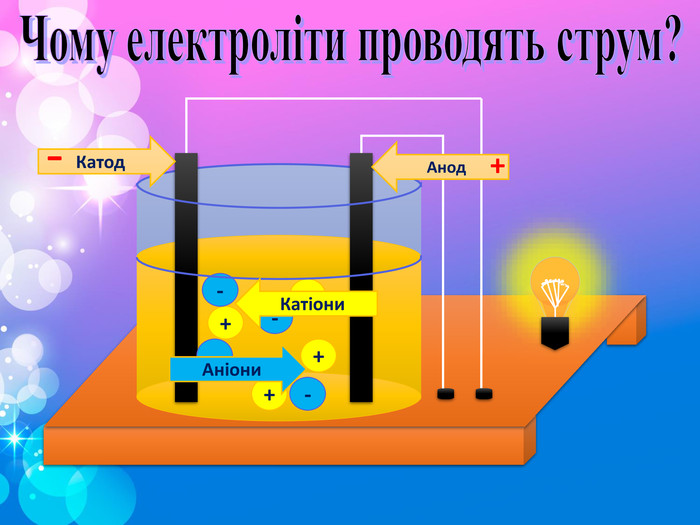
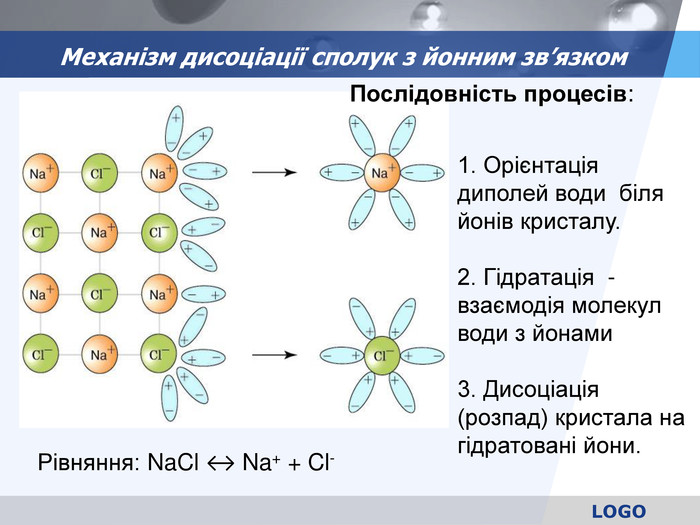
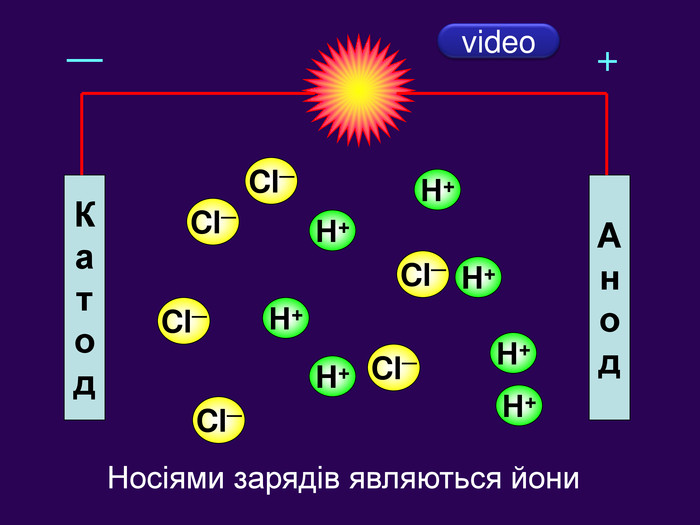
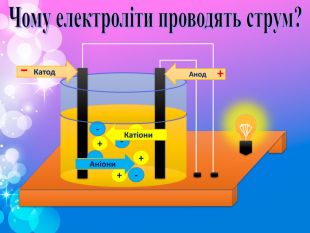
Теорія електролітичної дисоціації 1. При розчиненні або плавленні електроліту, його молекули розпадаються на йони – відбувається електролітична дисоціація. 2. У розчині або розплаві електроліту йони рухаються хаотично (неупорядковано), а при пропусканні електричного струму йони набувають напрямленого руху: позитивно заряджені йони рухаються до негативного електрода (катода), а негативно заряджені – до позитивного (анода). 3. Дисоціація – процес оборотний. Паралельно з процесом дисоціації (розпадом молекул на йони) відбувається асоціація (об’єднання йонів у молекули).
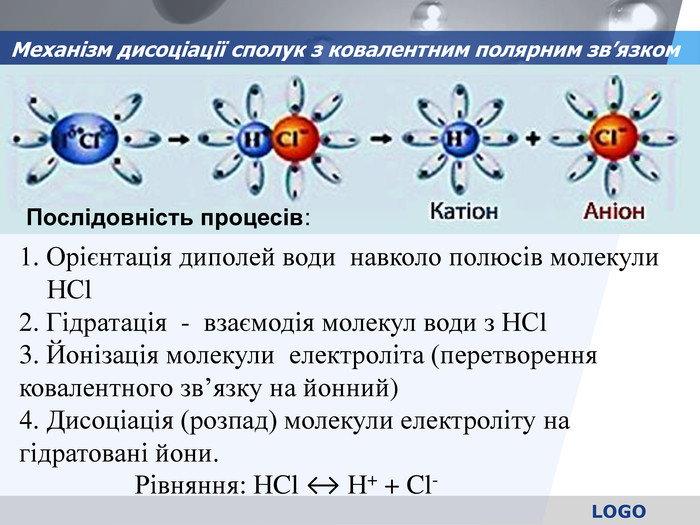
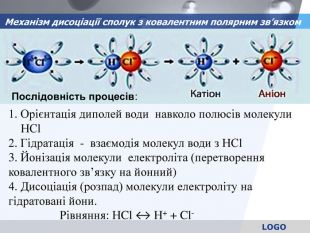
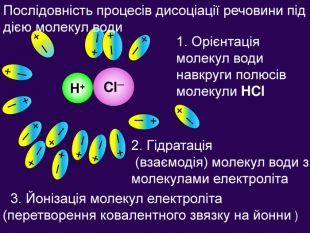
Механізм дисоціації сполук з ковалентним полярним зв’язком 1. Орієнтація диполей води навколо полюсів молекули НСl 2. Гідратація - взаємодія молекул води з НСl 3. Йонізація молекули електроліта (перетворення ковалентного зв’язку на йонний) 4. Дисоціація (розпад) молекули електроліту на гідратовані йони. Рівняння: НCl ↔ Н+ + Cl- Послідовність процесів:
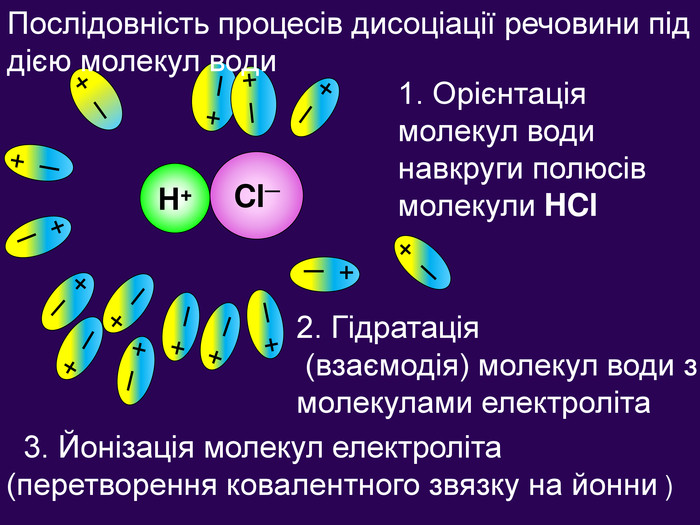
2. Гідратація (взаємодія) молекул води з молекулами електроліта + ─ Н+ Cl─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ + ─ Послідовність процесів дисоціації речовини під дією молекул води 1. Орієнтація молекул води навкруги полюсів молекули HCl 3. Йонізація молекул електроліта (перетворення ковалентного звязку на йонни )
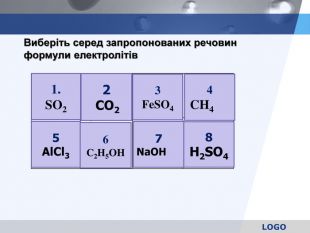
Речовини , розчини яких проводять електричний струм. Процес розпаду електроліту на іони . Позитивно заряджені іони . Негативно заряджені іони Електроліти , які при дисоціації утворюють катіони гідрогену і аніони кислотного залишку . Електроліти , які при дисоціації утворюють катіони металу і аніони гидроксогрупп ОН-. . Закінчити речення
7. Электролиты , які при дисоціації утворюють катіони металу і аніони кислотних залишків . 8. Кількісна характеристика електролітичноїдисоціації. 9. Молекули, що мають два електричних заряду , рівних за величиною , але протилежних за знаком , і розташованих на деякій відстані один від одного. 10. Який вчений запропонував поділ речовин на дві групи? 11. Автор теорії електролітичної дисоціації. Закінчити речення


про публікацію авторської розробки
Додати розробку
























-

Черниш Оксана Сергіївна
04.10.2023 в 22:57
дЯКУЮ!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костіна Неля Миколаївна
02.10.2023 в 09:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайлюк Галина
18.10.2022 в 09:17
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
12.10.2022 в 09:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Франчук Мар'яна Віталіївна
10.10.2022 в 10:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
04.10.2022 в 20:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kiriyenko Olena
27.10.2021 в 11:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука