Презентація до уроку № 16 "Йонно-молекулярні рівняння реакцій"
Про матеріал
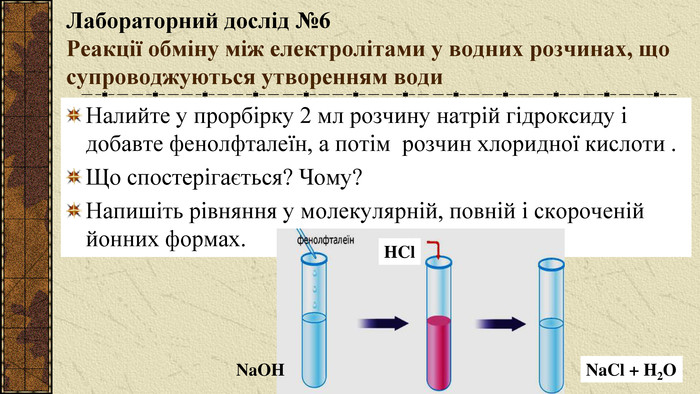
Презентація до уроку на тему "Йонно-молекулярні рівняння реакцій". Виконання лабораторних дослідів, тренувальних впрів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!!!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку