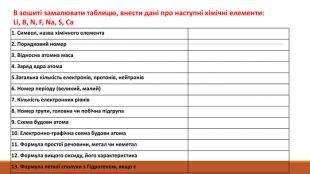
Презентація: "Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома"
Про матеріал
Презентація Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома - для засвоєння нових знань, як доповнення до уроку Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку