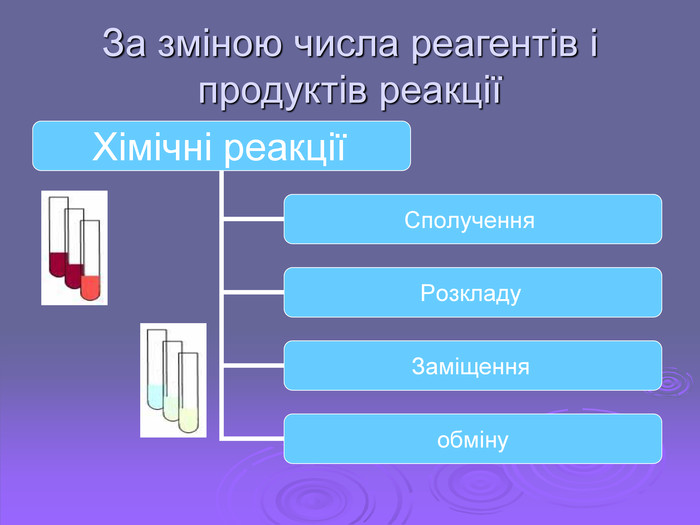
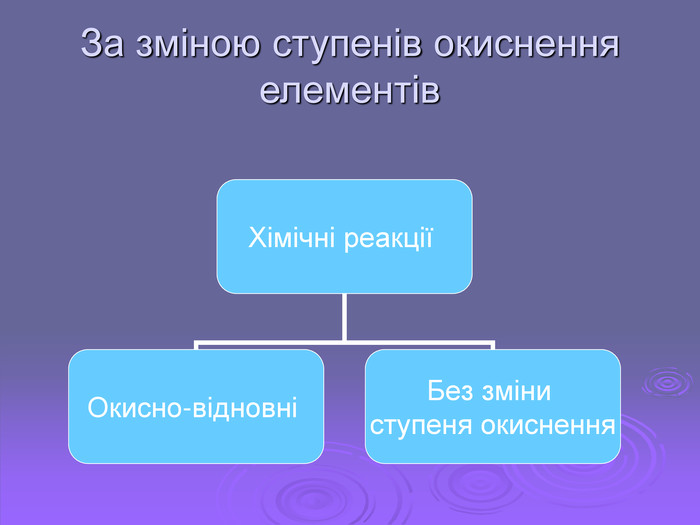
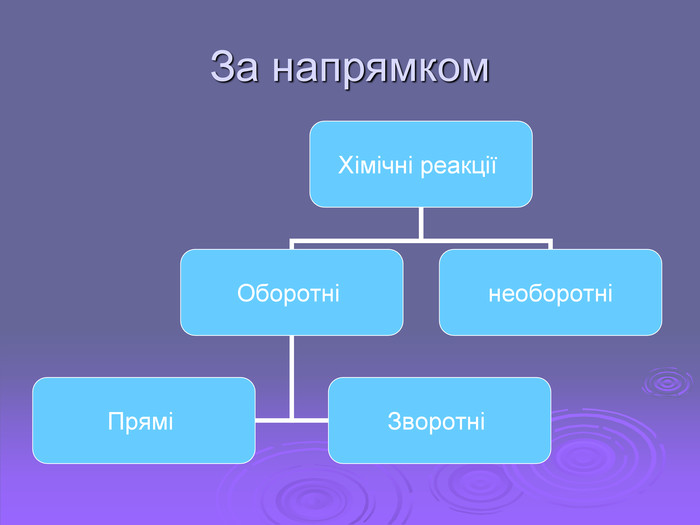
Презентація "Хімічні реакції"
Про матеріал
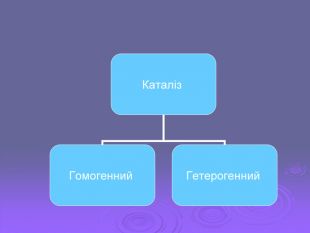
Презентація містить теоретичний і практичний аспект Може бути використана як супровід до уроку з теми "Хімічні реакції та закономірності їх перебігу"
Перегляд файлу
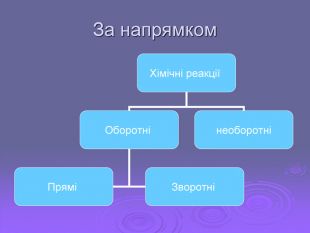
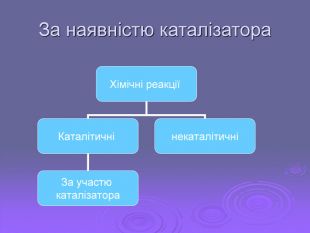
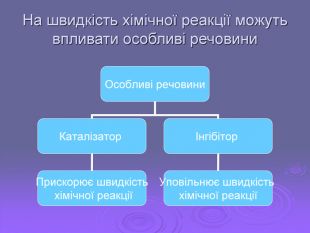
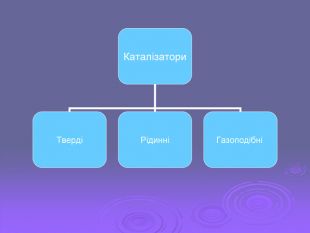
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
скажіть будь-ласка відповіді на 22 питання
-
ppt
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку