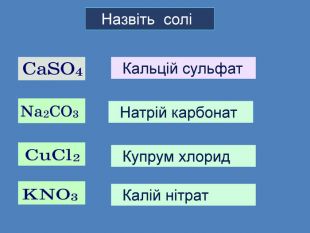
Презентація «Хімічні властивості солей». 8 клас
| Презентація допоможе в проведенні уроків на теми: «Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями». |

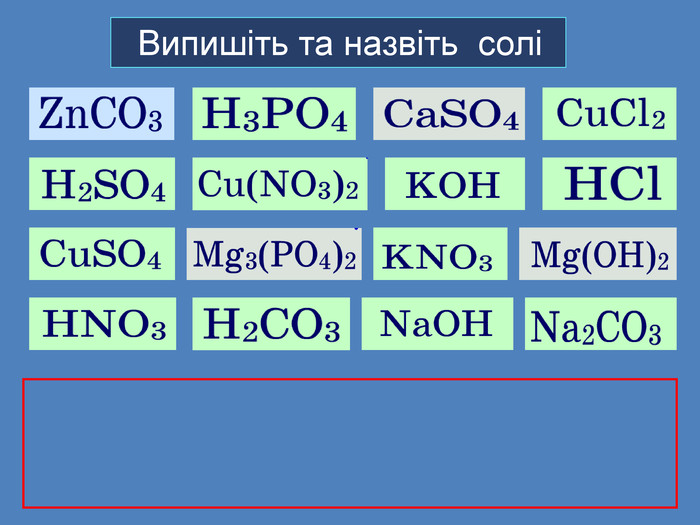
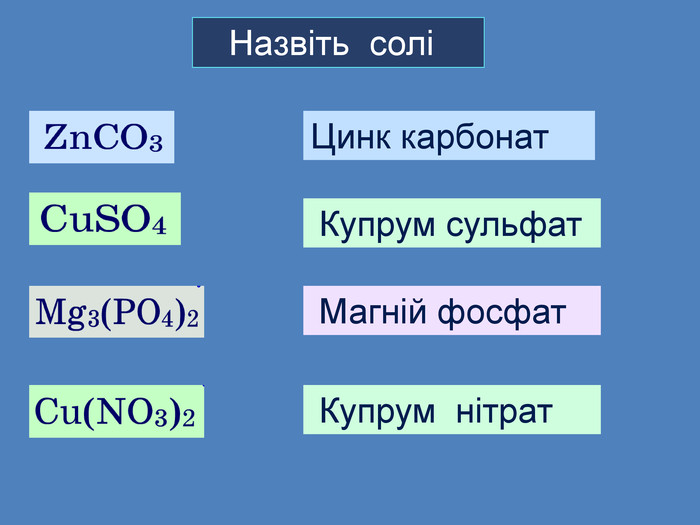
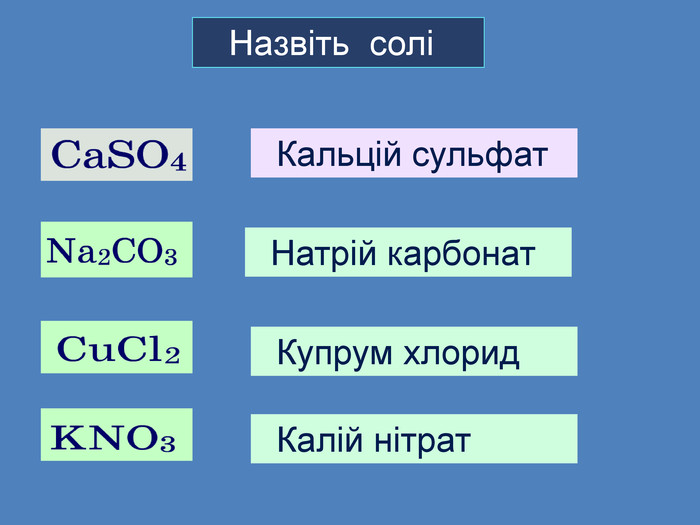



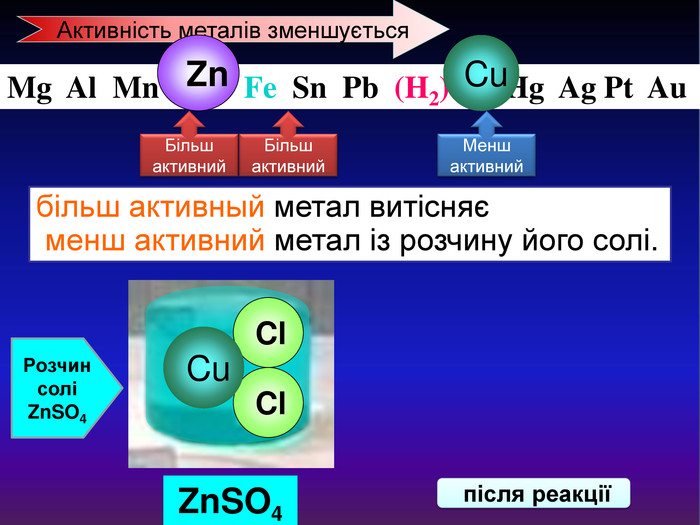

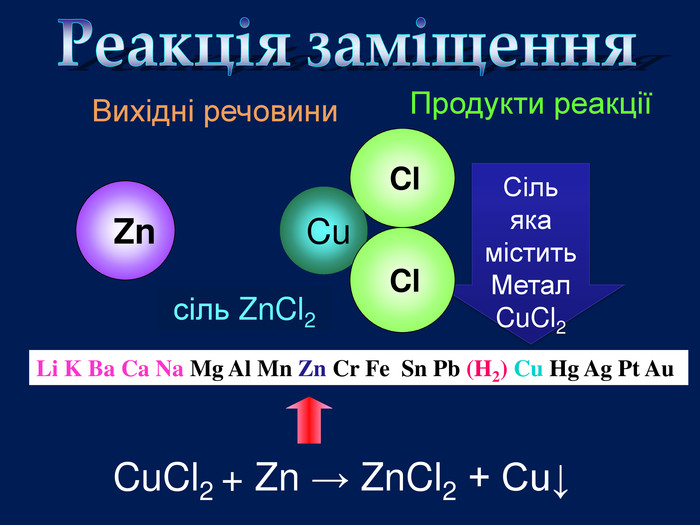
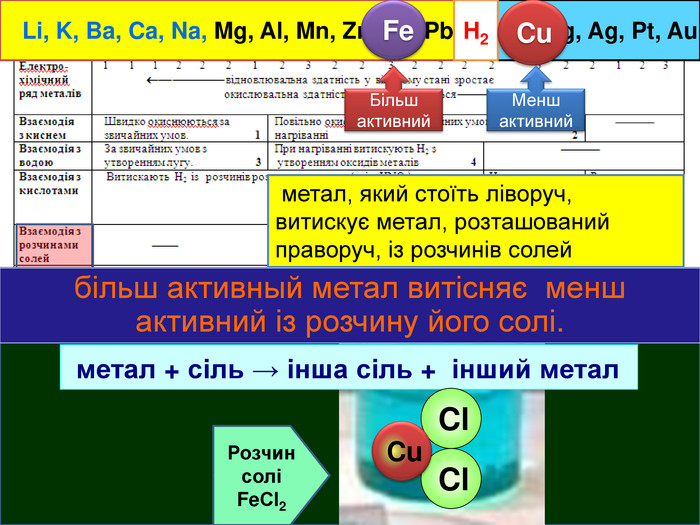
























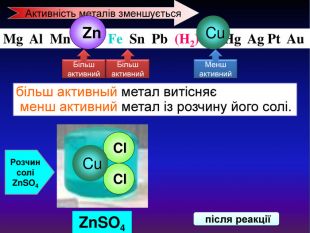
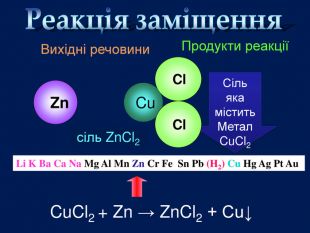
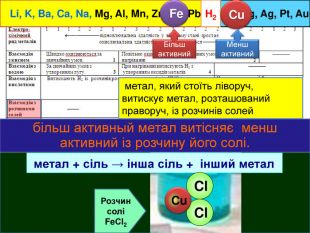
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb. Cu, Hg, Ag, Pt, Au. H2 метал, який стоїть ліворуч, витискує метал, розташований праворуч, із розчинів солей Cu. Меншактивний. Розчин соліCu. Сl2більш активный метал витісняє менш активний із розчину його солі. метал + сіль → інша сіль + інший метал Cl Cl Cu Fe. Розчин соліFe. Сl2 Більшактивний
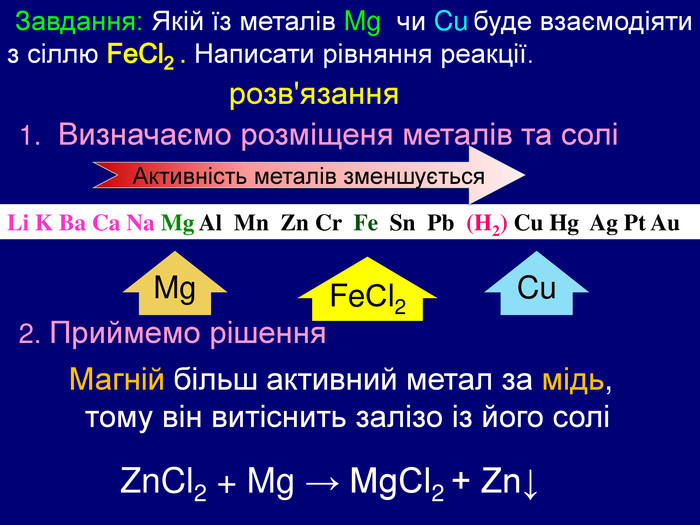
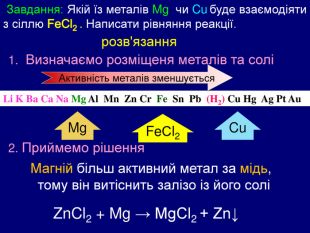
Завдання: Якій їз металів Mg чи Cu буде взаємодіяти з сіллю Fe. Cl2 . Написати рівняння реакції. Li K Ba Ca Na Mg Al Mn Zn Cr Fe Sn Pb (H2) Cu Hg Ag Pt Au Zn. Cl2 + Mg → Mg. Cl2 + Zn↓ розв'язання 1. Визначаємо розміщеня металів та солі Mg. Fe. Сl2 Cu Магній більш активний метал за мідь, тому він витіснить залізо із його соліАктивність металів зменшується 2. Приймемо рішення
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Sn Pb (H2) Cu Hg Ag Pt Au Sn Cl2 + Zn → Zn. Cl2 + Sn↓ розв'язання 1. Визначаємо розміщеня металів та солі Zn. Sn. Сl2 Cu Цинк більш активний метал за мідь, тому він витіснить олово із його соліАктивність металів зменшується Завдання: Якій із металів Zn чи Cu буде взаємодіяти з сіллю Sn. Cl2? Написати рівняння реакції.video 2. Приймемо рішення
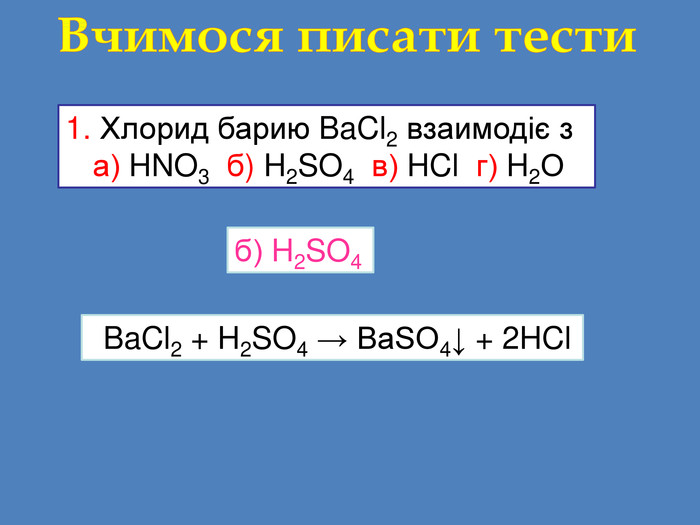
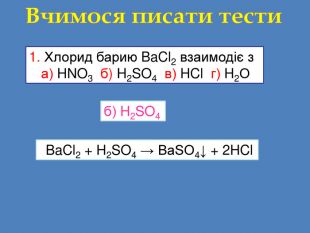
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Схема взаємодії кислота + сіль = кислота + сіль Складіть рівняння реакціїvideo Взаємодія солей з кислотами сульфатна кислотабарій сульфатбарій хлорид. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх Н2 SO4 + Ba. Cl2 = 2 НCl + Ba. SO4↓ Н2 SO4 Ba. Cl2 Ba. SO4
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції; кислота + сіль = сіль + кислотаvideo Взаємодія солей з кислотами натрій сульфат карбонова кислота хлоридна кислота. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх. Na2 СO3 + HCl = Na Cl + Н 2 СO3 Na2 СO3 HCl. Н 2 O СO2 Н 2 СO3
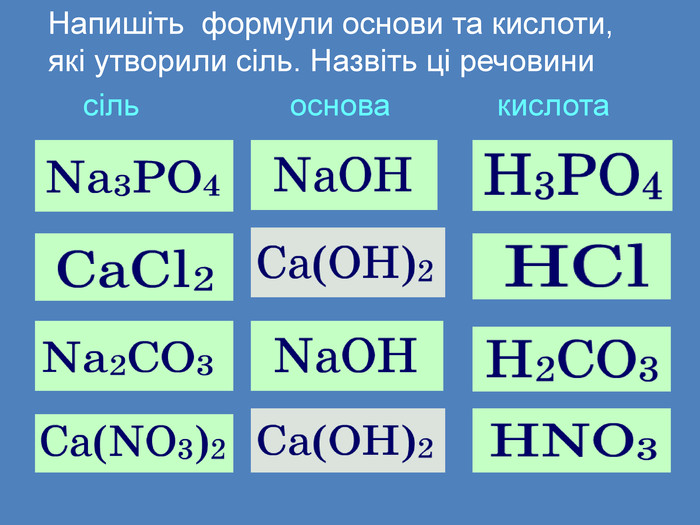
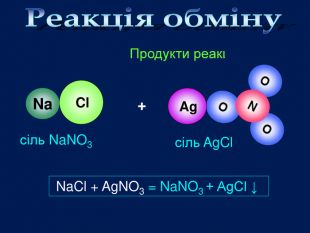
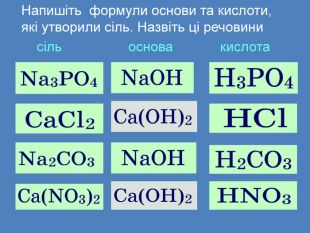
Солі взаємодіють з кислотами, утворюючи нову сіль і нову кислоту сіль + кислота → інша сіль + інша кислота Зверніть увагу!Реакція обміну протікає до кінця тільки в тому випадку, якщо утворюється осад (↓), чи виділяється газ (↑)Ag. NO3 + HCl → Ag. Cl↓ + HNO3 Ba. Cl2 + H2 SO4 → Ba. SO4↓ + 2 HCl. Na2 CO3 + 2 HCl → 2 Na. Cl + H2 CO3 H2 O CO2↑
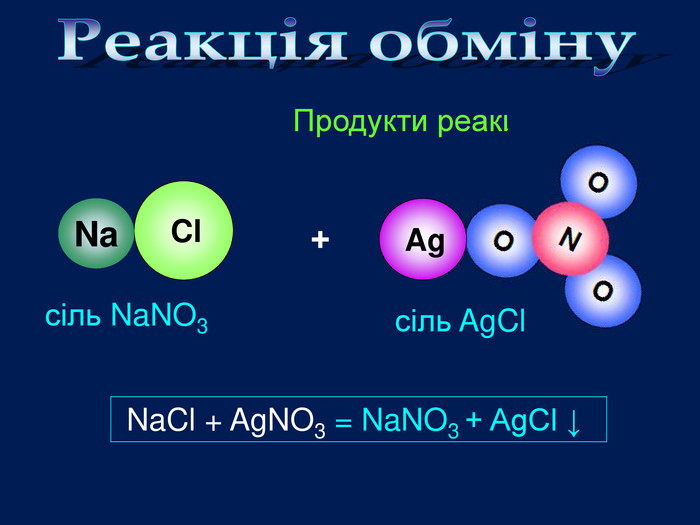
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Схема взаємодії кислота + сіль = кислота + сіль Складіть рівняння реакціїvideo Взаємодія солей з солями. Ва. Cl2 Ag. Cl. Ва. Cl2 + Ag. NO3 = Ва(NO3) 2 + Ag. Cl↓хлоридна кислотааргентум хлоридаргентум нітрат. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх. Ag. NO322
Cu. SO4 + 2 Na. OН = Взаємодія солей з лугамиvideo. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;купрум сульфат натрій гідроксид купрум гідроксид. Напишіть рівняння реакції Cu. SO4 Na. OНCu(OН)2 Na2 SO4 + Cu(OН)2↓
Солі взаємодіють з розчинами лугів, утворюючи нову сіль і основу сіль + луг → інша сіль + основа Зверніть увагу! * В реакцію вступають тільки розчинні солі та луги * Реакція протікає до кінца, якщо утворюється нерозчинна основа. (випадає в осад) Cu. SO4 + 2 Na. OH → Na2 SO4 + Cu(OH)2↓ Fe. Cl3 +3 KOH → 3 KCl + Fe(OH)3↓video
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції; Fe. SO4 + 2 Na. OН = Взаємодія солей з лугамиvideo. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх. Ферум сульфат натрій гідроксид ферум (ІІ) гідроксид. Напишіть рівняння реакціїNa2 SО4 + Fe(OН)2↓ Fe. SO4 Na. OНFe(OН)2↓
Fe. Cl3 + 3 Na. OН = Взамодія солей з лугамиvideo. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Ферум хлорид натрій гідроксид ферум (ІІІ) гідроксид. Напишіть рівняння реакції Fe(OН)3 + 3 Na. Cl Fe. Cl3 Na. OНFe(OН)3
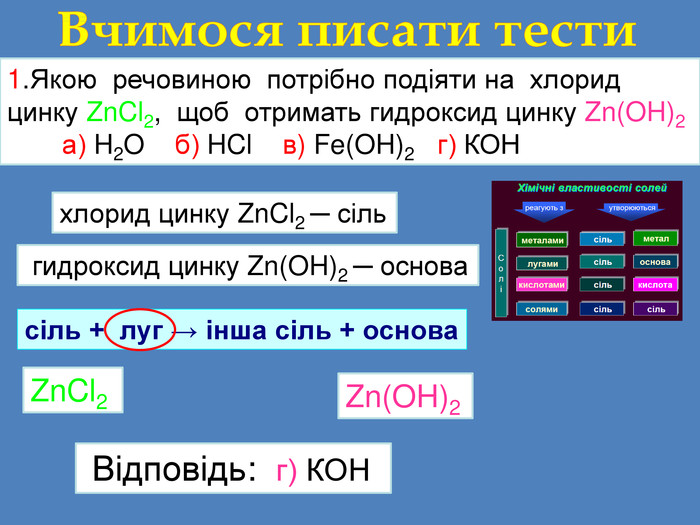
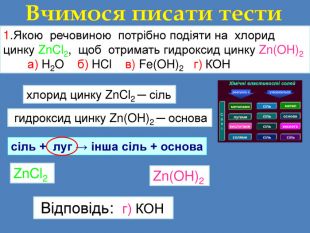
1. Якою речовиною потрібно подіяти на хлорид цинку Zn. Cl2, щоб отримать гидроксид цинку Zn(OH)2 а) H2 O б) HCl в) Fe(OH)2 г) КОНВчимося писати тести. Визначаємо речовини гидроксид цинку Zn(OH)2 ─ основа. Визначаємо схему реакціїсіль + луг → інша сіль + основа. Zn(OH)2 Zn. Cl2 Відповідь: г) КОНхлорид цинку Zn. Cl2 ─ сільr
Григорович О. В. Хімія.8 клас: Розробки уроків —Х.: Вид-во “Ранок”, 2008. Ярошенко О. Г. Хімія: підруч. для 8 кл. загальноосвіт. навч. закл. Освіта, 2008. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Хімія. 8 клас І. Ю. Старовойтова, О. В. Люсай. — X. : Вид. група «Основа», 2009. — 128 с. — (Серія «Мій конспект»). Джерела


про публікацію авторської розробки
Додати розробку































-

Полюга Уляна
08.09.2024 в 18:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юзьвяк Любов Михайлівна
10.04.2024 в 23:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
30.04.2023 в 22:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kuziv Yuliia
19.04.2021 в 01:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сакада Марина
11.04.2021 в 23:23
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ципльонок Валентина Володимирівна
30.03.2021 в 21:29
Велике спасибі за прекрасну роботу !
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гаврилюк Людмила Василівна
16.03.2021 в 21:57
дякую за чудову презентацію. хотіла б і сама навчитися такі робити
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Korotoshyn Romana
16.01.2021 в 20:09
Дякую за таку гарну презентацію.Все гарно виконано.Шкода,що не можу її зберегти.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Андрієвич Олена
23.04.2020 в 12:22
Ваші презентації чудові. Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гавдульська Ірина Ярославівна
17.04.2020 в 21:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Новикова Наталія Анатоліївна
14.04.2020 в 14:06
Дякую!Дуже гарна робота!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сало Оксана
06.04.2020 в 17:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костенко Тетяна Миколаївна
06.04.2020 в 15:22
Дякую за допомогу
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Макієнко Оксана Олексіївна
31.03.2020 в 21:23
Такої неймовірної насолоди від презентації ще ніколи не отримувала. Дивовижні спецефекти, матеріал підібраний на високому рівні!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бережна Тетяна Дмитрівна
15.04.2019 в 21:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Машков Вадим Віталійович
05.04.2018 в 00:02
Дуже гарна, змістовна і неймовірна презентація. Дякую!)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чернишева Вікторія Логвинівна
04.04.2018 в 22:05
Супер!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 14 відгуків