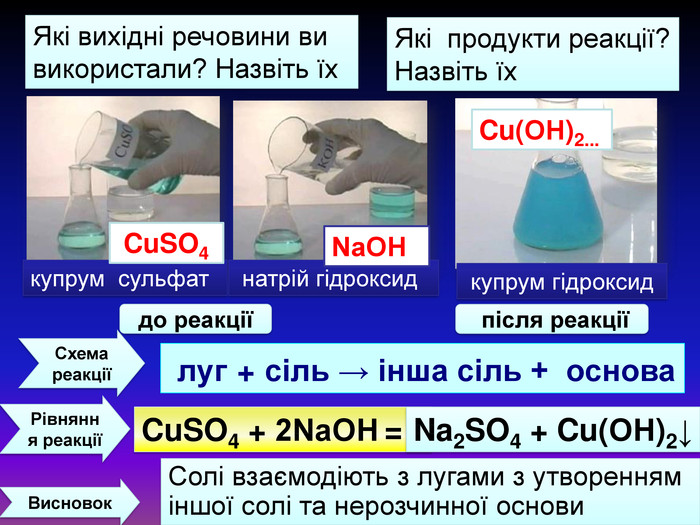
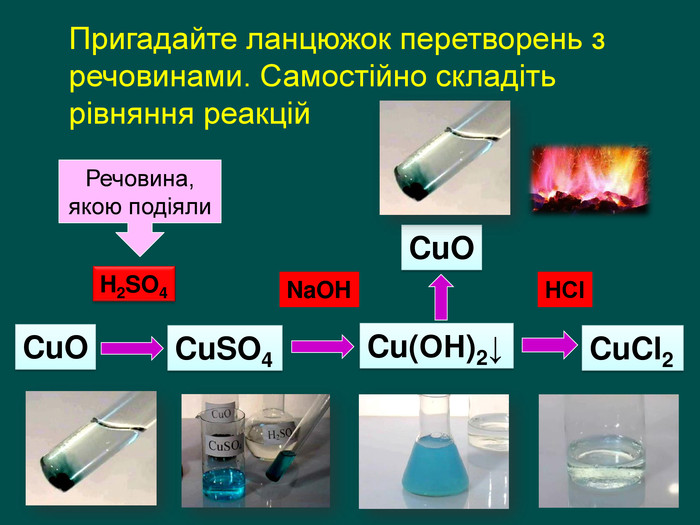
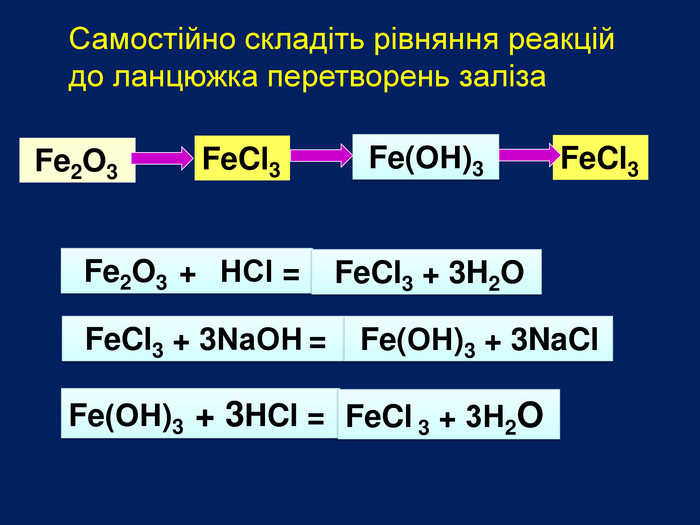
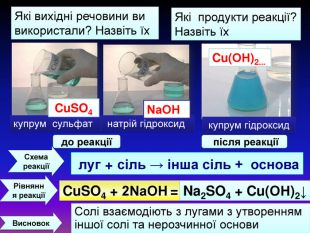
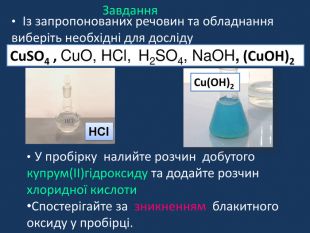
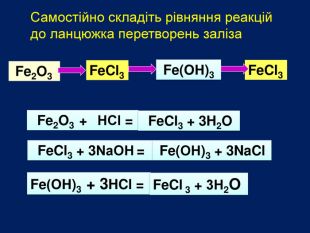
Презентація «Дослідження властивостей основних класів неорганічних сполук». 8 клас
Про матеріал
| Презентація допоможе в проведенні практичної роботи №2: «Дослідження властивостей основних класів неорганічних сполук.» |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку